江苏省南京市玄武区2022年中考一模化学试题
试卷更新日期:2022-05-13 类型:中考模拟
一、单选题
-
1. 下列物质中,常温下呈液态的是( )A、钢 B、汞 C、冰 D、氦2. 华夏造物历史悠久,《天工开物》中记载的下列造物过程涉及化学变化的是( )A、炼生铁 B、晒海盐 C、钉木舟 D、织衣布3. 下列属于复合肥料的是( )A、NH4H2PO4 B、NH4HCO3 C、Ca3(PO4)2 D、K2SO44. 下列物质与水混合,不可能形成溶液的是( )A、胆矾 B、纯碱 C、汽油 D、白醋5. 亚硝酸钠(NaNO2)是一种工业用盐,虽然有毒但也可以用作防腐剂。NaNO2中氮元素的化合价是( )A、+5 B、+3 C、+1 D、-36. 在“粗盐的初步提纯”实验中,下列操作正确的是()A、
 取用粗盐
B、
取用粗盐
B、 溶解粗盐
C、
溶解粗盐
C、 过滤粗盐水
D、
过滤粗盐水
D、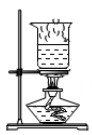 蒸干滤液
7. 下列物质的性质与用途具有对应关系的是( )A、氧气可支持燃烧,可用作燃料 B、活性炭具有吸附性,可用于净水 C、镁有银白色金属光泽,可用于制作烟花 D、氢氧化钠具有吸水性,可用作食品干燥剂8. 2022年2月4日,北京冬奥会火炬首次采用“绿氢”作为火炬燃料,其储存采用了高压储气的方式。下列关于该储气过程的说法正确的是( )
蒸干滤液
7. 下列物质的性质与用途具有对应关系的是( )A、氧气可支持燃烧,可用作燃料 B、活性炭具有吸附性,可用于净水 C、镁有银白色金属光泽,可用于制作烟花 D、氢氧化钠具有吸水性,可用作食品干燥剂8. 2022年2月4日,北京冬奥会火炬首次采用“绿氢”作为火炬燃料,其储存采用了高压储气的方式。下列关于该储气过程的说法正确的是( ) A、氢分子的体积变小 B、氢分子的质量变小 C、氢分子的数目变少 D、氢分子间的间隔变小9. 下列实验现象描述符合事实的是( )A、硫在空气中燃烧,发出蓝紫色火焰 B、无色酚酞溶液滴入稀盐酸中,溶液变红 C、黄铜片与铜片相互刻画,铜片上留有划痕 D、硝酸铵固体溶于适量水中后,溶液的温度升高10. 绿原酸(C16H18O9)被誉为“第七类营养素”,下列有关绿原酸的说法错误的是( )A、C16H18O9属于有机高分子化合物 B、C16H18O9的相对分子质量为354 C、C16H18O9完全燃烧可生成CO2和H2O D、C16H18O9分子中C,H,O的原子个数比为I6:18:911. 利用如图装置进行燃烧条件的探究(已知:白磷的着火点为40℃,红磷的着火点为240℃)。试管①③中充满氧气,试管②中充满氮气,升温至40℃,下列说法错误的是( )
A、氢分子的体积变小 B、氢分子的质量变小 C、氢分子的数目变少 D、氢分子间的间隔变小9. 下列实验现象描述符合事实的是( )A、硫在空气中燃烧,发出蓝紫色火焰 B、无色酚酞溶液滴入稀盐酸中,溶液变红 C、黄铜片与铜片相互刻画,铜片上留有划痕 D、硝酸铵固体溶于适量水中后,溶液的温度升高10. 绿原酸(C16H18O9)被誉为“第七类营养素”,下列有关绿原酸的说法错误的是( )A、C16H18O9属于有机高分子化合物 B、C16H18O9的相对分子质量为354 C、C16H18O9完全燃烧可生成CO2和H2O D、C16H18O9分子中C,H,O的原子个数比为I6:18:911. 利用如图装置进行燃烧条件的探究(已知:白磷的着火点为40℃,红磷的着火点为240℃)。试管①③中充满氧气,试管②中充满氮气,升温至40℃,下列说法错误的是( ) A、只有实验①中的白磷燃烧 B、由实验①②可验证燃烧需要氧气 C、由实验②③可验证红磷的着火点高于白磷 D、该实验中气球起缓冲试管内压强等作用12. 化学与生活关系密切,下列说法正确的是( )A、用灼烧法来鉴别羊毛织品和棉织品 B、用甲醛浸泡海鲜食品来延长其保鲜期 C、用燃着的火柴来检查液化石油气管道是否泄漏 D、用焚烧含氯塑料的方法来解决“白色污染”问题13. 物质甲、乙均可灭杀新型冠状病毒(2019-nCoV),图1是其灭杀过程中的反应示意图,转化Ⅱ中溶液的pH变化如图2所示。
A、只有实验①中的白磷燃烧 B、由实验①②可验证燃烧需要氧气 C、由实验②③可验证红磷的着火点高于白磷 D、该实验中气球起缓冲试管内压强等作用12. 化学与生活关系密切,下列说法正确的是( )A、用灼烧法来鉴别羊毛织品和棉织品 B、用甲醛浸泡海鲜食品来延长其保鲜期 C、用燃着的火柴来检查液化石油气管道是否泄漏 D、用焚烧含氯塑料的方法来解决“白色污染”问题13. 物质甲、乙均可灭杀新型冠状病毒(2019-nCoV),图1是其灭杀过程中的反应示意图,转化Ⅱ中溶液的pH变化如图2所示。

下列说法正确的是( )
A、转化I属于复分解反应 B、转化Ⅱ中氧元素的化合价没有发生变化 C、相同条件下戊的酸性比乙强 D、物质丙和丁的组成元素相同,所以它们的化学性质也相同14. 下列实验方案设计合理的是( )选项
实验目的
实验方案
A
检验CH4中混有H2
点燃,在火焰上方罩一干冷烧杯,观察现象
B
分离MnO2和KCl两种固体
加水溶解、蒸发、结晶、烘干
C
鉴别NH4Cl和NH4NO3两种固体
取样,加熟石灰混合研磨,闻气味
D
验证Fe、Cu、Ag三种金属的活动性强弱
将洁净的铜丝分别放入硝酸银溶液和硫酸亚铁溶液中,观察现象
A、A B、B C、C D、D15. 甲、乙、丙、丁、戊是五种物质,相连物质之间均能发生化学反应,且反应均属于基本反应类型。下列说法不符合图示要求的是( ) A、当甲为氧化铜时,戊可以为氢气,丁可以为氧化铁 B、当戊为氧气时,甲、乙、丙、丁可以为红磷、碳、甲烷、镁 C、当乙、丙、丁、戊分别为氧化物、碱、盐、酸时,甲可以为金属铁 D、当戊为铝时,甲、乙、丙、丁可以为氧气、硫酸铜溶液、硝酸银溶液、盐酸
A、当甲为氧化铜时,戊可以为氢气,丁可以为氧化铁 B、当戊为氧气时,甲、乙、丙、丁可以为红磷、碳、甲烷、镁 C、当乙、丙、丁、戊分别为氧化物、碱、盐、酸时,甲可以为金属铁 D、当戊为铝时,甲、乙、丙、丁可以为氧气、硫酸铜溶液、硝酸银溶液、盐酸二、填空题
-
16. 碳及其化合物与我们日常生活关系密切。(1)、下列含碳元素的物质中,属于有机化合物的是____(填字母)。A、甲烷 B、金刚石 C、干冰 D、乙醇(2)、下列属于合成纤维的是____(填字母)。A、蚕丝 B、尼龙 C、涤沦 D、棉花(3)、化学反应在生成新物质的同时,还伴随着能量的变化,请写出一个有二氧化碳生成的放热反应的化学方程式。(4)、“碳中和”的基本途径是“减排”(减少二氧化碳的排放)和“增汇”(增加对二氧化碳的吸收和转化)。常用的“减排”措施有:植树造林、等。将二氧化碳转化为甲醇(CH3OH),可有效实现“增汇”,在实际生产中甲醇的产率除了与温度、浓度、压强有关,还与催化剂质量分数有关,请根据如图说明甲醇的产率与CuO质量分数的关系是 , 生产前后CuO的化学性质。(填 “改变”或者“不改变”)。
 17. 水和溶液在生产、生活中具有广泛的用途。(1)、水是生命之源。河水、湖水、井水等天然水属于(填“纯净物”或“混合物”),常用的净水方法有吸附、沉降、过滤、蒸馏等,其中净水程度最高的是;检验某水样为硬水方法是。(2)、如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线,请回答下列问题:
17. 水和溶液在生产、生活中具有广泛的用途。(1)、水是生命之源。河水、湖水、井水等天然水属于(填“纯净物”或“混合物”),常用的净水方法有吸附、沉降、过滤、蒸馏等,其中净水程度最高的是;检验某水样为硬水方法是。(2)、如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线,请回答下列问题:
①t1℃时,将10克甲物质加入到25克水中,充分溶解后,所得溶液中溶质和溶剂的质量比是(写出最简整数比)。
②t2℃时,甲溶液的溶质质量分数与丙溶液的溶质质量分数相比,前者和后者的关系是(填字母)。
A.大于 B.等于 C.小于 D.无法确定
③将t2℃时等质量甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液的质量由大到小的顺序是。
三、综合题
-
18. 某兴趣小组的同学对硫酸的性质进行以下实验。
 (1)、用浓硫酸与蔗糖反应制“黑面包”。
(1)、用浓硫酸与蔗糖反应制“黑面包”。将适量的蔗糖(化学式:C12H22O11)放入烧杯中,加入几滴水,搅拌均匀:然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生有刺激性气味的气体,如图1所示。
①生成的黑色物质是(写名称),上述实验现象表明浓硫酸具有性。
②蔗糖属于六大基本营养素中的。
(2)、用稀硫酸(1:4)与锌反应制取氢气。【稀硫酸(1:4)是指浓硫酸(溶质的质量分数为98%,密度为1.84g/cm3)与水(密度为1g/cm3)按体积比1:4进行混合所得的硫酸.】
①配制稀硫酸(1:4)。实验步骤如下:
i.计算:配制该稀硫酸584克需浓硫酸mL。
ii.量取:用量筒量取所需的水,倒入烧杯中,另取一量筒,量取浓硫酸。
ⅲ.:在该过程中,不能将水直接倒入浓硫酸中进行稀释,其原因是。
ⅳ.将配制好的稀硫酸倒入试剂瓶中,盖好瓶塞并贴上标签。
②制取氢气。如用图2装置收集氢气时,发生装置应该与导管(填“a”或“b”)相连接。
③处理反应后的废液。若要除去废液中残余的H2SO4:得到硫酸锌溶液,请设计实验并完成下表。
实验步骤
实验现象
结论或解释(用化学方程式表示)
19. 碳酸锂是生产金属锂制品的基础材料,以阝-锂辉石为原料,用硫酸焙烧法制取碳酸锂的工艺流程(部分试剂和步骤等己略去)如图所示:
已知:锂元素在元素周明表中的位置和原子结构如图:
 (1)、锂元素和钠元素化学性质相似的原因是。(2)、阝-锂辉石中的锂元素(Li)以氧化物的形式存在,含有的主要杂质是氧化镁。写出“除镁”步骤中发生反应的化学方程式为。(3)、“沉锂”发生反应的化学方程式为。操作①的名称为。该操作后所得的母液为碳酸锂的(填“不饱和”或“饱和”)溶液。(4)、Li-SO2电池工作时的反应原理是锂与二氧化硫反应生成Li2S2O4。该电池工作过程中如有28克金属锂参加了反应,则同时消耗二氧化硫的质量是多少(写出计算过程)。20. A-J是初中化学常见的纯净物,且分别是由C、H、O、S、Na、Ca、Al、Cu、Cl中的一种或几种元素组成的。其中A、B、C、D、E分别为单质、氧化物、酸、碱、盐中的一种;H为氧化物且其中氧元素的质量分数为20%,A和G分别与足量的D反应的生成物相同,F可用于改良酸性土壤,I在空气中表面生成一层致密的氧化膜,阻止其进一步的氧化。图中“-”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系:部分反应物、生成物或反应条件己略去。
(1)、锂元素和钠元素化学性质相似的原因是。(2)、阝-锂辉石中的锂元素(Li)以氧化物的形式存在,含有的主要杂质是氧化镁。写出“除镁”步骤中发生反应的化学方程式为。(3)、“沉锂”发生反应的化学方程式为。操作①的名称为。该操作后所得的母液为碳酸锂的(填“不饱和”或“饱和”)溶液。(4)、Li-SO2电池工作时的反应原理是锂与二氧化硫反应生成Li2S2O4。该电池工作过程中如有28克金属锂参加了反应,则同时消耗二氧化硫的质量是多少(写出计算过程)。20. A-J是初中化学常见的纯净物,且分别是由C、H、O、S、Na、Ca、Al、Cu、Cl中的一种或几种元素组成的。其中A、B、C、D、E分别为单质、氧化物、酸、碱、盐中的一种;H为氧化物且其中氧元素的质量分数为20%,A和G分别与足量的D反应的生成物相同,F可用于改良酸性土壤,I在空气中表面生成一层致密的氧化膜,阻止其进一步的氧化。图中“-”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系:部分反应物、生成物或反应条件己略去。 (1)、写出化学式:H;G。(2)、写出D-I的反应的化学方程式。(3)、写出F→B的反应的化学方程式。21. 铁及其化合物在生活生产中应用非常广泛。某兴趣小组的同学对于碳酸亚铁的制取和相关性质进行探究。
(1)、写出化学式:H;G。(2)、写出D-I的反应的化学方程式。(3)、写出F→B的反应的化学方程式。21. 铁及其化合物在生活生产中应用非常广泛。某兴趣小组的同学对于碳酸亚铁的制取和相关性质进行探究。【查阅资料】
I.溶液pH大于8.8时,Fe2+可完全转化为Fe(OH)2沉淀。
II.FeCO3是白色固体,难溶于水,遇氧气、水会发生反应,生成Fe(OH)3;遇酸也会发生反应。
III.FeCl3溶液中滴加KSCN溶液,溶液会变为血红色,而FeCl2溶液中滴加KSCN溶液,溶液不变色。
【进行实验】
(1)、制取FeCO3。①兴趣小组的同学将已生锈的铁钉放入稀硫酸中除锈,该反应的化学方程式为。
②将除尽铁锈后的铁钉再放入足量的稀硫酸中,反应完成后发现溶液中有少量黑色固体出现,说明除锈后的铁钉属于(填“纯金属”或“合金”)。
③用上述溶液和pH=11.9的Na2CO3溶液反应制取FeCO3时,可能制得FeCO3的操作是(填字母)。
A.将少量的FeSO4溶液与大量的Na2CO3溶液同时加入到烧杯中,边加边搅拌
B.先将Na2CO3溶液加入烧杯中,再缓慢加入FeSO4溶液,边加边搅拌
C.先将FeSO4溶液加入烧杯中,再缓慢加入Na2CO3溶液,边加边搅拌
D.先将NaCO3溶液加入烧杯中,再加入过量稀盐酸,最后加FeSO4溶液,边加边搅拌
(2)、探究久置于潮湿空气中FeCO3的成分。实验I:
①取少量久置于潮湿空气中的FeCO3固体于试管中,加入足量的稀盐酸,观察到试管内 , 说明该固体中含有FeCO3。
②取少量上述反应后的溶液于试管中,进行了下一步实验操作,该操作是 , 可观察到 , 说明久置于空气中的FeCO3固体中还含有Fe(OH)3。
(3)、实验Ⅱ:该兴趣小组为进一步确定固体中FeCO3的质量分数,称取10.0g固体做了如下图所示的补充实验。

①装置A的分液漏斗中盛放的溶液可以为(填字母);装置C中盛放的溶液最合适的是(填字母)。
A.浓盐酸 B.稀硫酸 C.氢氧化钠溶液 D.氢氧化钙溶液
②反应结束后,继续通入一段时间N2的目的是。
③实验结束后,测得装置C和D共增重0.44g,则固体中FeCO3的质量分数为。
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要密封保存。