广东省广州市番禺区2022年中考一模化学试题
试卷更新日期:2022-05-10 类型:中考模拟
一、单选题
-
1. 空气是人类生产活动的重要资源。下列生产生活中用到的气体不是来自空气的是( )A、医疗急救用到的氧气 B、用于生产氮肥的氮气 C、用作农村燃料的沼气 D、制作试电笔用到的氖气2. 流溪河是城市饮用水的重要来源。下列说法正确的是( )A、过滤能使河水变成纯净水 B、加入絮凝剂明矾能进行杀菌消毒 C、河水中没有氧气 D、电解水得到的氧气和氢气的体积比是1:23. 下列物质的性质与用途均正确并相对应的是( )
性质
用途
A
铝在空气中与氧气反应生成致密氧化膜
铝合金用于制作卫生间的置物架
B
钨的导电性好
钨用于制作灯泡里的灯丝
C
CO2水溶液显酸性
CO2用作大棚蔬菜的气体肥料
D
氢氧化钠能够与酸反应
氢氧化钠用于改良酸性土壤
A、A B、B C、C D、D4. 下列描述正确的是( )A、基本营养素包括蛋白质、糖类、油脂、维生素和水五大类 B、天然橡胶为原料制成的乳胶枕芯不属于有机合成材料 C、土豆、米饭、黄瓜、花生油都是富含糖类的食物 D、“西气东输”的“气”是指氢气5. 下列关于碳和碳的氧化物的说法中,正确的是( )A、高温下,一氧化碳与氧化铁的反应属于置换反应 B、石墨有滑腻感、导电性、还原性和常温下化学性质稳定等性质 C、金刚石和石墨中原子排列方式相同 D、1g金刚石和1g石墨与氧气完全反应后生成的二氧化碳的质量不同6. 测定空气里氧气含量的实验装置和步骤如下:(已完成装置气密性检查)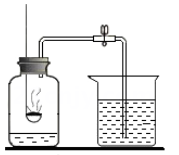
①在集气瓶内加入少量水,并将水面上方空间分为5等份;
②用弹簧夹夹紧胶皮管;
③点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧,观察现象;
④红磷熄灭后,立即打开弹簧夹,观察现象。
其中有错误的实验步骤是( )
A、① B、② C、③ D、④7. 如图为某反应的微观示意图,“ ”、“
”、“  ”各表示一种原子,下列说法错误的是( )
”各表示一种原子,下列说法错误的是( )  A、反应物是两种单质 B、反应物有剩余 C、该反应为化合反应 D、该反应生成了多种产物8. 氢氧化钙在生产和生活中有广泛的用途,下列关于氢氧化钙的认识错误的是( )A、生产:含氢氧化钙的废水用适量的Na2CO3溶液处理后可直接排放 B、性质:氢氧化钙溶液能与CO2、SO3等非金属氧化物反应 C、用途:氢氧化钙可用来配制波尔多液 D、组成:氢氧化钙溶液中含有Ca2+和OH-9. 卫星上使用Rb原子钟来计算时间,如图为Rb原子的结构示意图,从图中获得的信息错误的是( )
A、反应物是两种单质 B、反应物有剩余 C、该反应为化合反应 D、该反应生成了多种产物8. 氢氧化钙在生产和生活中有广泛的用途,下列关于氢氧化钙的认识错误的是( )A、生产:含氢氧化钙的废水用适量的Na2CO3溶液处理后可直接排放 B、性质:氢氧化钙溶液能与CO2、SO3等非金属氧化物反应 C、用途:氢氧化钙可用来配制波尔多液 D、组成:氢氧化钙溶液中含有Ca2+和OH-9. 卫星上使用Rb原子钟来计算时间,如图为Rb原子的结构示意图,从图中获得的信息错误的是( )Rb
 A、Rb原子有5个电子层,第一层有2个电子, 第三层有18个电子 B、Rb原子核外共有37个电子, 原子核内质子数和中子数之和是37 C、Rb原子不稳定,在化学反应中容易失去1个电子 D、Rb元素属于金属元素10. 实验室制取气体的常用装置如图,下列说法正确的是( )
A、Rb原子有5个电子层,第一层有2个电子, 第三层有18个电子 B、Rb原子核外共有37个电子, 原子核内质子数和中子数之和是37 C、Rb原子不稳定,在化学反应中容易失去1个电子 D、Rb元素属于金属元素10. 实验室制取气体的常用装置如图,下列说法正确的是( ) A、装置①可以较好地控制反应速率 B、装置①和④组合可以用来制取氧气 C、装置①和②组合可以用来制取氢气 D、装置③和④都可以用来收集二氧化碳11. 下列实验方案设计与结论均合理的是( )A、向氧化铁固体中滴入稀盐酸,能够发生反应但没有明显现象 B、用酚酰溶液能够区分NaOH溶液和Na2CO3溶液 C、向装有生锈铁片的试管中加入过量的稀盐酸,观察生锈铁片是否表面有气泡生成,以判断铁片是否完全生锈 D、向硫酸钠溶液中滴入氯化镁溶液,能够发生反应且有明显现象12. 25 ℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )
A、装置①可以较好地控制反应速率 B、装置①和④组合可以用来制取氧气 C、装置①和②组合可以用来制取氢气 D、装置③和④都可以用来收集二氧化碳11. 下列实验方案设计与结论均合理的是( )A、向氧化铁固体中滴入稀盐酸,能够发生反应但没有明显现象 B、用酚酰溶液能够区分NaOH溶液和Na2CO3溶液 C、向装有生锈铁片的试管中加入过量的稀盐酸,观察生锈铁片是否表面有气泡生成,以判断铁片是否完全生锈 D、向硫酸钠溶液中滴入氯化镁溶液,能够发生反应且有明显现象12. 25 ℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )编号
①
②
③
④
水的质量/g
50
50
50
50
加入固体质量/g
5
10
15
20
现象
固体完全溶解
固体完全溶解
剩余少量固体
剩余较多固体
A、实验①所得溶液质量分数为10% B、实验②说明25 ℃时该物质的溶解度是20g C、实验③④所得溶液质量分数相同 D、实验④所得溶液中含溶质20g13. 下列叙述正确的是( )A、乙硫醇(C2H5SH)再空气中完全燃烧可以生产二氧化碳、二氧化硫和水 B、实验室丢失标签的KCl、NaOH、CuSO4三瓶溶液,不用加其他试剂则无法鉴别 C、煤燃烧产生的二氧化碳和二氧化硫都是形成酸雨的污染物 D、向氧化铜粉末中滴加氢氧化钠溶液,固体溶解,溶液变成蓝色14. 下列实验中,根据实验现象可以得出相应的结论的是( )实验操作
现象
结论
A
将AgNO3溶液和CuSO4溶液分别加入两支装有铁钉的试管中
铁钉表面分别有灰黑色和红色固体析出
金属活动性强弱:Fe>Cu>Ag
B
把用砂纸打磨过的铝丝浸入CuSO4溶液中
蓝色溶液逐渐变浅
溶液中Cu2+减少
C
向K2CO3溶液中加入稀盐酸
有气泡产生
盐酸中HCl分子从溶液中挥发
D
点燃某无色气体,再火焰上方罩一个冷而干燥的烧杯
产生淡蓝色火焰,烧杯内壁有水珠
该无色气体为氢气
A、A B、B C、C D、D二、填空题
-
15. 2020年12月12日,国家主席习近平在气候峰会上发表的重要讲话中提到,中国 将釆取更加有力的政策和措施,力争在2030年前二氧化碳排放达到峰值,即“碳达峰”; 争取在2060年前实现“碳中和”(即通过植树造林、节能减排等形式,以抵消自身产生 的二氧化碳排放量,实现二氧化碳“零排放”)。我国对全世界宣布“碳中和”目标,彰显了大国的责任和担当。根据此材料,结合所学知识,回答以下问题:(1)、“碳”排放:
①化石燃料的燃烧是CO2排放的主要因素。化石燃料主要包括煤炭、和天然气。
②下列燃料在O2中燃烧时,不会产生CO2的是(填序号)。
A.天然气 B.氢气 C.腓(N2H4) D.石蜡(C19H40)
(2)、“碳"吸收。自然界有多种途径吸收CO2。①绿色植物通过作用吸收CO2。
②风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2该反应的化学方程式为。
③实验室用氧氧化钠溶液吸收CO2 , 用氢氧化钙溶液检验CO2的存在,吸收CO2时不用氢氧化钙的原因是。
(3)、“碳”利用。将CO2作为资源是实现碳中和的有效方法。以CO2和H2为原料,再一定条件下可以合成C2H6O,该产物C2H6O中,C、H、O的质量比为。16. 请回答下列问题。(1)、(一)盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。用质量分数为37%的浓盐酸配制1000 g质量分数为0.37% (pH值约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为 , 所需浓盐酸的质量为 。
②已知浓盐酸密度为1.19 g/cm3 , 量取上述所需浓盐酸需用到的仪器(填标号)。
A.10mL量筒 B.50mL量筒 C.试管 D.胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在上。
(2)、(二)甲、乙两位同学分别做酸和碱的中和反应实验:向烧杯中依次加入5mL稀氢氧化钠溶液和几滴酚酞溶液,溶液显红色,再用滴管慢慢滴入稀盐酸,不断搅拌溶液。甲同学滴入一定量盐酸后,红色溶液仍然没有褪去。同学甲因此认为试管中稀氢氧化钠和稀盐酸没有发生反应。你认为同学甲的结论(填:正确或不正确),请你设计实验方案支持你的观点:。
(3)、乙同学滴入一定量盐酸后,发现红色溶液恰好褪色,但由于乙同学有点紧张,手一抖,不小心多滴入了 2滴稀盐酸。此时,溶液中离子浓度顺序由大到小为: > >。三、综合题
-
17. 纯碱的用途非常广泛。我国制碱工业先驱侯德榜发明了“侯氏制碱法”,实现了工业制取纯碱,其模拟流程如图A:

【小资料】①通常情况下,1体积水中大约能溶解700体积氨气, 1体积水中大约能溶解1体积二氧化碳。
②饱和食盐水(溶液的温度控制为:30〜35℃ )中主要发生以下2个反应:
I. NH3 +CO2 +H2O=NH4HCO3、 II. NH4HCO3+NaCl=NaHCO3↓+NH4Cl
四种盐的溶解度随温度变化的曲线如图B所示。
 (1)、反应①的化学方程式为 , 反应②的基本反应类型是。(2)、操作a为 , 工业上常用分离液态空气的方法制取氮气,该过程属于变化。(填“物理”或“化学”)。(3)、为了提高产率,向饱和食盐水中通入CO2和NH3两种气体时应先通入其中一种气体,你 认为应该先通入的是(填"NH3”或“CO2”)。(4)、结合图B分析,饱和食盐水中发生反应II时析出NaHCO3晶体的主要原因_________(填序号)。A、溶剂质量减少 B、与其他三种物质相比,碳酸氢钠的溶解度最小,易达到饱和而析出 C、生成的碳酸氢钠的质量大于消耗的氯化钠的质量18. 金属锌在冶金、化学电源等方面具有重要作用。以闪锌矿(主要含ZnS,还含有SiO2和少量FeS、CdS、PbS等杂质)为原料制备金属锌的流程如图:
(1)、反应①的化学方程式为 , 反应②的基本反应类型是。(2)、操作a为 , 工业上常用分离液态空气的方法制取氮气,该过程属于变化。(填“物理”或“化学”)。(3)、为了提高产率,向饱和食盐水中通入CO2和NH3两种气体时应先通入其中一种气体,你 认为应该先通入的是(填"NH3”或“CO2”)。(4)、结合图B分析,饱和食盐水中发生反应II时析出NaHCO3晶体的主要原因_________(填序号)。A、溶剂质量减少 B、与其他三种物质相比,碳酸氢钠的溶解度最小,易达到饱和而析出 C、生成的碳酸氢钠的质量大于消耗的氯化钠的质量18. 金属锌在冶金、化学电源等方面具有重要作用。以闪锌矿(主要含ZnS,还含有SiO2和少量FeS、CdS、PbS等杂质)为原料制备金属锌的流程如图:
已知:常温下PbSO4难溶于水和稀硫酸。回答下列问题:
(1)、ZnS的名称是。(2)、“焙烧"过程中金属硫化物转化成金属氧化物,焙烧时ZnS发生反应的化学方程式是;焙烧尾气必须进行净化处理的原因是。(3)、“溶浸”产生的滤渣主要成分除了 SiO2外还有。(4)、“氧化除杂”的主要反应xFeSO4+4ZnO+O2+yH2O = 4Fe(OH)3+zZnSO4 , 则 x、y、 z依次是 。“电解”过程的反应为:2ZnSO4+2H2O 2Zn+O2 +2。(5)、“还原除杂”利用锌粉与CdSO4反应,其化学方程式为;已知Cd 放入盐酸中有气体产生,则Cd、Zn、Cu的金属活动性由强到弱的顺序为。(6)、某BaCO3中混有SiO2杂质,简述提纯该BaCO3的实验操作:。19. 有一包白色固体样品,可能含有NaCl、Na2CO3 , (NH4)2SO4、 BaCl2、Na2SO4中的一种或几种,为分析其组成,进行如下实验:①取适量样品与熟石灰混匀、研磨,没有任何异味产生。
②另取适量样品加入足量水,搅拌、静置、过滤,得到白色沉淀和无色滤液。
③取步骤②中的白色沉淀,加入过量稀盐酸,产生大量气泡,白色沉淀全部消失。
根据以上实验冋答F列问题:
(1)、样品中一定含有 , 一定不含有。(2)、步骤②中反应的化学方程式为。(3)、步骤②中的滤液,其组成有种可能,如要确定该滤液的组成,需要用到的一种试剂是 (填化学式)。20. 金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:物质
CoO
Co(OH)2
CoCl2
CoSO4
Co(NO3)2
CoCO3
在水中的溶解性
难溶于水的灰绿色固体
难溶于水的粉红色固体
易溶于水形成粉红色溶液
易溶于水形成粉红色溶液
易溶于水形成粉红色溶液
难溶于水的粉红色固体
(1)、A、根据金属化学性质的一般规律。下列预测合理的是___________。 B、钴能够与氢氧化钠溶液反应 C、H2或者CO能够将钴的氧化物转化为金属钴 D、钴能够与盐酸或者稀硫酸反应(2)、碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与(填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中。(3)、依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤
预期反应的化学方程式
预期反应的实验现象
(4)、从含钴的矿石中提取钴的工艺过程一般是会先用足量的酸进行酸浸,酸浸时,钴的氧化物发生如下反应:反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:(填化学符号)。
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为(用含b的式子表示)。