福建省泉州市洛江区初中学业质量检查化学试题
试卷更新日期:2022-05-10 类型:中考模拟
一、单选题
-
1. 下列生产工艺(或方法)中,没有化学变化发生的是( )A、粮食酿酒 B、纺纱织布 C、高炉炼铁 D、联合制碱2. 下列物质的用途主要与其化学性质有关的是( )A、石墨用作电极 B、二氧化碳能用于灭火 C、氯化钠溶液用于农业选种 D、活性炭用于净化水3. 下列举措中,与北京冬奥运“绿色办奥”理念不想符合的是( )A、独具特色的点火仪式,大火变“微火”的火炬 B、氢能点燃奥运主火炬“微火”照亮世界 C、氢能客车提供接驳服务,打造低碳交通体系 D、生活垃圾集中在露天焚烧或就地掩埋4. 如图是“实验室测定空气中氧气含量”的实验装置图,下列有关说法错误的是( )
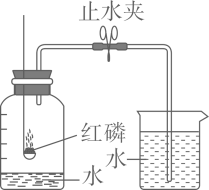 A、可用木炭代替红磷进行实验 B、做该实验前,应检查装置的气密性 C、待装置冷却至室温后才能打开止水夹 D、若红磷不足,将导致测得氧气的含量小于五分之一5. 维生素C(C6H8O6)主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素C的说法中错误的是 ( )A、维生素C是有机物 B、维生素C中氢元素的质量分数约是4.5% C、维生素C中含氢分子和氧分子的个数比是4:3 D、维生素C中C,H,O三种元素的质量比是9:1:126. LiFePO4新型锂离子电池以其独特的优势成为绿色能源的新宠,已知锂的化合价为+1价,P的化合价为+5,则LiFePO4中Fe的化合价是( )A、+2 B、0 C、+3 D、+67. “北斗”三号卫星导航系统应用了星载氢原子钟和铷原子钟。铷在元素周期表中的信息如图所示,下列有关铷的说法错误的是( )
A、可用木炭代替红磷进行实验 B、做该实验前,应检查装置的气密性 C、待装置冷却至室温后才能打开止水夹 D、若红磷不足,将导致测得氧气的含量小于五分之一5. 维生素C(C6H8O6)主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素C的说法中错误的是 ( )A、维生素C是有机物 B、维生素C中氢元素的质量分数约是4.5% C、维生素C中含氢分子和氧分子的个数比是4:3 D、维生素C中C,H,O三种元素的质量比是9:1:126. LiFePO4新型锂离子电池以其独特的优势成为绿色能源的新宠,已知锂的化合价为+1价,P的化合价为+5,则LiFePO4中Fe的化合价是( )A、+2 B、0 C、+3 D、+67. “北斗”三号卫星导航系统应用了星载氢原子钟和铷原子钟。铷在元素周期表中的信息如图所示,下列有关铷的说法错误的是( )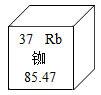 A、属于金属元素 B、Rb+核外电子数为36 C、原子核内有37个质子 D、相对原子质量为85.47g8. 下列对有关燃烧及灭火事例的解释错误的是( )A、炒菜时油锅着火,用锅盖盖灭——隔绝了空气 B、扑灭森林火灾时开辟隔离带——清除和隔离可燃物 C、秸秆失火,用水浇灭——降低了可燃物的着火点 D、木材架空后,燃烧会更剧烈——增大了可燃物与氧气的接触面积9. 下列各组括号内除杂质的方法或试剂错误的是( )A、CO2中混有CO(点燃) B、Cu粉中混有CuO(稀硫酸) C、CO中混有CO2 (氢氧化钠溶液) D、Cu粉中混有Fe粉(用磁铁吸引)10. 向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是( )
A、属于金属元素 B、Rb+核外电子数为36 C、原子核内有37个质子 D、相对原子质量为85.47g8. 下列对有关燃烧及灭火事例的解释错误的是( )A、炒菜时油锅着火,用锅盖盖灭——隔绝了空气 B、扑灭森林火灾时开辟隔离带——清除和隔离可燃物 C、秸秆失火,用水浇灭——降低了可燃物的着火点 D、木材架空后,燃烧会更剧烈——增大了可燃物与氧气的接触面积9. 下列各组括号内除杂质的方法或试剂错误的是( )A、CO2中混有CO(点燃) B、Cu粉中混有CuO(稀硫酸) C、CO中混有CO2 (氢氧化钠溶液) D、Cu粉中混有Fe粉(用磁铁吸引)10. 向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是( )选项
甲
乙
A.
铜、锌的混合物粉末
稀盐酸
B.
盐酸和稀硫酸的混合溶液
氯化钡溶液
C.
氯化钠和氯化钙的混合溶液
碳酸钠溶液
D.
盐酸和氯化铜的混合溶液
氢氧化钠溶液
 A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
11. 新能源(电动)汽车越来越受到老百姓的欢迎。请根据要求回答有关问题:
 (1)、在如图汽车的部件中,主要由合成材料制成的是(写出一个即可).(2)、在汽车的电路中,主要使用的是铜线,这是利用了铜的性。(3)、汽车表面的烤漆不仅美观,还能起到的作用。(4)、汽车在充电时,是将电能转化为能。(5)、汽车轮毅材料用铝合金而不用纯铝,其主要原因是。(6)、汽车制造需要大量铝、铁和铜等金属。工业上常用电解氧化铝的方法冶炼金属铝,该反应的化学方程式为。12. 我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。(1)、“碳”减排
(1)、在如图汽车的部件中,主要由合成材料制成的是(写出一个即可).(2)、在汽车的电路中,主要使用的是铜线,这是利用了铜的性。(3)、汽车表面的烤漆不仅美观,还能起到的作用。(4)、汽车在充电时,是将电能转化为能。(5)、汽车轮毅材料用铝合金而不用纯铝,其主要原因是。(6)、汽车制造需要大量铝、铁和铜等金属。工业上常用电解氧化铝的方法冶炼金属铝,该反应的化学方程式为。12. 我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。(1)、“碳”减排①化石燃料的燃烧是CO2排放的主要因素。化石燃料主要包括煤炭、石油和。
②下列对节能减排的建议可行的是(填字母)。
a.停止使用化石燃料 b.推广使用光伏发电
c.多骑共享单车出行 d.生活垃圾集中焚烧
(2)、“碳”捕捉。利用NaOH捕捉CO2 , 得到高纯度CO2的流程如图。
①捕捉室中加入的X溶液,X是(填化学式)。
②整个流程中可以循环使用的物质是。
(3)、“碳“利用。碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图所示:该反应的化学方程式为。 13. 水是一种宝贵的自然资源,我们应该了解水的净化和水资源的保护。(1)、自来水厂的净水流程一般包括:沉淀、过滤、、消毒等步骤。(2)、在日常生活中,可以用区别硬水和软水。(3)、漂白粉可用于自来水的杀菌消毒,其有效成分是次氯酸钙(化学式为Ca(ClO)2),次氯酸钙在空气中可发生如下反应: ,则X的化学式为。(4)、如图是甲、乙、丙三种物质的溶解度曲线。
13. 水是一种宝贵的自然资源,我们应该了解水的净化和水资源的保护。(1)、自来水厂的净水流程一般包括:沉淀、过滤、、消毒等步骤。(2)、在日常生活中,可以用区别硬水和软水。(3)、漂白粉可用于自来水的杀菌消毒,其有效成分是次氯酸钙(化学式为Ca(ClO)2),次氯酸钙在空气中可发生如下反应: ,则X的化学式为。(4)、如图是甲、乙、丙三种物质的溶解度曲线。
①t1℃时,甲和两种物质饱和溶液的溶质质量分数相等。
②t2℃时,向50克水中加入35克固体甲,得到溶液克。
③从甲、乙的混合物中分离提纯甲物质,一般采用的方法。
三、综合题
-
14. 某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:

回答下列问题:
(1)、步骤①和步骤②均用到的操作是。(2)、溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和(填离子符号)。(3)、已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:对应离子
Fe3+
Cu2+
Mg2+
开始沉淀时的pH
1.9
4.2
9.1
完全沉淀时的pH
3.2
6.7
11.1
步骤②加入熟石灰,调节溶液的pH范围为 , 固体C中所含成分的化学式为。
(4)、步骤③制得Mg(OH)2的化学方程式为。15. 如图所示,甲、乙、丙是初中化学常见的物质,图中“一”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去)。(微溶物视为可溶) (1)、乙的化学式为 , 丙所属的物质类别是。(2)、氢氧化钙在生活、生产中有广泛的用途,写出氢氧化钙的一种用途:。(3)、当甲为某种碱时,它与盐溶液反应能同时生成两种沉淀,写出该反应的化学方程式: , 该反应所属的基本类型是。16. 根据如图装置,结合所学化学知识回答问题。
(1)、乙的化学式为 , 丙所属的物质类别是。(2)、氢氧化钙在生活、生产中有广泛的用途,写出氢氧化钙的一种用途:。(3)、当甲为某种碱时,它与盐溶液反应能同时生成两种沉淀,写出该反应的化学方程式: , 该反应所属的基本类型是。16. 根据如图装置,结合所学化学知识回答问题。 (1)、写出图中仪器①的名称。(2)、实验室制取氧气的方法有多种方法,若用装置B装置制备氧气的化学方程式是;若用C装置收集氧气,“验满”的方法为。(3)、在实验室室可以用如热固体无水醋酸钠和固体碱石灰的方法制取甲烷。通常情况下,甲烷的密度比空气小,难溶于水,实验室制取甲烷选择的发生装置是(填字母)。若用F装置收集甲烷,气体应从端通入(填“a”或“b”)。17. 某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。请你参与学习并帮助填写空格(包括表中空格)。(1)、【实验准备】配制200克10%的NaOH溶液,需要蒸馏水毫升,氢氧化钠克。(2)、将浓硫酸稀释成稀硫酸。稀释浓硫酸的正确操作是。(3)、【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
(1)、写出图中仪器①的名称。(2)、实验室制取氧气的方法有多种方法,若用装置B装置制备氧气的化学方程式是;若用C装置收集氧气,“验满”的方法为。(3)、在实验室室可以用如热固体无水醋酸钠和固体碱石灰的方法制取甲烷。通常情况下,甲烷的密度比空气小,难溶于水,实验室制取甲烷选择的发生装置是(填字母)。若用F装置收集甲烷,气体应从端通入(填“a”或“b”)。17. 某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。请你参与学习并帮助填写空格(包括表中空格)。(1)、【实验准备】配制200克10%的NaOH溶液,需要蒸馏水毫升,氢氧化钠克。(2)、将浓硫酸稀释成稀硫酸。稀释浓硫酸的正确操作是。(3)、【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。【学生板演】该反应的化学方程式。
(4)、【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是。
(5)、【实验探究】丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
(6)、为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。实验方案
测溶液pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作



实验现象
试纸变色,对比比色卡,pH<7
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
(7)、【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出实验探究(6)中存在两处明显不正确,请大家反思。同学们经过反思发现了这两处不正确:①实验操作中的不正确是。
②实验方案中也有一个是错误的,错误的原因是。
(8)、【拓展应用】①大家一致认为实验后的废液不能直接排放,理由是(写一点)
②请设计一个实验方案从废液中得到Na2SO4固体(资料:H2SO4难分解、难挥发),该实验方案:。
四、计算题
-
18. 热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是CaCO3和Mg(OH)2 , 其它成分忽略不计)。某兴趣小组的同学为了探究水垢中CaCO3的含量,取10g水垢样品,向样品中加入足量的稀盐酸,其变化关系如图所示,试计算:
 (1)、生成二氧化碳的质量为克。(2)、该水垢样品中CaCO3的质量分数。
(1)、生成二氧化碳的质量为克。(2)、该水垢样品中CaCO3的质量分数。