山西省朔州市怀仁市2020-2021学年高一下学期期末考试化学试题
试卷更新日期:2022-05-09 类型:期末考试
一、单选题
-
1. 下列说法错误的是( )A、臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质 B、在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 C、抗坏血酸(即维生素C)是水果罐头中常用的抗氧化剂,是因为其具有氧化性 D、对废旧金属的回收和再利用是资源可持续发展的重要途径之一2. “液态阳光”是指由阳光、二氧化碳和水通过人工光合作用得到的绿色液态燃料。下列有关“液态阳光”的说法错误的是( )A、CO2和H2O转化为“液态阳光”过程中同时吸收能量 B、煤气化得到的水煤气合成的甲醇属于“液态阳光” C、“液态阳光”行动有利于可持续发展并应对气候变化 D、“液态阳光”有望解决全球化石燃料不断枯竭的难题3. 下列叙述错误的是( )A、乙醇可用作燃料,医疗上常用75%(体积分数)的乙醇溶液作消毒剂 B、橡胶硫化的过程中发生了化学反应 C、高分子材料中的有机物分子均呈链状结构 D、高分子材料能以石油、煤等化石燃料为原料进行生产4. 下列关于能源和作为能源的物质的叙述中,错误的是( )A、化石能源物质内部蕴藏着大量的能量 B、绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 C、物质的化学能可以在不同条件下转为热能、电能为人类所利用 D、吸热反应没有利用价值5. 下列有关化学用语表示正确的是( )A、四氯化碳分子空间充填模型:
 B、异丁烷分子球棍模型:
B、异丁烷分子球棍模型: C、C2H2的电子式:
C、C2H2的电子式: D、酯基:-COOR
6. 下列物质中,与化合物互为同系物的是( )A、 B、 C、 D、7. 下列关于硅单质及其化合物的说法正确的是( )
D、酯基:-COOR
6. 下列物质中,与化合物互为同系物的是( )A、 B、 C、 D、7. 下列关于硅单质及其化合物的说法正确的是( )①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A、①② B、②③ C、①④ D、③④8. 下列各组物质,只用水就可鉴别的是( )A、和 B、和 C、和 D、、、9. 在298K时,实验测得溶液中的反应:H2O2+2HI=2H2O+I2 , 在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500mol·L-1 , c(H2O2)=0.400mol·L-1时的反应速率为( )实验编号
1
2
3
4
5
c(HI)/mol·L-1
0.100
0.200
0.300
0.100
0.100
c(H2O2)/mol·L-1
0.100
0.100
0.100
0.200
0.300
v/mol·L-1·s-1
0.00760
0.0153
0.0227
0.0151
0.0228
A、0.0380mol·L-1·s-1 B、0.152mol·L-1·s-1 C、0.608mol·L-1·s-1 D、0.760mol·L-1·s-110. 锂海水电池在航海中有着重要应用,其示意图如图所示,电池反应为2Li+2H2O=2LiOH+H2↑。下列说法错误的是( ) A、金属镍作正极 B、金属锂发生氧化反应 C、可将化学能转化为电能 D、电子从锂电极经海水流向镍电极11. 下列叙述正确的是( )A、氯仿、四氯甲烷和苯是工业上重要的有机溶剂 B、、、、是同系物 C、烷烃分子中的碳原子与其它原子的结合方式是通过两个共价键 D、在一定条件下,可与、浓硫酸发生化学反应12. 用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2 , 其部分工艺流程如下:
A、金属镍作正极 B、金属锂发生氧化反应 C、可将化学能转化为电能 D、电子从锂电极经海水流向镍电极11. 下列叙述正确的是( )A、氯仿、四氯甲烷和苯是工业上重要的有机溶剂 B、、、、是同系物 C、烷烃分子中的碳原子与其它原子的结合方式是通过两个共价键 D、在一定条件下,可与、浓硫酸发生化学反应12. 用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2 , 其部分工艺流程如下:
下列说法错误的是( )
A、吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2=Ca(NO2)2+H2O B、将石灰乳改为澄清石灰水吸收效率将会增大 C、采用气液逆流接触有利于尾气中NO、NO2的充分吸收 D、若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高13. 科学佩戴口罩对防控新冠病毒疫情有重要作用,生产一次性医用口罩的主要原料为聚丙烯树脂。下列有关说法错误的是( )A、聚丙烯属于合成有机高分子材料 B、聚丙烯在自然环境中不易降解 C、聚丙烯能使酸性高锰酸钾溶液褪色 D、由丙烯制聚丙烯的反应类型为加聚反应14. 下列叙述正确的是( )A、乙醇在空气中燃烧生成和 , 说明乙醇分子中含有C、H、O三种元素 B、重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒 C、蔗糖、油脂、蛋白质水解的最终产物都可以发生银镜反应 D、用紫色石蕊溶液可以鉴别乙醇和乙酸15. 科学家已获得了气态N4分子,其结构为正四面体形(如图所示)。已知断裂1molN—N键吸收193kJ能量,断裂1molNN键吸收946kJ能量,下列说法正确的是( ) A、N4属于一种新型的化合物 B、N4(g)=4N(g)的过程中吸收772kJ能量 C、1molN4转化为N2时要吸收734kJ能量 D、N4和N2互为同素异形体,N4转化为N2属于化学变化16. 已知Fe3O4放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是( )A、Fe(NO3)x中的x为2 B、磁性氧化铁中的所有铁元素全部被氧化 C、将Fe2O3放入稀硝酸中会发生类似的反应 D、反应中每还原0.1mol氧化剂,就有0.3mol电子转移17. 如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )
A、N4属于一种新型的化合物 B、N4(g)=4N(g)的过程中吸收772kJ能量 C、1molN4转化为N2时要吸收734kJ能量 D、N4和N2互为同素异形体,N4转化为N2属于化学变化16. 已知Fe3O4放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是( )A、Fe(NO3)x中的x为2 B、磁性氧化铁中的所有铁元素全部被氧化 C、将Fe2O3放入稀硝酸中会发生类似的反应 D、反应中每还原0.1mol氧化剂,就有0.3mol电子转移17. 如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )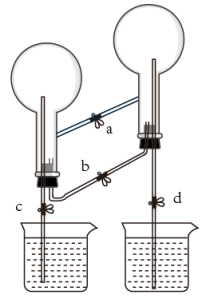 A、在实验室中,不能直接分解氯化铵制备氨气 B、在实验室中制备干燥的氨气和氯化氢时,不能都选用无水氯化钙作干燥剂 C、实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉 D、喷泉结束后,将烧瓶内溶液混合后得到氯化铵溶液,蒸干可得氯化铵固体18. 下列装置和原理能达到实验目的的是( )A、制取SO2:
A、在实验室中,不能直接分解氯化铵制备氨气 B、在实验室中制备干燥的氨气和氯化氢时,不能都选用无水氯化钙作干燥剂 C、实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉 D、喷泉结束后,将烧瓶内溶液混合后得到氯化铵溶液,蒸干可得氯化铵固体18. 下列装置和原理能达到实验目的的是( )A、制取SO2: B、验证SO2的漂白性
B、验证SO2的漂白性 C、实验室制备和分离乙酸乙酯
C、实验室制备和分离乙酸乙酯 D、SO2的尾气处理
D、SO2的尾气处理 19. 在一定温度时,将2molA和2molB放入容积为5L的某密闭容器中发生反应:2A(s)+2B(g)C(g)+2D(g),经5min后测得容器内B的浓度减少了0.2mol·L-1.下列叙述错误的是( )A、在5min内该反应用C的浓度变化表示的反应速率为0.02mol·L-1·min-1 B、5min时,容器内D的浓度为0.2mol·L-1 C、当容器内压强保持恒定时,该可逆反应达到平衡状态 D、5min时容器内气体总的物质的量为3mol20. 下列说法正确的是( )A、油脂都兼有酯和烯烃的一些化学性质 B、利用植物秸秆等生物质中的纤维素可以生产酒精,用作燃料 C、酸性既可以验证乙烷和乙烯,还可以除去乙烷中混有的乙烯 D、、、醋酸溶液与金属钠反应,产生的速率是依次增大21. 下列反应原理中,不符合工业冶炼金属实际情况的是( )A、 B、 C、 D、22. 已知某气态烃A在标准状况下的密度是 , 取在足量中充分燃烧,把燃烧后的产物全部通过浓 , 浓质量增加 , 再把剩余气体通过碱石灰,碱石灰质量增加 , 下列说法正确的是( )A、该烃的摩尔质量为72 B、该烃的分子式为 C、该烃分子中一个氢原子被溴原子取代后,可形成8种同分异构体 D、该烃化学性质稳定,不能发生氧化反应23. 下列做法不值得提倡的是( )A、选用一次性筷子、纸杯和塑料袋 B、选乘公共交通工具出行 C、选用回收废纸制造的纸箱 D、将废旧塑料制品制成再生制品24. 苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋的主要酸性成分苹果酸的结构简式为。下列说法错误的是( )A、苹果酸中含有的官能团名称是羟基和羧基 B、苹果酸与足量金属钠反应,能生成标准状况下氢气 C、苹果酸在一定条件下能与和发生酯化反应 D、苹果酸的分子式为
19. 在一定温度时,将2molA和2molB放入容积为5L的某密闭容器中发生反应:2A(s)+2B(g)C(g)+2D(g),经5min后测得容器内B的浓度减少了0.2mol·L-1.下列叙述错误的是( )A、在5min内该反应用C的浓度变化表示的反应速率为0.02mol·L-1·min-1 B、5min时,容器内D的浓度为0.2mol·L-1 C、当容器内压强保持恒定时,该可逆反应达到平衡状态 D、5min时容器内气体总的物质的量为3mol20. 下列说法正确的是( )A、油脂都兼有酯和烯烃的一些化学性质 B、利用植物秸秆等生物质中的纤维素可以生产酒精,用作燃料 C、酸性既可以验证乙烷和乙烯,还可以除去乙烷中混有的乙烯 D、、、醋酸溶液与金属钠反应,产生的速率是依次增大21. 下列反应原理中,不符合工业冶炼金属实际情况的是( )A、 B、 C、 D、22. 已知某气态烃A在标准状况下的密度是 , 取在足量中充分燃烧,把燃烧后的产物全部通过浓 , 浓质量增加 , 再把剩余气体通过碱石灰,碱石灰质量增加 , 下列说法正确的是( )A、该烃的摩尔质量为72 B、该烃的分子式为 C、该烃分子中一个氢原子被溴原子取代后,可形成8种同分异构体 D、该烃化学性质稳定,不能发生氧化反应23. 下列做法不值得提倡的是( )A、选用一次性筷子、纸杯和塑料袋 B、选乘公共交通工具出行 C、选用回收废纸制造的纸箱 D、将废旧塑料制品制成再生制品24. 苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋的主要酸性成分苹果酸的结构简式为。下列说法错误的是( )A、苹果酸中含有的官能团名称是羟基和羧基 B、苹果酸与足量金属钠反应,能生成标准状况下氢气 C、苹果酸在一定条件下能与和发生酯化反应 D、苹果酸的分子式为二、填空题
-
25.(1)、正丁烷与异丁烷互为同分异构体的依据是。(2)、乙烯与加成,乙烯使酸性溶液褪色的原因是 , 工业上制取乙醇的化学方程式是。(3)、将下端绕成螺旋状的铜丝在酒精灯外焰上灼烧,铜丝表面会变黑。反应的化学方程式为;将表面变黑的铜丝灼烧后立即插入盛有无水乙醇的试管中,可以看到乙醇沸腾,铜丝表面恢复红亮。反应的化学方程式为;上述实验操作反复几次后,可以闻到有刺激性气味的物质生成。反应的总的化学方程式为。铜是该反应的 , 原因是。26. 医药、食品添加剂等属于精细化学品。生产精细化学品已经成为当代化学工业结构调整的重点之一、科学、安全、有效和合理地使用化学品是每一位生产者和消费者的要求和责任。回答下列问题:(1)、向食品中加入调味剂,能改善或改变食品的口味,下列不属于调味剂的是(填字母)。
a.食盐 b.辣椒粉 c.小苏打 d.谷氨酸钠
(2)、由于人们的年龄阶段、工作环境及地方性营养状况等的特殊要求,需要在食品中加入营养强化剂,以补充必要的营养成分。下列不属于营养强化剂的是(填字母)。A焦糖色 b.铁强化酱油中的乙二胺四乙酸铁钠
c.碘酸钾 d.苯甲酸钠
(3)、某抗酸药每片含有 , 。该抗酸药发挥药效时的离子方程式是 , 服用抗酸药时,一般要嚼碎后吞服,原因是。(4)、阿司匹林的结构简式如图1所示,若口服阿司匹林后,在胃肠酶的作用下,阿司匹林与水发生水解反应,生成和两种物质。其中A的结构简式如图2所示,则B的结构简式为。阿司匹林跟同时服用,可使上述水解产物A与反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是(已知A中羟基不与反应)。 27. 燃煤排放的尾气中含有二氧化硫、氮氧化物(主要为 NO)等污染物,工业上采用不同的方法脱硫脱硝。(1)、工业用NaClO溶液脱硫脱硝,SO2和NO转化率分别达到100%和92.4%。
27. 燃煤排放的尾气中含有二氧化硫、氮氧化物(主要为 NO)等污染物,工业上采用不同的方法脱硫脱硝。(1)、工业用NaClO溶液脱硫脱硝,SO2和NO转化率分别达到100%和92.4%。①用NaClO溶液吸收燃煤排放的尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO与NO反应生成Cl-和 , 其离子方程式为。
②相对于SO2 , NO更难脱除,其原因可能是(填字母)。
a.该条件下 SO2的氧化性强于NO
b.燃煤排放的尾气中 NO 的含量多于SO2
c.相同条件下SO2在水溶液中的溶解性强于NO
③NO转化率随溶液pH变化如下图所示。NO中混有SO2能提高其转化率,其原因可能是。
 (2)、工业上把尾气与氨气混合,通过选择性催化剂,使NO被氨气还原为氮气,SO2 吸附在催化剂表面;当催化剂表面SO2达到饱和后,进行催化剂再生同时产生亚硫酸铵而脱硫。
(2)、工业上把尾气与氨气混合,通过选择性催化剂,使NO被氨气还原为氮气,SO2 吸附在催化剂表面;当催化剂表面SO2达到饱和后,进行催化剂再生同时产生亚硫酸铵而脱硫。①NO脱除的化学反应方程式为。
②工业上催化剂再生采取的措施为。
(3)、电子束尾气处理技术是用电子束照射含有水蒸气和空气的尾气,产生强活性O把NO和SO2氧化而除去。在实际处理中需向尾气中通入一定量氨气,这样处理得到的产物为和 (填化学式)。(4)、通过NOx传感器可监测NOx的含量,其工作原理如下图所示。
①NiO电极上发生反应(填“氧化”或“还原”)。
②写出Pt电极上的电极反应式。
28.(1)、I.某工厂排放的废水中含有、、、等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
完成步骤Ⅳ实验操作中的蒸发结晶需要选择下图的仪器是(其它仪器已选好,填序号),请设计一种检验绿矾是否变质的方法:。
 (2)、步骤Ⅲ的实验装置如下图所示,加热装置应与装置(填“甲”“乙”或“丙”)连接。
(2)、步骤Ⅲ的实验装置如下图所示,加热装置应与装置(填“甲”“乙”或“丙”)连接。 (3)、利用氧化铜制取铜有如下四种方案:
(3)、利用氧化铜制取铜有如下四种方案:方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉,过滤,将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案(填“甲”“乙”或“丙”,下同)不好;从产品纯度考虑,方案不好。方案丁不存在上述问题。
(4)、II.溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。目前,人们主要从海水和盐湖水中提取溴。下图是海水提溴工艺流程示意图:
回答下列问题:
工业上常用的一种海水提溴的技术叫做“吹出法”,其过程主要包括氧化、吹出、吸收、等环节。
(5)、吸收塔中的吸收率可达 , 吸收塔中主要反应的离子方程式是。(6)、蒸馏塔溶液中的浓度比吹出塔溶液中的浓度(填“高”“相等”或“低”)。