山西省吕梁市2020-2021学年高一下学期期末考试化学试题
试卷更新日期:2022-05-09 类型:期末考试
一、单选题
-
1. 化学与生产、生活等密切相关,下列说法正确的是( )A、糖类、油脂、蛋白质在一定条件下均能发生水解反应 B、硫酸钙属于常见的食品添加剂中的营养强化剂 C、葡萄酒中添加适量的 , 可以起到杀菌和抗氧化的作用 D、绿色食品就是不施用化肥、农药,不含任何化学物质的食品2. 正确掌握化学用语是学好化学的基础,下列有关化学用语表示正确的是( )A、乙烯的结构简式: B、羟基的电子式为:
 C、乙醇的分子式:
D、甲烷分子的空间充填模型
C、乙醇的分子式:
D、甲烷分子的空间充填模型 3. 下列反应是吸热反应的是( )A、
3. 下列反应是吸热反应的是( )A、 B、
B、 C、
C、 D、
D、 4. 下列离子方程式书写正确的是( )A、溶液中加入过量NaOH溶液: B、向稀硝酸中加入过量铁粉: C、将通入到溶液中: D、氢氧化钡溶液与稀硫酸反应:5. 下列说法正确的是( )A、甲烷与氯气在光照条件下反应后的混合气体能使湿润的蓝色石蕊试纸变红 B、
4. 下列离子方程式书写正确的是( )A、溶液中加入过量NaOH溶液: B、向稀硝酸中加入过量铁粉: C、将通入到溶液中: D、氢氧化钡溶液与稀硫酸反应:5. 下列说法正确的是( )A、甲烷与氯气在光照条件下反应后的混合气体能使湿润的蓝色石蕊试纸变红 B、 和
和 互为同分异构体
C、石油的分馏、煤的气化、液化、干馏等过程均为化学变化
D、塑料、橡胶和纤维都是天然高分子材料
6. 乙酸乙酯广泛用于药物、燃料和香料等工业。实验室可用乙醇、乙酸和浓硫酸按照如图装置制备乙酸乙酯(沸点77.2℃),下列有关说法错误的是( )
互为同分异构体
C、石油的分馏、煤的气化、液化、干馏等过程均为化学变化
D、塑料、橡胶和纤维都是天然高分子材料
6. 乙酸乙酯广泛用于药物、燃料和香料等工业。实验室可用乙醇、乙酸和浓硫酸按照如图装置制备乙酸乙酯(沸点77.2℃),下列有关说法错误的是( ) A、浓硫酸能加快酯化反应的速率 B、仪器a的下端管口可以伸入到液面以下 C、分离饱和碳酸钠溶液和乙酸乙酯的方法是蒸馏 D、使用水浴加热可以提高反应物的利用率,增加乙酸乙酯的产率7. 等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是( )A、
A、浓硫酸能加快酯化反应的速率 B、仪器a的下端管口可以伸入到液面以下 C、分离饱和碳酸钠溶液和乙酸乙酯的方法是蒸馏 D、使用水浴加热可以提高反应物的利用率,增加乙酸乙酯的产率7. 等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是( )A、 B、
B、 C、
C、 D、
D、 8. 中国化学家研究出一种新型复合光催化剂(C3N4/CQDs)可以利用太阳光高效分解水,其原理如下图所示。下列说法错误的是( )
8. 中国化学家研究出一种新型复合光催化剂(C3N4/CQDs)可以利用太阳光高效分解水,其原理如下图所示。下列说法错误的是( ) A、使用该光催化剂,提高了化学反应速率,实现了太阳能向化学能的转化 B、反应Ⅰ中涉及到非极性键的断裂和极性键的形成 C、反应Ⅱ中既做氧化剂又做还原剂 D、总反应的化学方程式为9. 下列实验现象与实验操作不相匹配的是( )
A、使用该光催化剂,提高了化学反应速率,实现了太阳能向化学能的转化 B、反应Ⅰ中涉及到非极性键的断裂和极性键的形成 C、反应Ⅱ中既做氧化剂又做还原剂 D、总反应的化学方程式为9. 下列实验现象与实验操作不相匹配的是( )选项
实验操作
实验现象
A
向盛有酸性高锰酸钾溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B
将镁条点燃后迅速伸入集满的集气瓶
集气瓶中产生浓烈的白烟并有黑色颗粒产生
C
将新制与葡萄糖溶液混合加热
产生砖红色沉淀
D
向盛有鸡蛋清溶液的试管中滴入几滴浓硝酸
试管中产生黄色沉淀
A、A B、B C、C D、D10. 某有机化合物的结构简式如图所示,下列有关该有机物的叙述正确的是( ) A、该有机物的分子式为 B、该有机物能使酸性溶液褪色的官能团有:碳碳双键、苯环和羟基 C、该有机物最多消耗Na与 的物质的量之比为1∶1 D、该有机物在一定条件下可以发生加聚反应,生成高分子化合物11. 下列有关金属的工业制法中,正确的是( )A、制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 B、制镁:用海水为原料,经一系列过程制得氧化镁固体,还原得镁 C、制铁:以铁矿石、焦炭为原料,用焦炭经一系列反应产生的CO还原得铁 D、制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融氯化铝得到铝12. 下列物质中可一次性鉴别乙酸、乙醇、和氢氧化钡溶液的是( )
A、该有机物的分子式为 B、该有机物能使酸性溶液褪色的官能团有:碳碳双键、苯环和羟基 C、该有机物最多消耗Na与 的物质的量之比为1∶1 D、该有机物在一定条件下可以发生加聚反应,生成高分子化合物11. 下列有关金属的工业制法中,正确的是( )A、制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 B、制镁:用海水为原料,经一系列过程制得氧化镁固体,还原得镁 C、制铁:以铁矿石、焦炭为原料,用焦炭经一系列反应产生的CO还原得铁 D、制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融氯化铝得到铝12. 下列物质中可一次性鉴别乙酸、乙醇、和氢氧化钡溶液的是( )①金属钠 ②溴水 ③碳酸钠溶液 ④紫色石蕊溶液
A、①② B、①③ C、②③ D、③④13. 如图所示,将液体A逐滴加入到固体B中。下列叙述正确的是( ) A、若A为浓硝酸,B为 , C中溶液出现白色沉淀,则非金属性: B、若A为浓盐酸,B为 , 则C中KI淀粉溶液变为蓝色 C、若A为浓氨水,B为氢氧化钠固体,则C中溶液先产生白色沉淀后沉淀又溶解 D、若A为浓硫酸,B为 , 则C中品红溶液变为无色14. 肼()空气燃料电池是一种新型环保型燃料电池,如图所示,电池可以用固体氧化物作电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是( )
A、若A为浓硝酸,B为 , C中溶液出现白色沉淀,则非金属性: B、若A为浓盐酸,B为 , 则C中KI淀粉溶液变为蓝色 C、若A为浓氨水,B为氢氧化钠固体,则C中溶液先产生白色沉淀后沉淀又溶解 D、若A为浓硫酸,B为 , 则C中品红溶液变为无色14. 肼()空气燃料电池是一种新型环保型燃料电池,如图所示,电池可以用固体氧化物作电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是( ) A、a电极上的电极反应式为 B、电流流向:a电极→用电器→b电极 C、当a电极上消耗时,b电极上被还原的在标准状况下的体积为11.2L D、由b电极通过固体氧化物电解质移向a电极15. 硝酸铜是制备系催化剂的重要原料,现用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述正确的是( )A、消耗硝酸的量:③①② B、③对环境造成的危害最小,符合绿色化学的理念 C、因为铜与浓硝酸反应的速度最快,故制取硝酸铜的最佳方案是① D、三种途径所消耗的铜的质量不相等16. 在实验室中模拟工业上以钛铁矿(主要成分为 , 含杂质)为原料制取偏钛酸的流程如图。
A、a电极上的电极反应式为 B、电流流向:a电极→用电器→b电极 C、当a电极上消耗时,b电极上被还原的在标准状况下的体积为11.2L D、由b电极通过固体氧化物电解质移向a电极15. 硝酸铜是制备系催化剂的重要原料,现用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述正确的是( )A、消耗硝酸的量:③①② B、③对环境造成的危害最小,符合绿色化学的理念 C、因为铜与浓硝酸反应的速度最快,故制取硝酸铜的最佳方案是① D、三种途径所消耗的铜的质量不相等16. 在实验室中模拟工业上以钛铁矿(主要成分为 , 含杂质)为原料制取偏钛酸的流程如图。
已知:向钛铁矿中加入硫酸得到硫酸氧钛(),硫酸氧钛在加热的条件下水解得到偏钛酸,偏钛酸为难溶于水的白色沉淀。
下列叙述错误的是( )
A、中,Ti的化合价为+4价 B、过量试剂A为铁粉,仅起还原浸出液中的作用 C、操作②主要是蒸发浓缩、冷却结晶、过滤 D、硫酸氧钛水解的离子方程式为:二、实验题
-
17. 是硫元素的重要化合物,在生产、生活中有着广泛的应用,但是有毒,是形成酸雨的主要气体。请完成下列与有关的问题。(1)、Ⅰ.某实验小组设计了如下图的装置制取和验证的性质。

实验室可用铜与浓硫酸反应制取 , 请写出装置中发生反应的化学方程式。
(2)、实验时C装置中观察到的现象是。(3)、实验时D装置中氯水褪色,请设计实验检验实验后D装置中硫元素的存在形式(请写出实验操作、现象和结论)。(4)、E装置中球形干燥管的作用是。(5)、上述实验体现的性质有。(6)、Ⅱ.利用石灰乳除工业燃煤尾气中硫的氧化物(、)的工艺如图所示,该工艺既能净化尾气,又能获得应用广泛的。尾气中与石灰乳、空气反应生成的化学方程式为。 18. 海洋中蕴含丰富的资源,溴元素主要以的形式存在于海水中,海水呈弱碱性。工业上从淡化海水中提取溴的工艺流程如图:
18. 海洋中蕴含丰富的资源,溴元素主要以的形式存在于海水中,海水呈弱碱性。工业上从淡化海水中提取溴的工艺流程如图:
资料:常温下溴呈液态,红棕色,易挥发。
(1)、步骤Ⅰ中氧化 , 宜在(选填“酸性”或“碱性”)条件下进行。(2)、步骤Ⅱ中可用热空气吹出,其原因是 , 吹出的用溶液吸收时,被氧化和被还原的的物质的量之比是。(3)、步骤Ⅲ中用酸化含、的溶液得到 , 发生反应的离子方程式为。(4)、探究(3)中所用的浓度对的生成的影响,实验如下:序号
A
B
试剂组成
溶液溶液
溶液溶液
实验现象
无明显现象
溶液呈红棕色,放热
①B中溶液呈红棕色说明产生。
②酸化含、的溶液宜选用的是(选填“稀硫酸”或“浓硫酸”)。
(5)、步骤Ⅲ的蒸馏过程中,温度应控制在80~90℃,请解释温度不能过高的原因。19. A的产量是衡量一个国家石油化工发展水平的标志,B和D是生活中两种常见的有机物,都可以通过粮食进行发酵酿造,H是高分子化合物。相关转化关系如图所示。 (1)、A分子的电子式为;D中官能团的名称为。(2)、在反应①~⑧中,属于取代反应的是(填序号)。(3)、写出下列反应的化学方程式:
(1)、A分子的电子式为;D中官能团的名称为。(2)、在反应①~⑧中,属于取代反应的是(填序号)。(3)、写出下列反应的化学方程式:反应②。
反应⑦。
(4)、Ⅰ是A的一种同系物,但比A多一个碳原子,写出Ⅰ与氯化氢的反应产物的结构简式。(5)、F是一种速效局部冷冻麻醉剂,可由反应⑤或⑥制备,请指出哪一个反应制备较好?(填序号),并说明理由。(6)、若148gB和120gD充分反应生成了88gG,该反应的产率为。20. 对于一个可逆反应不仅要考虑反应的快慢还要考虑反应的限度,化学反应不仅存在物质间的转化还存在能量间的转化。请回答下列有关化学反应的问题。(1)、Ⅰ.已知反应 , 某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。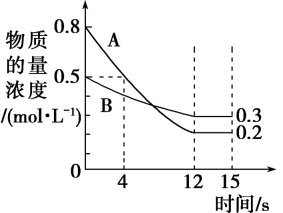
从反应开始到12s时,用A表示的反应速率为。
(2)、经测定,前4s内 , 则该反应的化学方程式为。(3)、若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲: , 乙: , 丙:。则甲、乙、丙三个容器中反应速率由快到慢的顺序为。(4)、判断该反应达到平衡状态的依据是____(填字母序号)。A、该条件下,正、逆反应速率都为零 B、该条件下,混合气体的密度不再发生变化 C、该条件下,混合气体的压强不再发生变化 D、容器内分子数不再发生变化(5)、Ⅱ.某甲醛气体探测仪利用燃料电池工作原理对甲醛含量进行检测,电池结构如图所示。
a电极上发生的反应类型为反应(选填“氧化”或“还原”)。
(6)、探测仪工作时,电子从(选填“a”或“b”)极流出,a电极的电极反应式为。(7)、如果在外电路中有1mol电子发生转移,则检测出标准状况下甲醛的体积为L。