山西省吕梁市2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2022-05-09 类型:期末考试
一、单选题
-
1. 化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是( )A、84消毒液具有强氧化性,可用于居家环境杀菌消毒 B、加强生活垃圾分类与再生资源回收有利于践行“绿水青山就是金山银山”的理念 C、中国华为自主研发的5G芯片巴龙5000的主要材料是Si D、太阳能光催化环境技术技术可以将二氧化碳转化为燃料,该燃料属于一次能源2. 下列关于有机化合物的说法错误的是( )A、乙烯和苯中均含有碳碳双键 B、植物油含不饱和高级脂肪酸酯,能使Br2的CCl4 , 溶液褪色 C、乙酸乙酯中混有的少量乙酸,可用饱和Na2CO3溶液除去 D、用酒精消毒,其原理是酒精使细菌的蛋白质变性而失去生理活性3. 设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )A、22.4 L Cl2中含有NA个Cl2分子 B、1 L 0.1 mol·L-1 Na2SO4溶液中有0.1NA个Na+ C、1 mol H2与1 mol Cl2反应生成NA个HCl分子 D、1 mol Ca变成Ca2+时失去的电子数为2NA4. 分类是学习和研究化学的一种重要方法,下列分类合理的是( )A、K2CO3和K2O都属于钾盐 B、H2SO4和HNO3都属于酸 C、KOH和Na2CO3都属于碱 D、Na2O和Na2CO3都属于氧化物5. 下列化学实验操作或事故处理方法,正确的是( )A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒回试剂瓶中 B、Ba(NO3)2溶于水,可将含有Ba(NO3)2的溶液倒入水槽中,再用水冲入下水道 C、酒精灯着火时应立即用湿抹布扑盖 D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸6. 下列实验内容可以达到预期实验目的的是( )A、将木炭与浓硫酸共热,得到的气体通入澄清石灰水检验木炭的氧化产物是CO2 B、加入足量铁屑,充分反应后过滤,除去FeCl2溶液中的少量FeCl3 C、将1 mol CuSO4·5H2O溶解在1L水中配制1mol/L的CuSO4溶液 D、将SO2通入酸性KMnO4溶液中证明SO2具有漂白性7. 下列各组离子,在溶液中能大量共存的是( )A、H+、Na+、OH-、NO B、Na+、Fe3+、NO、Cl- C、NH、H+、HCO、SO D、Ag+、Ca2+、CO、SO8. 下列离子方程式中,正确的是( )A、碳酸氢铵溶液中加入足量氢氧化钠: B、碳酸钙加入过量盐酸中: C、金属钠与水反应: D、铜与浓硝酸反应:9. 下列表示物质结构的化学用语正确的是( )A、8个中子的碳原子的核素符号:12C B、HF的电子式:
 C、CO2的结构式:O=C=O
D、Cl-离子的结构示意图:
C、CO2的结构式:O=C=O
D、Cl-离子的结构示意图: 10. 下列措施中,能加快化学反应速率的是( )A、食物存储在冰箱里 B、铁制品表面刷油漆 C、用5%H2SO4溶液代替25%H2SO4溶液与锌粒反应 D、用过氧化氢溶液制氧气时添加少量二氧化锰粉末11. 合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g) NH3(g),当正、逆反应速率相等且不等于零时,下列说法错误的是( )A、N2、H2完全转化为NH3 B、N2、H2、NH3在容器中共存 C、反应已达到化学平衡状态 D、N2、H2、NH3的浓度不再改变12. 在一定条件下,对于密闭容器中进行的可逆反应:N2 + 3H22NH3 , 下列说法中,能充分说明这一反应已经达到化学平衡状态的是( )A、N2、H2与NH3的物质的量之比为1︰3︰2 B、N2、H2与NH3的浓度相等 C、各组分的浓度不再发生变化 D、反应停止,正、逆反应速率都等于零13. 下列关于浓HNO3与浓H2SO4的叙述正确的是 ( )A、都具有脱水性 B、在加热条件下都能与碳反应 C、露置于空气中都能形成白雾 D、在空气中长期露置,溶液质量均减轻14. 下列各组反应中,所得产物相同的是( )A、金属铜与浓硝酸或稀硝酸反应 B、钠在常温或加热条件与氧气反应 C、铁在少量氧气或过量的氧气中点燃 D、氯化铝溶液与少量氢氧化钠溶液或过量氢氧化钠溶液反应15. 关于下图所示装置,下列说法正确的是( )
10. 下列措施中,能加快化学反应速率的是( )A、食物存储在冰箱里 B、铁制品表面刷油漆 C、用5%H2SO4溶液代替25%H2SO4溶液与锌粒反应 D、用过氧化氢溶液制氧气时添加少量二氧化锰粉末11. 合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g) NH3(g),当正、逆反应速率相等且不等于零时,下列说法错误的是( )A、N2、H2完全转化为NH3 B、N2、H2、NH3在容器中共存 C、反应已达到化学平衡状态 D、N2、H2、NH3的浓度不再改变12. 在一定条件下,对于密闭容器中进行的可逆反应:N2 + 3H22NH3 , 下列说法中,能充分说明这一反应已经达到化学平衡状态的是( )A、N2、H2与NH3的物质的量之比为1︰3︰2 B、N2、H2与NH3的浓度相等 C、各组分的浓度不再发生变化 D、反应停止,正、逆反应速率都等于零13. 下列关于浓HNO3与浓H2SO4的叙述正确的是 ( )A、都具有脱水性 B、在加热条件下都能与碳反应 C、露置于空气中都能形成白雾 D、在空气中长期露置,溶液质量均减轻14. 下列各组反应中,所得产物相同的是( )A、金属铜与浓硝酸或稀硝酸反应 B、钠在常温或加热条件与氧气反应 C、铁在少量氧气或过量的氧气中点燃 D、氯化铝溶液与少量氢氧化钠溶液或过量氢氧化钠溶液反应15. 关于下图所示装置,下列说法正确的是( ) A、该装置能将电能转化为化学能 B、电子由铜片通过导线流向铁片 C、铁片上发生的反应为Cu2+ + 2e- = Cu D、负极上发生的是氧化反应16. 有关Na、Mg两种元素的性质叙述正确的是( )A、金属性:Na<Mg B、原子半径:Na>Mg C、单质的还原性:Na<Mg D、最高价氧化物对应水化物的碱性:NaOH<Mg(OH)217. 短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族。Z的气态氢化物为M,0.01mol·L-1的M溶液的pH=2.R、X、Z能组成一种化合物,其球棍模型如图所示。下列说法错误的是( )
A、该装置能将电能转化为化学能 B、电子由铜片通过导线流向铁片 C、铁片上发生的反应为Cu2+ + 2e- = Cu D、负极上发生的是氧化反应16. 有关Na、Mg两种元素的性质叙述正确的是( )A、金属性:Na<Mg B、原子半径:Na>Mg C、单质的还原性:Na<Mg D、最高价氧化物对应水化物的碱性:NaOH<Mg(OH)217. 短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族。Z的气态氢化物为M,0.01mol·L-1的M溶液的pH=2.R、X、Z能组成一种化合物,其球棍模型如图所示。下列说法错误的是( ) A、原子半径:Y>Z>X>R B、R与X能形成多种共价化合物 C、Z的含氧酸酸性一定比X的强 D、工业上电解熔融YZ化合物制备Y的单质18. 下列对化学反应中能量变化的说法正确的是( )A、化学反应中一定伴有能量变化 B、钠与水的反应是吸热反应 C、放热反应发生时不必加热 D、Ba(OH)2·8H2O 与NH4Cl的反应是放热反应19. 可用于辐照育种。下列关于的说法正确的是( )A、质子数为82 B、中子数为55 C、质量数为137 D、核外电子数为8220. 下列各组物质互为同分异构体的是( )A、O2和O3 B、正戊烷和异戊烷 C、和 D、12C和14C21. 下列说法正确的是( )A、分子通式为CnH2n+2的烃可以是烷烃,也可能是烯烃 B、甲烷中混有乙烯,可以用酸性高锰酸钾溶液进行洗气 C、戊烷的同分异构体有三个 D、与钠反应的剧烈程度:乙酸>乙醇>水22. 下列实验装置或操作不能达到实验目的的是( )
A、原子半径:Y>Z>X>R B、R与X能形成多种共价化合物 C、Z的含氧酸酸性一定比X的强 D、工业上电解熔融YZ化合物制备Y的单质18. 下列对化学反应中能量变化的说法正确的是( )A、化学反应中一定伴有能量变化 B、钠与水的反应是吸热反应 C、放热反应发生时不必加热 D、Ba(OH)2·8H2O 与NH4Cl的反应是放热反应19. 可用于辐照育种。下列关于的说法正确的是( )A、质子数为82 B、中子数为55 C、质量数为137 D、核外电子数为8220. 下列各组物质互为同分异构体的是( )A、O2和O3 B、正戊烷和异戊烷 C、和 D、12C和14C21. 下列说法正确的是( )A、分子通式为CnH2n+2的烃可以是烷烃,也可能是烯烃 B、甲烷中混有乙烯,可以用酸性高锰酸钾溶液进行洗气 C、戊烷的同分异构体有三个 D、与钠反应的剧烈程度:乙酸>乙醇>水22. 下列实验装置或操作不能达到实验目的的是( )



A 制氨气
B 收集氧气
C 除去水中泥沙
D 分离乙醇和水
A、A B、B C、C D、D23. 下列“实验结论”与“实验操作及现象”不相符的一组是( )选项
实验操作及现象
实验结论
A
把一小块钠放入水中,立刻熔成小球
该反应是放热反应
B
向某溶液中加入AgNO3溶液,产生白色沉淀
该溶液中一定含有Cl-
C
向NaHCO3溶液中滴入酚酞溶液,溶液颜色变红
NaHCO3溶液显碱性
D
向某溶液中加入NaOH溶液,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色
该溶液中一定含有Fe2+
A、A B、B C、C D、D二、综合题
-
24. 化学是一门以实验为基础的自然科学,实验是科学探究的重要途径。请填写下列空白:利用如图所示的A装置制取、收集氨气,用B装置探究氨气的某些性质。
 (1)、A装置中制取氨气的化学方程式为;A装置收集氨气时采用向下排空气法,说明氨气的密度比空气的密度 (选填“大”或“小”)。(2)、B装置中的两个集气瓶中分别装有氯化氢气体和氨气,当抽去中间的玻璃片时,可观察到的实验现象是。(3)、下图装置是研究Cl2的性质。
(1)、A装置中制取氨气的化学方程式为;A装置收集氨气时采用向下排空气法,说明氨气的密度比空气的密度 (选填“大”或“小”)。(2)、B装置中的两个集气瓶中分别装有氯化氢气体和氨气,当抽去中间的玻璃片时,可观察到的实验现象是。(3)、下图装置是研究Cl2的性质。
①观察到B中的现象是 。
②C中反应后的溶液遇淀粉变蓝,说明Cl2与KI溶液反应生成的物质有。
③D中NaOH溶液的作用是。
④A、B中现象不同,其原因是。
25. 某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeSO4 , 其流程如下: (1)、“酸溶”时,提高反应速率的措施有(写一条)。(2)、加入Fe粉还原后,检验Fe3+是否反应完全的试剂为。(3)、写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式:。26. 氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中显示出良好的应用前景。回答下列问题:(1)、下列N原子电子排布图表示的状态中,能量最低和最高的分别为、。(填标号)
(1)、“酸溶”时,提高反应速率的措施有(写一条)。(2)、加入Fe粉还原后,检验Fe3+是否反应完全的试剂为。(3)、写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式:。26. 氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中显示出良好的应用前景。回答下列问题:(1)、下列N原子电子排布图表示的状态中,能量最低和最高的分别为、。(填标号)A.
 B.
B.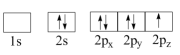
C.
 D.
D.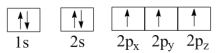 (2)、N3-与Na+具有相同的电子构型,r(N3-)大于r(Na+),原因是。(3)、Ca3(PO4)2在食品工业中用作抗结剂、营养增补剂,Ca3(PO4)2中的阴离子空间构型是 , 中心原子P的杂化形式为。Ca3(PO4)2中,存在(填标号)。
(2)、N3-与Na+具有相同的电子构型,r(N3-)大于r(Na+),原因是。(3)、Ca3(PO4)2在食品工业中用作抗结剂、营养增补剂,Ca3(PO4)2中的阴离子空间构型是 , 中心原子P的杂化形式为。Ca3(PO4)2中,存在(填标号)。A离子键 B.σ键 C.π键 D.氢键
(4)、受民间中医启发,科研工作者发现As2O3(俗称砒霜,或写作As4O6)对白血病有明显的治疗作用。As4O6的分子结构如1所示,则在该化合物中As原子的杂化轨道数目为 , As原子的第一电离能(填“>”“=”或“<”)O原子的第一电离能。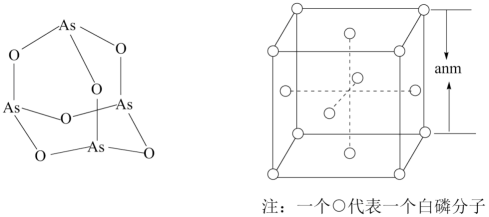 (5)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示。已知晶胞参数为anm,阿伏加德罗常数的数值为NA , 则P4的密度为(列出计算式)g·cm-3。27. 铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。(1)、按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于区。(2)、Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ , 请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别 , Mn2+的半径Fe3+的半径(选填”>”、”<”或“=”)。(3)、金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为(用含π的式子表示)。(4)、向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的【Fe(SCN)(H2O)5】2+。N、H、O三种元素的电负性由大到小的顺序为。【Fe(SCN)(H2O)5】2+中Fe3+的配位数为。H2O中氧原子的杂化方式为。(5)、二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2 , 可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则C5H的大π键表示为 , 二茂铁为黄色针状晶体,熔点173℃(在100℃时开始升华),沸点249℃,水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是(填标号)。
(5)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示。已知晶胞参数为anm,阿伏加德罗常数的数值为NA , 则P4的密度为(列出计算式)g·cm-3。27. 铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。(1)、按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于区。(2)、Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ , 请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别 , Mn2+的半径Fe3+的半径(选填”>”、”<”或“=”)。(3)、金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为(用含π的式子表示)。(4)、向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的【Fe(SCN)(H2O)5】2+。N、H、O三种元素的电负性由大到小的顺序为。【Fe(SCN)(H2O)5】2+中Fe3+的配位数为。H2O中氧原子的杂化方式为。(5)、二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2 , 可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则C5H的大π键表示为 , 二茂铁为黄色针状晶体,熔点173℃(在100℃时开始升华),沸点249℃,水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是(填标号)。
A.离子键B.配位键C.δ键D.范德华力
28. 下列是有机化合物A的转化过程: (1)、若D在一定条件下可以被氧化为B,则A的结构简式 , A水解的化学方程式为。(2)、若B能发生银镜反应,C不能发生消去反应,则A的结构简式为。(3)、若B、D均不能发生银镜反应,则A可能的结构简式为。(写出1个)(4)、若Z与A为不同类别的同分异构体,并且具有下列性质;
(1)、若D在一定条件下可以被氧化为B,则A的结构简式 , A水解的化学方程式为。(2)、若B能发生银镜反应,C不能发生消去反应,则A的结构简式为。(3)、若B、D均不能发生银镜反应,则A可能的结构简式为。(写出1个)(4)、若Z与A为不同类别的同分异构体,并且具有下列性质;①Z不能与NaHCO3溶液反应
②Z不能使溴水褪色;
③1molZ与足量金属钠反应可以生成1molH2;
④Z在光照条件下与氯气取代所得一氯取代物只有两种(不考虑立体异构现象)。则Z的结构简式为。
29. 芳纶可以制成防弹衣、防弹头盔、防弹装甲等,对位芳纶纤维J(聚对苯二甲酰对苯二胺)是重要的国防军工材料。化合物A、乙烯、苯制备J的一种合成路线如下:
回答下列问题:
(1)、A的化学名称为。(2)、A→B的反应类型是。(3)、实验室由苯制备F所需试剂、条件分别为。(4)、G中官能团的名称是。(5)、E与I反应生成J的化学方程式为。(6)、写出与D互为同分异构体的只含酯基的结构简式(核磁共振氢谱为四组峰,峰面积比为2:2:1:1。(7)、参照上述合成路线,以1,3-戊二烯和丙烯为原料(无机试剂任选),设计制备邻苯二甲酸的合成路线。