山东省泰安市2022届高三二轮验收考试化学试题
试卷更新日期:2022-05-09 类型:高考模拟
一、单选题
-
1. 科技创新让2022年北京冬奥会举世瞩目。对下列科技创新所涉及的化学知识判断正确的是( )A、颁奖礼服内添加了石墨烯发热材料,石墨烯和C60是同位素 B、冬奥火炬“飞扬”使用氢气作为燃料,氢气属于一次能源 C、速滑竞赛服使用聚氨酯材料可减少空气阻力,聚氨酯是高分子材料 D、制造速滑馆冰面采用的超临界二氧化碳与普通二氧化碳化学性质不同2. 《物理小识》中对镀金法有如下叙述:“以汞和金涂银器上,成白色,入火则汞去,而金存,数次即黄。”其中“入火则汞去”是指( )A、蒸发 B、升华 C、分液 D、分馏3. W、X、Y、Z是原子序数依次增大的短周期主族元素,原子序数总和为25,Y是地壳中含量最多的元素,由这四种元素形成的某化合物的结构如图所示。下列叙述正确的是( )
 A、原子半径大小:Z>Y>X>W B、该化合物具有强氧化性,用于消毒杀菌 C、X可与Y形成XY、XY2等共价化合物 D、W分别与X、Y、Z形成的化合物所含化学键类型相同4. 科学家利用辣椒素(结构简式如图)来识别皮肤神经末梢中对热有反应的感受器。有关辣椒素的叙述正确的是 ( )
A、原子半径大小:Z>Y>X>W B、该化合物具有强氧化性,用于消毒杀菌 C、X可与Y形成XY、XY2等共价化合物 D、W分别与X、Y、Z形成的化合物所含化学键类型相同4. 科学家利用辣椒素(结构简式如图)来识别皮肤神经末梢中对热有反应的感受器。有关辣椒素的叙述正确的是 ( ) A、含有5种官能团 B、所有碳原子可能在同一平面 C、既能与NaOH反应,又能与H2SO4反应 D、1 mol该物质和溴水反应时,最多可消耗4 mol Br25. 下列有关海水综合利用的离子方程式错误的是( )A、海水提镁中用石灰乳沉镁: B、海水提溴中用水溶液富集溴: C、氯碱工业中电解饱和食盐水: D、侯氏制碱法中获取碳酸氢钠:6. 下列说法正确的是( )A、NCl3分子的极性比PCl3的大 B、
A、含有5种官能团 B、所有碳原子可能在同一平面 C、既能与NaOH反应,又能与H2SO4反应 D、1 mol该物质和溴水反应时,最多可消耗4 mol Br25. 下列有关海水综合利用的离子方程式错误的是( )A、海水提镁中用石灰乳沉镁: B、海水提溴中用水溶液富集溴: C、氯碱工业中电解饱和食盐水: D、侯氏制碱法中获取碳酸氢钠:6. 下列说法正确的是( )A、NCl3分子的极性比PCl3的大 B、 中,①②键长不相同
C、NO的空间构型为三角锥形
D、基态原子中,4s电子能量较高,总是在比3s电子离核更远的地方运动
7. 下列实验结果不能作为相应定律或原理的证据是( )
中,①②键长不相同
C、NO的空间构型为三角锥形
D、基态原子中,4s电子能量较高,总是在比3s电子离核更远的地方运动
7. 下列实验结果不能作为相应定律或原理的证据是( )A
B
C
D
勒夏特列原理
元素周期律
盖斯定律
阿伏加德罗定律
实
验
方
案


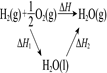

结果
左球气体颜色加深
右球气体颜色变浅
烧瓶中冒气泡,
试管中出现浑浊
测得ΔH为ΔH1、ΔH2的和
H2与O2的体积比约为2︰1
A、A B、B C、C D、D8. 氨硼烷(NH3· BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+ 3H2O2 = NH4BO2+ 4H2O。已知H2O2足量,下列说法正确的是( ) A、若左右两极室质量差为1.9 g,则电路中转移0.3 mol电子 B、电池工作时,H+通过质子交换膜向负极移动 C、电池工作时,正、负极分别放出H2和NH3 D、正极的电极反应式为H2O2 +2H+ + 2e- = 2H2O9. 水合肼又称水合联氨,广泛用于还原剂抗氧化剂、发泡剂等。其制备原理为:NaClO+2NH3=N2H4·H2O+NaCl。用如图装置制取水合肼有关分析正确的是( )
A、若左右两极室质量差为1.9 g,则电路中转移0.3 mol电子 B、电池工作时,H+通过质子交换膜向负极移动 C、电池工作时,正、负极分别放出H2和NH3 D、正极的电极反应式为H2O2 +2H+ + 2e- = 2H2O9. 水合肼又称水合联氨,广泛用于还原剂抗氧化剂、发泡剂等。其制备原理为:NaClO+2NH3=N2H4·H2O+NaCl。用如图装置制取水合肼有关分析正确的是( ) A、装置的连接顺序是:f→a→b→d→c→e B、e所在装置的漏斗可以没入水面以下 C、f所在装置可以快速制备氨气 D、操作过程中要快速滴加NaClO溶液10. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、11.2 L CH4和22.4 L Cl2 (均为标准状况)在光照下充分反应后的分子数为一定为1.5 NA B、120g MgSO4与NaHSO4的固体混合物中含有阳离子总数一定为NA C、3.2g Cu完全溶于一定量的浓硝酸,转移电子数一定为0.1 NA D、2.3 g C2H6O中含有的C- H共价键数目一定为 0.3 NA11. CH3-CH=CH-COOCH3有两种立体异构体
A、装置的连接顺序是:f→a→b→d→c→e B、e所在装置的漏斗可以没入水面以下 C、f所在装置可以快速制备氨气 D、操作过程中要快速滴加NaClO溶液10. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、11.2 L CH4和22.4 L Cl2 (均为标准状况)在光照下充分反应后的分子数为一定为1.5 NA B、120g MgSO4与NaHSO4的固体混合物中含有阳离子总数一定为NA C、3.2g Cu完全溶于一定量的浓硝酸,转移电子数一定为0.1 NA D、2.3 g C2H6O中含有的C- H共价键数目一定为 0.3 NA11. CH3-CH=CH-COOCH3有两种立体异构体 和
和 , 由CH3CHO和Ph3P=CHCOOCH3反应制取这两种异构体的历程中能量变化如图
, 由CH3CHO和Ph3P=CHCOOCH3反应制取这两种异构体的历程中能量变化如图
已知:在立体结构中,实线表示该键在纸平面上,实楔形线表示该键在纸前方,虚线表示该键在纸后方。
下列说法正确的是( )
A、 比
比 稳定
B、温度升高,CH3CHO的转化率减小
C、生成
稳定
B、温度升高,CH3CHO的转化率减小
C、生成 的过程中,速率最快的是由
的过程中,速率最快的是由 生成
生成 的反应
D、两个反应历程中,中间产物相同
12. 已知SrF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节SrF2浊液的pH,测得在不同pH条件下,体系中-1gc(X)(X为Sr2+或F-)与1g[]的关系如图所示。
的反应
D、两个反应历程中,中间产物相同
12. 已知SrF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节SrF2浊液的pH,测得在不同pH条件下,体系中-1gc(X)(X为Sr2+或F-)与1g[]的关系如图所示。
下列说法错误的是( )
A、L1代表-lgc(Sr2+)与lg[]的变化曲线 B、Ksp(SrF2)的数量级为10-9 C、a、c两点的溶液中均存在2c(Sr2+)=c(F-)+c(HF) D、c点的溶液中存在c(Cl-)>c(Sr2+)=c(HF)>c(H+)二、多选题
-
13. 下列说法正确的是( )A、向乙醇中加入绿豆大小的金属钠有气体产生,说明乙醇中含有H2O B、向蔗糖中加入浓硫酸,蔗糖变黑后膨胀,说明浓硫酸具有吸水性和强氧化性 C、向NaHCO3溶液中滴加紫色石蕊试液,溶液变蓝,说明Kw > Ka1(H2CO3)·Ka2(H2CO3) D、向苯酚稀溶液中逐滴加入饱和溴水有白色沉淀产生,说明羟基对苯环性质产生影响14. 关于化合物(如图),下列说法正确的是( )
 A、该分子的不饱和度为8 B、分子中含有1个不对称碳原子 C、可以发生加成反应和取代反应 D、不能使酸性KMnO4稀溶液褪色15. 生活污水中的氮和磷元素主要以铵盐和磷酸盐形式存在,可用铁、石墨作电极,用电解法去除。电解时:如图一原理所示可进行除氮;翻转电源正负极,可进行除磷,利用Fe2+将PO转化为Fe3(PO4)2沉淀。下列说法错误的是( )
A、该分子的不饱和度为8 B、分子中含有1个不对称碳原子 C、可以发生加成反应和取代反应 D、不能使酸性KMnO4稀溶液褪色15. 生活污水中的氮和磷元素主要以铵盐和磷酸盐形式存在,可用铁、石墨作电极,用电解法去除。电解时:如图一原理所示可进行除氮;翻转电源正负极,可进行除磷,利用Fe2+将PO转化为Fe3(PO4)2沉淀。下列说法错误的是( ) A、图二中0~20 min脱除的元素是氮元素,此时石墨作阴极 B、溶液pH越小,有效氯浓度越大,氮的去除率越高 C、图二中20~40 min脱除的元素是磷元素,此时阴极电极反应式为:2H++2e-=H2↑ D、电解法除氮中有效氯ClO-氧化NH3的离子方程为:3ClO-+2NH3=3Cl-+N2+3H2O
A、图二中0~20 min脱除的元素是氮元素,此时石墨作阴极 B、溶液pH越小,有效氯浓度越大,氮的去除率越高 C、图二中20~40 min脱除的元素是磷元素,此时阴极电极反应式为:2H++2e-=H2↑ D、电解法除氮中有效氯ClO-氧化NH3的离子方程为:3ClO-+2NH3=3Cl-+N2+3H2O三、综合题
-
16. 天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4 , 还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:

已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)、“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是。(2)、分馏过程中,为防止产品变质,过程中一定需要注意的是。液体a的电子式是。(3)、实验室中洗涤ZrOCl2·8H2O沉淀操作是。(4)、“还原”中氧化剂是(填化学式)。(5)、由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是。
17. 以物质的量之比3:1的Fe和Al共熔后结晶得Fe3Al晶体,晶胞结构如图一所示,该晶胞为立方晶胞,晶胞参数为a pm。血红素(如图二)是血红蛋白的活性部位,其中心元素是Fe( II)。二者是常见的含铁物质,请回答下列问题。 (1)、Fe2+的价电子排布式为:。(2)、血红素分子中非金属元素电负性由大到小的顺序是 (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是 (用化学式表示);C、N、O三种元素形成一种阴离子CNO- , 其结构中有个σ键, 个π键。(3)、有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为 ;该环(填“有”、“无”)芳香性。(4)、Fe3Al晶胞中,rAl=b pm, rFe=c pm,则该晶胞的空间利用率为(以含π的代数式表示)。(5)、m原子的原子分数坐标为. ;晶胞内任意两个Al原子之间的距离为pm。(6)、Fe3Al晶体的密度为 g·cm-3。18. 氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。答下列问题:(1)、已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=-a kJ·mol-1;N2(g)+O2(g)=2NO(g) ΔH=+b kJ·mol-1;用NH3催化还原NO,可以消除氮氧化物的污染。写出反应的热化学方程式。(2)、不同温度下,工业催化合成氨N2(g)+3H2(g)2NH3(g) 反应的K值随温度变化如表。
(1)、Fe2+的价电子排布式为:。(2)、血红素分子中非金属元素电负性由大到小的顺序是 (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是 (用化学式表示);C、N、O三种元素形成一种阴离子CNO- , 其结构中有个σ键, 个π键。(3)、有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为 ;该环(填“有”、“无”)芳香性。(4)、Fe3Al晶胞中,rAl=b pm, rFe=c pm,则该晶胞的空间利用率为(以含π的代数式表示)。(5)、m原子的原子分数坐标为. ;晶胞内任意两个Al原子之间的距离为pm。(6)、Fe3Al晶体的密度为 g·cm-3。18. 氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。答下列问题:(1)、已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=-a kJ·mol-1;N2(g)+O2(g)=2NO(g) ΔH=+b kJ·mol-1;用NH3催化还原NO,可以消除氮氧化物的污染。写出反应的热化学方程式。(2)、不同温度下,工业催化合成氨N2(g)+3H2(g)2NH3(g) 反应的K值随温度变化如表。温度/℃
25
400
450
K
5 ×108
0.507
0.152
从平衡角度考虑,工业合成氨应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因。
(3)、某科研组提出合成氨的“表面氢化机理”如图所示,可在较低的电压下实现氮气的还原合成氨:
已知:第一步:*H++e- =*H(快)(吸附在催化剂表面的物质用*表示);
第二步:N2+2*H =中间体(吸附在催化剂表面)(慢);
第三步:(快)(写出第三步的方程式)。
其中,第二步为决速步,原因是(从反应物分子结构角度)。
(4)、向恒温密闭容器中充入一定物质的量N2、H2混合气体,在不同催化剂作用下的进行反应N2(g)+3H2(g)2NH3(g) ΔH<0,相同时间内H2的转化率随温度的变化如图所示:
根据图示,b点v正v逆(填“>”、“< ”或“=”),温度高于T4后曲线重合为ac的合理解释是;c点时,正、逆反应瞬时速率方程:v正(H2)= k1·c3(H2)·c(N2)和v逆(NH3)= k2·c2(NH3),此条件下反应的平衡常数K= (用含k1、k2的代数式表示)。
(5)、在30 MPa时,体积分数为3m%的H2、m%的N2和q%的惰性气体合成氨气,平衡时NH3体积分数随温度变化情况如图。
若q=10时,M点的N2的分压=MPa。此时该反应的压强平衡常数Kp=(MPa)-2(保留三位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
19. 化合物I是有机合成中的一种中间体,合成路线如图(部分反应条件已省略),回答下列问题:

已知:①

②

③
 +H2O
+H2O ④
 (1)、B中含氧官能团的名称为. ;
(1)、B中含氧官能团的名称为. ;化合物B→C的反应类型是。
(2)、最理想的“原子经济性反应”是指反应物的原子全部转化为期望的最终产物的反应。A→B的反应属于最理想的“原子经济性反应”,化合物X结构简式是;化合物E的结构简式是。(3)、写出H→I的化学方程式:。(4)、写出两种同时符合下列条件的化合物B的同分异构体的结构简式(不包括立体异构):。①包含两个碳环,且只含两个-CH2-
②包含
 ,
,  是不对称碳原子,苯环上只有1个取代基(5)、以化合物
是不对称碳原子,苯环上只有1个取代基(5)、以化合物 为原料,设计
为原料,设计 的合成路线(用流程图表示,无机试剂、有机溶剂任选)。 20. 氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,易分解,极易水解。实验室利用下列反应和相关装置制备氨基甲酸铵。2NH3(g) + CO2(g) H2NCOONH4(s) ΔH<0
的合成路线(用流程图表示,无机试剂、有机溶剂任选)。 20. 氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,易分解,极易水解。实验室利用下列反应和相关装置制备氨基甲酸铵。2NH3(g) + CO2(g) H2NCOONH4(s) ΔH<0
已知:常压下,有关物质的熔沸点:
物质
CO2
H2NCOONH4
熔点
- 78.45℃
59.61℃
沸点
- 56. 55℃
58.76℃
请回答:
(1)、仪器a的名称为;实验室用A或F装置均可制备氨气,其中F装置的反应方程式是。 装置B内盛放的试剂是。(2)、E装置能控制原料气按反应计量系数充分反应,若反应初期观察到E装置内浓硫酸中产生气泡,接下来的具体操作是。此外,装置E还能防倒吸、、。(3)、对比大理石和盐酸反应制CO2 , 该实验利用千冰升华产生CO2气体的优点有____ (填序号)。A.提供-78℃低温环境,避免氨基甲酸铵分解A、避免了CO2的除杂干燥 B、增大了反应物氨气的转化率 C、加快了氨基甲酸铵的生成速率(4)、产品纯度分析:①称取产品1.845 g [内含杂质(NH4)2CO3·H2O ],用蒸馏水溶解,定容于100 mL容量瓶中。
②移取20.00 mL上述溶液于锥形瓶,加入足量BaCl2溶液。
③向上述溶液加入足量甲醛(HCHO)溶液,放置5 min,再加入20.00 mL 1.000 mol·L-1NaOH溶液。
④向上述溶液滴加1~2滴酚酞,用1.000 mol·L-1HCl标准溶液滴定,实验三次,测得消耗标准溶液11.00mL。
已知: H2NCOONH4+ H2O= (NH4) 2CO3、4NH+ 6HCHO= [(CH2)6N4H]++ 3H++6H2O、[(CH2)6N4H]+ +OH-= [(CH2)6N4]+ + H2O
氨基甲酸铵纯度为 (保留小数点后两位),若无操作②,所测纯度(填“偏大”或“偏小”)。