辽宁省辽阳市2022届高三一模化学试题
试卷更新日期:2022-05-09 类型:高考模拟
一、单选题
-
1. 食品膨松剂添加到食品中,在食品加工过程中受热分解产生气体,使面坯起发,做出的食品口感柔软或酥脆。下列物质不能作食品膨松剂的是( )A、碳酸氢钠 B、碳酸氢铵 C、生物酵母 D、氯化钠2. 氢氟酸可用于雕刻玻璃,其反应原理为4HF+SiO2=SiF4↑+2H2O。下列有关说法正确的是( )A、HF中的共价键为s-pσ键 B、H2O、SiF4均为极性分子 C、SiO2晶体为分子晶体 D、基态氧原子的价层电子轨道表示式为
 3. 中国舞剧不仅吸收和化用戏曲杂技等传统艺术的身体语言,而且跨越艺术类型。从国画。文物、诗词等其他传统文化艺术中汲取灵感。下列有关说法错误的是( )A、杂技《柔术滚杯》用直筒玻璃杯取代高脚塑料杯,塑料是高分子有机物 B、国画《千里江山图》的绿色来自孔雀石颜料,孔雀石的主要成分是碱式碳酸铜 C、词句“断虹霁雨,净秋空”描述的情景与雷雨天气氧气转化成臭氧(少量)有关 D、古化戏曲行当中“净行”的面部绘画比较复杂,需重施油彩,油彩是易溶于水的物质4. 下列说法正确的是( )A、石墨转化为金刚石是化学变化 B、常温下,铁、铝与浓硫酸不发生反应 C、标准状况下,2.24LNO2中含有的氧原子的数目为0.2NA D、向硫酸铵溶液中加入氢氧化钡溶液。发生反应的离子方程式为Ba2++=BaSO4↓5. 有机化合物M、N的结构分别如图所示。下列有关说法错误的是( )
3. 中国舞剧不仅吸收和化用戏曲杂技等传统艺术的身体语言,而且跨越艺术类型。从国画。文物、诗词等其他传统文化艺术中汲取灵感。下列有关说法错误的是( )A、杂技《柔术滚杯》用直筒玻璃杯取代高脚塑料杯,塑料是高分子有机物 B、国画《千里江山图》的绿色来自孔雀石颜料,孔雀石的主要成分是碱式碳酸铜 C、词句“断虹霁雨,净秋空”描述的情景与雷雨天气氧气转化成臭氧(少量)有关 D、古化戏曲行当中“净行”的面部绘画比较复杂,需重施油彩,油彩是易溶于水的物质4. 下列说法正确的是( )A、石墨转化为金刚石是化学变化 B、常温下,铁、铝与浓硫酸不发生反应 C、标准状况下,2.24LNO2中含有的氧原子的数目为0.2NA D、向硫酸铵溶液中加入氢氧化钡溶液。发生反应的离子方程式为Ba2++=BaSO4↓5. 有机化合物M、N的结构分别如图所示。下列有关说法错误的是( ) (M)
(M) (N)A、M、N都属于烃,且互为同分异构体 B、M、N中碳原子的杂化方式相同 C、能用溴的四氯化碳溶液区分M和N D、N的二氯代物有3种不同结构6. M是合成某具有药理作用的有机物的中间体,其结构如图所示,下列有关M的说法正确的是( )
(N)A、M、N都属于烃,且互为同分异构体 B、M、N中碳原子的杂化方式相同 C、能用溴的四氯化碳溶液区分M和N D、N的二氯代物有3种不同结构6. M是合成某具有药理作用的有机物的中间体,其结构如图所示,下列有关M的说法正确的是( ) A、分子式为C17H22O3 B、分子中含有4种官能团 C、1mol M最多能与4mol H2发生加成反应 D、分子中所有碳原子可能共面7. 铜的某种氧化物的晶胞结构如图所示。下列说法错误的是( )
A、分子式为C17H22O3 B、分子中含有4种官能团 C、1mol M最多能与4mol H2发生加成反应 D、分子中所有碳原子可能共面7. 铜的某种氧化物的晶胞结构如图所示。下列说法错误的是( )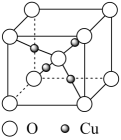 A、Cu位于元素周期表ds区 B、该晶胞中Cu的配位数为4 C、该物质的化学式为Cu2O D、该晶体属于离子晶体8. 化合物M(NH4CuSO3)为难溶于水的白色固体,取少量M进行如下实验,下列推断正确的是( )
A、Cu位于元素周期表ds区 B、该晶胞中Cu的配位数为4 C、该物质的化学式为Cu2O D、该晶体属于离子晶体8. 化合物M(NH4CuSO3)为难溶于水的白色固体,取少量M进行如下实验,下列推断正确的是( ) A、化合物M中Cu的化合价为+2价 B、红色固体(A)为氧化铜 C、G为含极性共价键的极性分子 D、加热H无明显现象9. 下列实验操作及现象不能得到相应结论的是( )
A、化合物M中Cu的化合价为+2价 B、红色固体(A)为氧化铜 C、G为含极性共价键的极性分子 D、加热H无明显现象9. 下列实验操作及现象不能得到相应结论的是( )选项
实验操作及现象
结论
A
将乙醇与浓硫酸的混合物加热至170℃,并将产生的气体干燥后通入少量溴的四氯化碳溶液中,溴的四氯化碳溶液褪色
乙醇发生了消去反应
B
向淀粉溶液中先加入稀硫酸并加热,再加入碘水,溶液变蓝
淀粉未发生水解或部分水解
C
向稀HNO3溶液中加入铜片并加热,试管口观察到红棕色气体
铜与稀HNO3溶液反应生成NO2
D
向浓度均为0.1 mol·L-1的NaCl、NaI混合溶液中滴加1~2
滴0.01 mol·L-1的AgNO3溶液,产生黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A、A B、B C、C D、D10. 某二次电池以含的有机溶液为电解质溶液,放电时的工作原理为。下列说法正确的是( ) A、放电时,电子的流向:电解质溶液 B、放电时,正极的电极反应式为 C、充电时,与直流电源正极相连 D、充电时,阳极的质量增加11. 某温度下,在恒容密闭容器中发生反应: , 下列有关说法正确的是( )A、加入合适的催化剂,能提高单位时间内的产量 B、升高反应温度有利于提高的平衡转化率 C、平衡后再通入适量 , 平衡常数K增大 D、增大体系的压强,平衡不发生移动12. 硫酸工业中,将SO2氧化为SO3是生产工艺中的重要环节。在温度为T1条件下,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)⇌2SO3(g)ΔH<0,实验测得:v正=k正·c2(SO2)·c(O2),v逆=k逆·c2(SO3)。
A、放电时,电子的流向:电解质溶液 B、放电时,正极的电极反应式为 C、充电时,与直流电源正极相连 D、充电时,阳极的质量增加11. 某温度下,在恒容密闭容器中发生反应: , 下列有关说法正确的是( )A、加入合适的催化剂,能提高单位时间内的产量 B、升高反应温度有利于提高的平衡转化率 C、平衡后再通入适量 , 平衡常数K增大 D、增大体系的压强,平衡不发生移动12. 硫酸工业中,将SO2氧化为SO3是生产工艺中的重要环节。在温度为T1条件下,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)⇌2SO3(g)ΔH<0,实验测得:v正=k正·c2(SO2)·c(O2),v逆=k逆·c2(SO3)。容器编号
起始浓度/(mol·L-1)
平衡浓度/(mol·L-1)
c(SO2)
c(O2)
C(SO3)
c(O2)
I
0.6
0.3
0
0.2
II
0.5
x
0.3
III
0.3
0.25
0.2
已知:k正、k逆为速率常数,仅受温度的影响。
下列说法错误的是( )
A、达到平衡时,平衡常数和速率常数的关系: B、若容器II中达到平衡时=1,则x=0.85 C、容器III中达到平衡时,c(O2)<0.25mol·L-1 D、当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m<n13. 氨是农业上“氮的固定”的必需原料,随着世界人口的增长,氨的需求量在不断增大。科研人员新发现以磷盐作质子(H+)传导体,以四氢呋喃(无色易挥发的液体)为电解剂,利用电化学法将氮气还原成氨的原理如图所示。下列说法错误的是( ) A、M电极为阳极,电极反应式为H2-2e-=2H+ B、(Ⅰ)→(Ⅱ)的变化中,磷原子的成键数目不发生变化 C、图示中最后一步反应为3Li+N2+3H+=3Li++2NH3 D、该方法制备氨气所需的温度低于传统工业合成氨的温度14. 短周期主族元素R、X、Y、Z的原子序数依次增大,R是农作物“肥料三要素”之一,在短周期主族元素中X的原子半径最大,R、X原子的最外层电子数之和等于Y原子的最外层电子数。下列推断错误的是( )A、Y、Z的气态氢化物的水溶液都显酸性 B、简单离子半径:R<X<Y C、R、X、Y的基态原子的第一电离能:X<Y<R D、化合物RZ3中各原子最外层均满足8e-稳定结构15. 常温下,将0.2mol·L-1NH4Cl溶液与0.2mol·L-1NaHCO3溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。溶液中的含碳粒子和含氮粒子的分布系数(δ)随溶液pH的变化如图所示:
A、M电极为阳极,电极反应式为H2-2e-=2H+ B、(Ⅰ)→(Ⅱ)的变化中,磷原子的成键数目不发生变化 C、图示中最后一步反应为3Li+N2+3H+=3Li++2NH3 D、该方法制备氨气所需的温度低于传统工业合成氨的温度14. 短周期主族元素R、X、Y、Z的原子序数依次增大,R是农作物“肥料三要素”之一,在短周期主族元素中X的原子半径最大,R、X原子的最外层电子数之和等于Y原子的最外层电子数。下列推断错误的是( )A、Y、Z的气态氢化物的水溶液都显酸性 B、简单离子半径:R<X<Y C、R、X、Y的基态原子的第一电离能:X<Y<R D、化合物RZ3中各原子最外层均满足8e-稳定结构15. 常温下,将0.2mol·L-1NH4Cl溶液与0.2mol·L-1NaHCO3溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。溶液中的含碳粒子和含氮粒子的分布系数(δ)随溶液pH的变化如图所示:
下列有关描述中正确的是( )
A、常温下,Kh(NH)>Kh(HCO) B、混合溶液中存在:c(H+)-c(OH-)>c(NH3•H2O)-c(H2CO3) C、当向该混合溶液中逐滴加入NaOH溶液时,c(NH)、c(HCO)均逐渐减小 D、当溶液pH=11时,溶液中粒子浓度的大小关系:c(CO)>c(NH3•H2O)>c(HCO)>c(NH)二、综合题
-
16. Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3 , 还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。已知:

①25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Co(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
1.09×10-15
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液;“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
(1)、Mn元素位于元素周期表第周期第族。(2)、向“沉淀池I”中加入MnO2 , MnO2的作用是;“滤渣2”的主要成分是(填化学式)。(3)、MnSO4转化为MnOOH的离子方程式为。(4)、MnSO4转化为MnOOH中“III.实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为。(5)、高纯度的MnOOH转化为Mn2O3的化学方程式为。(6)、在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为(当溶液中某离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。17. 研究NOx、SO2和CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。(1)、已知①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-234kJ·mol-1②N2(g)+O2(g)⇌2NO(g)△H2=+179.5kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-112.3kJ·mol-1
NO2与CO反应生成无污染气体的热化学方程式为。
(2)、氨气可将氮氧化物转化为无毒气体。450℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3 , 起始时体系压强为pMPa,发生反应:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g),5min时反应达到平衡,此时测得N2的物质的量分数为。①0~5min内,v(NH3)=mol·L-1·min-1 , NO的平衡转化率=%。
②450℃时,该反应的压强平衡常数Kp=(填含p的代数式,Kp为以分压表示的平衡常数,分压=总压×气体组分物质的量分数)MPa。
(3)、工业上,常温下将含NOx的尾气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中进行无害化处理,原理如图所示。
该吸收过程中,Ce3+/Ce4+的作用是 , 其中反应II的离子方程式为。
18. 过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,易溶于水,可以替代过氧化钙作为水产养殖业的产氧剂,放氧速率高于过氧化钙,并可给在贮运过程中的鱼、虾等生物供氧保鲜。某实验小组模拟工业生产过碳酸钠,装置如图所示。 (1)、装置中仪器A的名称为;仪器B的侧面导管的作用是。(2)、按图连接好装置后,在三颈瓶中加入Na2CO3固体,再由B向三颈瓶中加入H2O2充分反应。反应时,反应温度不能太高,原因是;向反应后的混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、烘干。得到过碳酸钠晶体。加入NaCl固体的作用是。(3)、过碳酸钠为鱼、虾等生物供氧时,其有效成分是过氧化氢(不稳定,易分解),将过氧化氢制成过碳酸钠的优点是。(4)、实验制得的过碳酸钠活性氧测定。
(1)、装置中仪器A的名称为;仪器B的侧面导管的作用是。(2)、按图连接好装置后,在三颈瓶中加入Na2CO3固体,再由B向三颈瓶中加入H2O2充分反应。反应时,反应温度不能太高,原因是;向反应后的混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、烘干。得到过碳酸钠晶体。加入NaCl固体的作用是。(3)、过碳酸钠为鱼、虾等生物供氧时,其有效成分是过氧化氢(不稳定,易分解),将过氧化氢制成过碳酸钠的优点是。(4)、实验制得的过碳酸钠活性氧测定。取6g上述实验制得的过碳酸钠样品溶于水中,滴入稀硫酸酸化,再加入足量的KI溶液,并加入少量淀粉,待充分反应后,置于250mL容量瓶中定容;从容量瓶中收出25mL于锥形瓶中,用0.5000mol·L-1 Na2S2O3潮液滴定至终点,消耗Na2S2O3溶液的体积为21.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
已知:过碳酸钠产品质量的优劣可用活性氧的质量分数[w(活性氧)]表示,当w(活性氧)≥13%时为优等品。其计算方法如下:w(活性氧)=×100%。
①加入KI后发生反应的离子方程式为。
②滴定终点时的现象为。
③该实验制得的过碳酸钠的w(活性氧)= , 则该过碳酸钠(填“是”或“不是”)优等品。
19. 3,4-二羟基肉桂酸乙酯( )具有抗炎作用和治疗自身免疫性疾病的潜力。由气体A制备该物质的合成路线如下:
)具有抗炎作用和治疗自身免疫性疾病的潜力。由气体A制备该物质的合成路线如下:
已知:
 +
+

回答下列问题:
(1)、已知:气体A对氢气的相对密度为14,A的化学名称是。(2)、B中含有的官能团的名称为。(3)、D的结构简式为。(4)、H→I的反应类型是。(5)、反应E→F的化学方程式为;E中含有个手性碳原子(连有四个不同基团的碳原子)。(6)、芳香族化合物X是H的同分异构体,1molX与足量NaHCO3溶液反应可生成2molCO2 , 符合条件的X有种,其中核磁共振氢谱的峰面积比为3:2:2:1的结构简式为(写出一种)。