湖南省永州市2022届高三高考第三次适应性考试化学试题
试卷更新日期:2022-05-09 类型:高考模拟
一、单选题
-
1. 北京2022年冬奥会中使用了大量新材料。下列属于金属材料的是( )A、速滑冰刀中的钛合金 B、“飞扬”火炬中的聚硅氮烷树脂 C、运动服面料中使用的聚氨酯纤维 D、冰墩墩外壳材质中的有机硅橡胶2. 下列叙述涉及氧化还原反应的是( )A、根瘤菌固氮 B、生石灰作干燥剂 C、氢氧化铝作胃酸中和剂 D、用纯碱清洗铁屑表面油脂3. 下列实验中,能够正确描述其反应离子方程式的是( )A、用白醋除水垢:2H++CaCO3=Ca2++CO2↑+H2O B、常温下,硫化钾溶液的pH>7:S2-+H3O+HS-+H2O C、用铜电极电解饱和食盐水:2Cl-+2H2OH2↑+Cl2↑+2OH- D、向FeSO4溶液中加入K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓4. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、1.0mol·L-1的盐酸含有分子数为NA B、1molFe溶于过量稀硝酸,电子转移数为2NA C、78gNa2O2和Na2S固体混合物中含有的离子总数为3NA D、1LpH=4的0.1mol·L-1K2Cr2O7溶液中Cr2O离子数为0.1NA5. 下列实验操作、现象与结论相匹配的是( )
操作
现象
结论
A
将缠绕的铜丝灼烧后反复插入盛乙醇的试管,然后滴加酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色
乙醇催化氧化生成乙醛
B
向小苏打粉末中滴入柠檬酸
产生无色气体
柠檬酸的酸性比碳酸强
C
将25℃、0.1mol·L-1Na2SO3溶液加热到40℃,用传感器监测溶液pH的变化
溶液pH逐渐减小
温度升高,Na2SO3水解平衡正向移动
D
将苯、液溴、铁粉混合后产生的气体通入AgNO3溶液中
产生淡黄色沉淀
苯与液溴发生了取代反应
A、A B、B C、C D、D6. 如图是合成某药物中间体的结构简式。下列说法正确的是( ) A、分子式为C15H20O2 B、分子中所有碳原子可能共平面 C、在浓硫酸催化下加热能够发生消去反应 D、该物质的芳香族同分异构体中,能发生水解反应且核磁共振氢谱峰面积之比为9:9:2:2的有2种(不考虑立体异构)7. 主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂Q的结构如图所示。下列说法正确的是( )
A、分子式为C15H20O2 B、分子中所有碳原子可能共平面 C、在浓硫酸催化下加热能够发生消去反应 D、该物质的芳香族同分异构体中,能发生水解反应且核磁共振氢谱峰面积之比为9:9:2:2的有2种(不考虑立体异构)7. 主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂Q的结构如图所示。下列说法正确的是( ) A、原子半径:W<Y<X<Z B、W与Z形成的化合物中含有共价键 C、X与Y形成的化合物可用作食品干燥剂 D、Q中不是所有原子都满足8电子稳定结构8. MnO2催化除去HCHO的机理如图所示。下列说法正确的是( )
A、原子半径:W<Y<X<Z B、W与Z形成的化合物中含有共价键 C、X与Y形成的化合物可用作食品干燥剂 D、Q中不是所有原子都满足8电子稳定结构8. MnO2催化除去HCHO的机理如图所示。下列说法正确的是( ) A、MnO2降低了反应的焓变 B、反应②中断裂碳氧双键 C、反应①~④均是氧化还原反应 D、上述机理总反应为HCHO+O2CO2+H2O9. α—萘磺酸(
A、MnO2降低了反应的焓变 B、反应②中断裂碳氧双键 C、反应①~④均是氧化还原反应 D、上述机理总反应为HCHO+O2CO2+H2O9. α—萘磺酸( )和β—萘磺酸(
)和β—萘磺酸( )是重要的化工原料,合成时往往得到两者的混合物,工业上相关的合成反应如图。有关说法错误的是( )
)是重要的化工原料,合成时往往得到两者的混合物,工业上相关的合成反应如图。有关说法错误的是( )反应①:
 +H2SO4=
+H2SO4= +H2O ΔH1<0 K1
+H2O ΔH1<0 K1反应②:
 +H2SO4=
+H2SO4= +H2O △H2<0 K2A、若主要产物是α-萘磺酸,说明反应①活化能比②小 B、平衡时α-萘磺酸和β-萘磺酸的物质的量浓度关系为= C、在密闭容器中加入萘与硫酸,tmin后反应达到平衡,用萘磺酸表示的反应速率为 D、α-萘磺酸与β-萘磺酸能相互转化10. 向碘水、淀粉的混合液中加入AgNO3溶液,蓝色褪去。为探究褪色原因,实验过程如图。下列分析错误的是( )
+H2O △H2<0 K2A、若主要产物是α-萘磺酸,说明反应①活化能比②小 B、平衡时α-萘磺酸和β-萘磺酸的物质的量浓度关系为= C、在密闭容器中加入萘与硫酸,tmin后反应达到平衡,用萘磺酸表示的反应速率为 D、α-萘磺酸与β-萘磺酸能相互转化10. 向碘水、淀粉的混合液中加入AgNO3溶液,蓝色褪去。为探究褪色原因,实验过程如图。下列分析错误的是( ) A、过程①后溶液pH明显变小 B、过程③中加入NaCl溶液的目的是除去Ag+ C、过程④中氧化I-的物质不只有O2 D、综合上述实验,过程①中蓝色褪去的原因是Ag+氧化了I211. 一种从含砷废水[砷主要以亚砷酸(H3AsO3)形式存在]中回收砷的工艺流程如图:
A、过程①后溶液pH明显变小 B、过程③中加入NaCl溶液的目的是除去Ag+ C、过程④中氧化I-的物质不只有O2 D、综合上述实验,过程①中蓝色褪去的原因是Ag+氧化了I211. 一种从含砷废水[砷主要以亚砷酸(H3AsO3)形式存在]中回收砷的工艺流程如图:
已知:
I.As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2OII.As2S3(s)+3S2-(aq)2AsS(aq)
III.砷酸(H3AsO4)在酸性条件下有强氧化性,能被氢碘酸等还原
下列说法错误的是( )
A、As2S3中砷元素的化合价为+3价 B、“沉砷”过程中FeS可以用过量的Na2S代替 C、用氧气进行“氧化脱硫”涉及离子方程式AsS+2O2=AsO+3S↓ D、能用氢碘酸、淀粉溶液检验还原后溶液中是否仍存在砷酸二、多选题
-
12. 无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,电池工作原理如图所示:

下列说法错误的是( )
A、放电时,M极为正极 B、放电时,右侧储液器中NaCl的浓度增大 C、充电时,N极的电极反应式为:Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+ D、充电时,电路中每转移1mole- , N电极理论上质量减小23g13. 反应2NaClO+C3H3N3O3=C3N3O3Cl2Na+NaOH+H2O可制备广谱消毒剂C3N3O3Cl2Na,装置如图所示(夹持装置已略去)。下列说法错误的是( )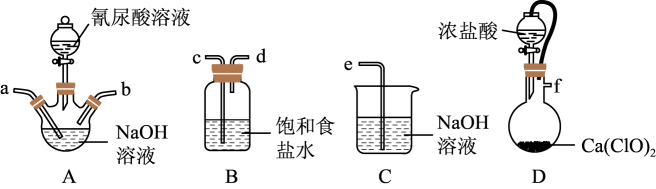 A、按气流从左至右,装置中导管连接顺序为f→c→d→a→b→e B、升高温度有利于装置A中产品的生成 C、当加入4molNaOH时,最多消耗氰尿酸(C3H3N3O3)1mol D、装置D中橡皮管可平衡气压,便于浓盐酸顺利流下14. 25℃时,向1L某缓冲溶液(含0.1mol·L-1CH3COOH、0.08mol·L-1CH3COONa)和1L0.1mol·L-1CH3COOH溶液中加入NaOH(s)或通入HCl(g),两种溶液的pH变化如图所示(不考虑溶液体积变化)。已知缓冲溶液pH=pKa-lg , 下列说法正确的是( )
A、按气流从左至右,装置中导管连接顺序为f→c→d→a→b→e B、升高温度有利于装置A中产品的生成 C、当加入4molNaOH时,最多消耗氰尿酸(C3H3N3O3)1mol D、装置D中橡皮管可平衡气压,便于浓盐酸顺利流下14. 25℃时,向1L某缓冲溶液(含0.1mol·L-1CH3COOH、0.08mol·L-1CH3COONa)和1L0.1mol·L-1CH3COOH溶液中加入NaOH(s)或通入HCl(g),两种溶液的pH变化如图所示(不考虑溶液体积变化)。已知缓冲溶液pH=pKa-lg , 下列说法正确的是( ) A、曲线①对应的溶液是缓冲溶液 B、25℃时醋酸的电离常数的数量级为10-5 C、a点溶液中离子浓度的大小关系为c(CH3COO-)=c(CH3COOH)>c(H+)>c(OH-) D、b点溶液存在:4c(CH3COOH)+9c(H+)=9c(Cl-)+9c(OH-)+5c(CH3COO-)
A、曲线①对应的溶液是缓冲溶液 B、25℃时醋酸的电离常数的数量级为10-5 C、a点溶液中离子浓度的大小关系为c(CH3COO-)=c(CH3COOH)>c(H+)>c(OH-) D、b点溶液存在:4c(CH3COOH)+9c(H+)=9c(Cl-)+9c(OH-)+5c(CH3COO-)三、综合题
-
15. 以下是制备FeC2O4·2H2O的流程:
 (1)、实验I:制备(NH4)2Fe(SO4)2·6H2O
(1)、实验I:制备(NH4)2Fe(SO4)2·6H2O
B中盛有一定量的(NH4)2SO4溶液,A中分液漏斗中的药品是。
(2)、实验开始时先将止水夹a(填“打开”或“关闭”)。(3)、简述B中生成(NH4)2Fe(SO4)2的操作过程。(4)、 实验II:制备FeC2O4·2H2O已知:25℃时,当pH>4,Fe2+易被氧化。
步骤①生成FeC2O4·2H2O的化学方程式为 , 该步加入H2C2O4而不是Na2C2O4溶液的原因是。
(5)、实验III:测定产品中铁元素的质量分数产品中可能含有Fe2(C2O4)3、H2C2O4·2H2O杂质,为测定铁元素的含量,称取mg产品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃,再加入过量KMnO4溶液,充分反应后,向上述溶液中加入还原剂将Fe3+完全还原为Fe2+ , 再加入稀H2SO4酸化,在75℃继续用cmol·L-1KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液VmL。
铁元素的质量分数为 , 若第一次滴入KMnO4溶液不足,则产品中铁元素含量(填“偏高”或“偏低”)。
16. 一种银铟矿主要成分为Au、Ag2S、CuS、ZnS、PbS、FeS、In2O3、Ga2O3等物质,从该矿获得稀有金属的工艺流程如图所示:
该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子
Fe3+
In3+
Ga3+
Cu2+
Zn2+
Pb2+
开始沉淀的pH
2.2
2.1
2.6
4.6
6.24
7.1
完全沉淀(c=1.0×10-5mol·L-1)的pH
3.2
3.4
4.3
6.6
8.24
9.1
(1)、“浸出”过程中金、银分别转化为AuCl、AgCl进入溶液,同时生成硫,写出Ag2S发生反应的离子方程式。(2)、高温水蒸气除铁利用了FeCl3易水解的性质,写出该反应的化学方程式。(3)、“二次还原”得到的滤液中主要的阳离子有H+、Na+、Ca2+、Zn2+、Pb3+、In3+、。(4)、“二次中和”得到的滤渣除少量Fe(OH)3外,主要成分还有(写化学式)。(5)、“分铅锌”步骤中,维持H2S饱和水溶液的浓度为0.1mol·L-1 , 为使Zn2+沉淀完全,需控制溶液的pH不小于已知:lg3≈0.48;Ksp(ZnS)=3.0×10-25 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=1.0×10-13]。(6)、已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“φ”表示),φ越大则该物质的氧化性越强,φ越低则该物质的还原性越强。浸出步骤中金反应的两个半反应如下:HClO+H++2e-=Cl-+H2O φ=1.49+lg
AuCl4-+3e-=4Cl-+Au φ=0.994+lg
(φ与半反应式的系数无关,仅与浓度有关,cθ=1mol·L-1)
如图是Au的浸出率与NaCl溶液浓度的关系,请解释A点以后,金浸出率减小的原因是。
 17. 乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应有:
17. 乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应有:I.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H1
II.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H2=+173kJ·mol-1
III.CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.2kJ·mol-1
IV.C2H5OH(g)+2H2(g)=2CH4(g)+H2O(g) △H4=-156.2kJ·mol-1
(1)、△H1=kJ·mol-1。(2)、压强为100kPa的条件下,图1是平衡时体系中各产物的物质的量分数与温度的关系,图2是H2的平衡产率与温度及起始时的关系。
①图1中c线对应的产物为(填“CO2”、“H2”或“CH4”)。
②图2中B点H2的产率与A点相等的原因是。
(3)、反应温度T℃、0.1MPa的恒压密闭容器中,充入1mol乙醇和xmolH2O(g),若只发生反应CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g),平衡时,乙醇转化率为α,CO2的压强为MPa,反应平衡常数Kp=(以分压表示,分压=总压×物质的量分数。列出计算式即可)(4)、CH3CH2OH(g)在催化剂Rh/CeO2上反应制取氢气的机理如图:
①出生成CO(g)步骤的化学方程式。
②下列措施可以提高CH3CH2OH在催化剂表面吸附率的有(填标号)。
a..减小乙醇蒸气的分压 b.增大催化剂的比表面积
18. 磷及其化合物与人类生产、生活密切相关。(1)、基态P原子中,电子占据的最高能级的符号为。(2)、核外电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、如图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。 (4)、已知有关氮、磷的单键和三键的键能(kJ·mol-1)如表:
(4)、已知有关氮、磷的单键和三键的键能(kJ·mol-1)如表:N-N
N≡N
P-P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式为
 )形式存在的原因是 , 白磷中P原子的杂化方式为。(5)、已知PCl3是不稳定的无色液体,遇水反应可生成两种酸,该反应的化学方程式为 , 所得含氧酸(已知该含氧酸的各步电离平衡常数分别为Ka1=1.6×10-2和Ka2=7×10-7)的结构式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是 , 白磷中P原子的杂化方式为。(5)、已知PCl3是不稳定的无色液体,遇水反应可生成两种酸,该反应的化学方程式为 , 所得含氧酸(已知该含氧酸的各步电离平衡常数分别为Ka1=1.6×10-2和Ka2=7×10-7)的结构式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
(7)、分别用 、●表示H2PO和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
、●表示H2PO和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为(填标号)。
 19. 随着化学的发展,人类发明了难以计数的药物,青霉素是其中久负盛名的一种,以下是合成青霉素V的一部分路线:
19. 随着化学的发展,人类发明了难以计数的药物,青霉素是其中久负盛名的一种,以下是合成青霉素V的一部分路线:
注:
 此结构简式表示氢伸向纸面里面,羟基伸向纸面外面。(1)、物质A所含官能团的名称是。(2)、物质B的分子式 , X分子由10个原子构成,试写出其结构简式。(3)、写出F→G的化学方程式。(4)、A,C,I三种物质中具有手性的是。(5)、不考虑“手性氮”和空间位阻等因素,仅从数学概率分析,G手性拆分得H的理论产率可达到。(6)、已知:
此结构简式表示氢伸向纸面里面,羟基伸向纸面外面。(1)、物质A所含官能团的名称是。(2)、物质B的分子式 , X分子由10个原子构成,试写出其结构简式。(3)、写出F→G的化学方程式。(4)、A,C,I三种物质中具有手性的是。(5)、不考虑“手性氮”和空间位阻等因素,仅从数学概率分析,G手性拆分得H的理论产率可达到。(6)、已知:①
 +R"OH
+R"OH +R'OH
+R'OH②R—N=CH—OH

试写出采用H2S、CH3OH及合适催化剂,由C制备D的合成路线。