河南省南阳市邓州市2022年中招第一次模拟考试化学试题
试卷更新日期:2022-05-06 类型:中考模拟
一、单选题
-
1. 下列过程是日常生活中常见的现象,其中发生了化学变化是( )A、玻璃破碎 B、酒精挥发 C、光合作用 D、冰雪融化2. 有机材料在日常生活中使用广泛。下列自行车部件中不属于有机合成材料的是( )A、塑料尾灯罩 B、链条 C、轮胎 D、座垫3. 绚丽多彩的世界离不开化学家的贡献。下面说法错误的是( )A、中国张青莲主持测定相对原子质量新值 B、英国道尔顿发现质量守恒定律 C、中国侯德榜发明联合制碱法 D、俄国门捷列夫发现元素周期律4. 某学校食堂的早餐提供:小米粥、葱油饼、馒头及醋溜白菜,请你从均衡营养的角度建议食堂增加的食物中含( )A、油脂 B、蛋白质 C、糖类 D、维生素5. 实验安全和成功的保证是规范的操作。下列实验操作正确的是( )A、
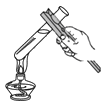 加热液体
B、
加热液体
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 倾倒液体
D、
倾倒液体
D、 比较火焰各层温度
6. 我国冶炼金属的历史悠久。冶炼钛(Ti)的反应之一为 ,该反应的反应类型和TiCl4中钛元素化合价为( )A、置换反应+4 B、复分解反应-4 C、置换反应-4 D、分解反应+47. 下列实验现象描述正确的是( )A、镁带在空气中燃烧发出耀眼的白光,生成白色MgO固体 B、电解水一段时间后,正、负极产生气体的体积比约为2:1 C、硫在氧气中燃烧发出蓝紫色火焰,有刺激性气味的气体产生 D、向氢氧化钠溶液中滴加氯化铁溶液,产生白色沉淀8. 下列各物质中,能发生反应且反应前后溶液总质量变小的是( )A、氧化铁与盐酸 B、稀硫酸与烧碱溶液 C、硫酸与氯化钡溶液 D、铜与硫酸镁溶液9. 利用催化剂将废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2 X+H2O,X的化学式为( )A、CO B、CH4 C、CH3OH D、C2H5OH10. KNO3和NaCl的溶解度曲线如图所示。下列叙述错误的是( )
比较火焰各层温度
6. 我国冶炼金属的历史悠久。冶炼钛(Ti)的反应之一为 ,该反应的反应类型和TiCl4中钛元素化合价为( )A、置换反应+4 B、复分解反应-4 C、置换反应-4 D、分解反应+47. 下列实验现象描述正确的是( )A、镁带在空气中燃烧发出耀眼的白光,生成白色MgO固体 B、电解水一段时间后,正、负极产生气体的体积比约为2:1 C、硫在氧气中燃烧发出蓝紫色火焰,有刺激性气味的气体产生 D、向氢氧化钠溶液中滴加氯化铁溶液,产生白色沉淀8. 下列各物质中,能发生反应且反应前后溶液总质量变小的是( )A、氧化铁与盐酸 B、稀硫酸与烧碱溶液 C、硫酸与氯化钡溶液 D、铜与硫酸镁溶液9. 利用催化剂将废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2 X+H2O,X的化学式为( )A、CO B、CH4 C、CH3OH D、C2H5OH10. KNO3和NaCl的溶解度曲线如图所示。下列叙述错误的是( ) A、30℃时,KNO3和NaCl两种饱和溶液中的溶质的质量分数大的是KNO3 B、0℃时,KNO3和NaCl两种饱和溶液中,所含溶质的质量:NaCl可能大于KNO3 C、将30℃的KNO3饱和溶液降温到20℃时一定有晶体析出 D、30℃时,将等质量的KNO3和NaCl分别配成饱和溶液,所得溶液的质量:NaCl小于KNO311. 下列实验方案能够达到目的的是( )A、可用点燃的方法除去二氧化碳中的少量一氧化碳 B、加水可除去熟石灰中的生石灰 C、用加入熟石灰研磨、闻气味可鉴别化肥碳酸氢铵和氯化铵 D、分别将银片、锌片放入硝酸铜溶液中,可验证锌、银、铜的金属活动性顺序12. 推理是化学学习中常用的思维方法。下列推理正确的是( )A、点燃氢气前一定要验纯,则点燃甲烷气体前一定要验纯 B、置换反应有单质生成,则有单质生成的反应一定是置换反应 C、分子、原子可以构成物质,则物质都是由分子、原子构成的 D、活泼金属与酸反应放出气体,则能与酸反应放出气体的物质一定是活泼金属13. 向HCl和MgCl2的混合溶液中,不断加入NaOH溶液,下列图像横坐标表示加入NaOH溶液质量,纵坐标表示反应的有关变化情况,其中正确的是 ( )A、
A、30℃时,KNO3和NaCl两种饱和溶液中的溶质的质量分数大的是KNO3 B、0℃时,KNO3和NaCl两种饱和溶液中,所含溶质的质量:NaCl可能大于KNO3 C、将30℃的KNO3饱和溶液降温到20℃时一定有晶体析出 D、30℃时,将等质量的KNO3和NaCl分别配成饱和溶液,所得溶液的质量:NaCl小于KNO311. 下列实验方案能够达到目的的是( )A、可用点燃的方法除去二氧化碳中的少量一氧化碳 B、加水可除去熟石灰中的生石灰 C、用加入熟石灰研磨、闻气味可鉴别化肥碳酸氢铵和氯化铵 D、分别将银片、锌片放入硝酸铜溶液中,可验证锌、银、铜的金属活动性顺序12. 推理是化学学习中常用的思维方法。下列推理正确的是( )A、点燃氢气前一定要验纯,则点燃甲烷气体前一定要验纯 B、置换反应有单质生成,则有单质生成的反应一定是置换反应 C、分子、原子可以构成物质,则物质都是由分子、原子构成的 D、活泼金属与酸反应放出气体,则能与酸反应放出气体的物质一定是活泼金属13. 向HCl和MgCl2的混合溶液中,不断加入NaOH溶液,下列图像横坐标表示加入NaOH溶液质量,纵坐标表示反应的有关变化情况,其中正确的是 ( )A、 B、
B、 C、
C、 D、
D、 14. 向11.2g含有两种杂质的铁粉中加入足量的稀硫酸,充分反应后,得到1g氢气。则该样品中含有的杂质可能为( )A、Mg、Cu B、Al、Cu C、Zn、Cu D、Mg、Zn
14. 向11.2g含有两种杂质的铁粉中加入足量的稀硫酸,充分反应后,得到1g氢气。则该样品中含有的杂质可能为( )A、Mg、Cu B、Al、Cu C、Zn、Cu D、Mg、Zn二、填空题
-
15. 预防骨质疏松应给人体补充的元素是(填“元素符号”);保持氧气的化学性质的微粒是(填“名称”);鉴别硬水和软水可用。16. 金属材料在生产和生活中的应用极为广泛。生铁、钢的性质不同的根本原因是;焊接钢轨的反应原理是铝与氧化铁在高温条件下反应生成铁和氧化铝,该反应的化学方程式为;铁在空气中的锈蚀,实际上是铁与空气中的氧气和共同作用的结果。17.(1)、我国科学家在水煤气变换中引入了高效催化剂,使该反应可在120℃时进行,反应过程如图所示。

反应的化学方程式为。
(2)、甲醇(CH3OH)是一种新型燃料。甲醇属于(填“无机物”或“有机物”);甲醇充分燃烧的化学方程式为。18. 构建类价二维图是化学学习元素及其化合物的重要方法。右图表示的是铁元素的类价二维图,回答下列问题: (1)、E点表示的物质化学式是。(2)、C点物质与一种氧化物在高温条件下可转化为A点物质,写出该转化的化学方程式。
(1)、E点表示的物质化学式是。(2)、C点物质与一种氧化物在高温条件下可转化为A点物质,写出该转化的化学方程式。三、综合题
-
19. 现有A-D四瓶失去标签的溶液:澄清石灰水、碳酸钠溶液、稀盐酸和溶质质量分数为10%的氢氧化钠溶液。某同学设计实验:从四瓶溶液中各取少量溶液两两混合,可以观察到:A+C→白色沉淀,C+D→无色气体,其余无明显现象。则这四种溶液两两混合可发生个反应,D为 , A与C反应的化学方程式为。20. A、B、C、D、E是初中常见的不同类别的五种物质。已知B含三种元素;D溶液呈蓝色,农业上可用来配制波尔多液;E呈红棕色,是铁锈的主要成分。它们的关系如图所示("一"表示两端的物质间能发生化学反应,"→"表示一种物质生成另一种物质,部分反应物、生成物和反应条件已略去)。请回答:D的化学式为 , A属于五种类别中的 , B与C反应的化学方程式为。

四、计算题
-
21. 将一氧化碳和二氧化碳的混合气体3.6g通过足量灼热氧化铜粉末,充分反应,将所得的气体全部通入足量的氢氧化钡溶液中,气体全部被吸收,生成白色沉淀,溶液质量减少15.3g。则原混合气体中碳、氧元素的质量比为。
五、简答题
-
22. 从微观的角度解释下列现象。(1)、蔗糖在热水比在冷水中溶解的快。(2)、K2SO4溶液是无色的,而KMnO4溶液是紫色的。23. 从天然盐井水中获取的粗盐中含有泥沙、氯化镁、硫酸钠和氯化钙等杂质。为得到精盐,某兴趣小组设计如下实验:【提示】杂质含量较少,不考虑微溶物形成沉淀。
 (1)、步骤⑤操作的名称是 , 步骤③加入试剂一定不可能是。
(1)、步骤⑤操作的名称是 , 步骤③加入试剂一定不可能是。a.氢氧化钙溶液 b.氢氧化钾溶液 c.氢氧化钡溶液
(2)、请设计实验来验证滤液中含有氢氧化钠(写出实验步骤和现象)24. 某工厂从废旧电子产品在回收部分金属的流程图如下。
已知:硫酸镍的化学式为NiSO4;。滤液1中的溶质为 , Cu、Fe、Ni的活动性由弱到强的顺序为 , 固体A的成分是(写化学式)。
25. 北京2022年冬奥会完美地诠释了绿色奥运、科技奥运。(1)、为落实“绿色奥运”的理念,冬奥会“飞扬”火炬使用的燃料是H2 , 其燃烧的化学方程式为。(2)、北京冬奥会选用二氧化碳跨临界直冷制冰系统,冰面温差控制在0.5摄氏度以内,碳排量接近于0。选用液态二氧化碳作制冷剂的原因是。(3)、某同学自制A装置在实验室制取二氧化碳气体,无纺布内装的药品是 , 若用C装置收集二氧化碳气体,气体应从(填“m”或“”)端进入。将已通入CO2的石蕊溶液加热,产生现象的原因是(用化学方程式解释)。
 (4)、某同学连接B、D、E装置进行实验。若实验时D装置中蜡烛燃烧更剧烈,E装置中溶液变浑浊,则B装置中反应的化学方程式为。(5)、某兴趣小组在实验室制CO2的发生装置中连接上压强传感器如图一,测得试管内气体压强变化情况如图二。下列说法正确的是。
(4)、某同学连接B、D、E装置进行实验。若实验时D装置中蜡烛燃烧更剧烈,E装置中溶液变浑浊,则B装置中反应的化学方程式为。(5)、某兴趣小组在实验室制CO2的发生装置中连接上压强传感器如图一,测得试管内气体压强变化情况如图二。下列说法正确的是。a.ab段压强变化的原因是打开弹簧夹
b.b点试管中液面低于多孔隔板
c.cd段长颈漏斗中液面下降
(6)、若把15gK2CO3和KCl的混合物加入100g的盐酸中,恰好完全反应,剩余溶液质量为110.6g。求反应后所得溶液中溶质的质量分数(结果保留到0.1%)。
-