广东省江门市2022年中考一模化学试题
试卷更新日期:2022-05-06 类型:中考模拟
一、单选题
-
1. 厨房中下列变化不属于化学变化的是( )A、天然气燃烧 B、食品变质 C、活性炭除冰箱异味 D、铁锅生锈2. 下列物质含有氢分子的是( )A、Ca(OH)2 B、H2CO3 C、H2O2 D、H23. “庄稼一枝花,要靠肥当家”。化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起了重要作用。下列属于复合肥料的是( )A、NH4H2PO4 B、K2CO3 C、CO(NH2)2 D、NH4NO34. 莫道雪融便无迹,雪融成水水成冰”,其中涉及有关物质的说法错误的是( )A、冰和水的化学性质不同 B、冰和水的相对分子质量相同 C、雪和水的分子间隔不同 D、雪融成水是物理变化5. 2021年6月17日,神舟十二号载人飞船成功发射升空。其中一种火箭推进剂在火箭发射过程中,发生的微观示意图如下图,下列说法正确的是( )
 A、甲和乙都是氧化物 B、丙的化学式为N2 C、反应后生成的丙与丁的质量比为3:4 D、该反应属于置换反应6. 液化气泄漏时下列做法中正确的是( )A、立即开灯检查 B、要立即开启排气扇通风 C、立即在现场打电话报警 D、首先迅速关闭液化气罐阀门7. 用如图所示的装置进行电解水实验,有以下描述:
A、甲和乙都是氧化物 B、丙的化学式为N2 C、反应后生成的丙与丁的质量比为3:4 D、该反应属于置换反应6. 液化气泄漏时下列做法中正确的是( )A、立即开灯检查 B、要立即开启排气扇通风 C、立即在现场打电话报警 D、首先迅速关闭液化气罐阀门7. 用如图所示的装置进行电解水实验,有以下描述:①向水中加入少量硫酸,能使水电解产生气体的速度变大;
②甲、乙两试管内收集到的气体的体积约为2:1;
③甲试管内产生的气体能燃烧;
④乙试管内产生的气体能使带火星的木条复燃.以上描述中正确的是( )
 A、①②③④ B、③ C、①② D、①②③8. 李兰娟院士的研究团队发现:达芦那韦(化学式C27H37N3O7S)能显著抑制新冠肺炎病毒复制。下列有关达芦那韦的说法正确的是( )A、从分类上看:达芦那韦属于无机化合物 B、从微观上看:每个达芦那韦分子由74个原子构成 C、从宏观上看:达芦那韦是由碳、氢、氮、氧、硫五种元素组成 D、从质量上看:达芦那韦中碳、氢、氧三种元素的质量比为27:37:79. 下列为人体部分液体的pH范围,其中酸性最强的是( )A、唾液(6.6-7.1) B、胃液(0.9-1.5) C、胆汁(7.1-7.3) D、血浆(7.3-7.4)10. 下列实验方案不能达到实验目的的是( )
A、①②③④ B、③ C、①② D、①②③8. 李兰娟院士的研究团队发现:达芦那韦(化学式C27H37N3O7S)能显著抑制新冠肺炎病毒复制。下列有关达芦那韦的说法正确的是( )A、从分类上看:达芦那韦属于无机化合物 B、从微观上看:每个达芦那韦分子由74个原子构成 C、从宏观上看:达芦那韦是由碳、氢、氮、氧、硫五种元素组成 D、从质量上看:达芦那韦中碳、氢、氧三种元素的质量比为27:37:79. 下列为人体部分液体的pH范围,其中酸性最强的是( )A、唾液(6.6-7.1) B、胃液(0.9-1.5) C、胆汁(7.1-7.3) D、血浆(7.3-7.4)10. 下列实验方案不能达到实验目的的是( )选项
实验目的
实验方案
A
鉴别C、CuO、Fe三种粉末
分别加入稀硫酸,观察现象
B
除去NaCl固体中混有少量的Na2CO3
加入过量稀盐酸,蒸发
C
鉴别羊毛纤维和合成纤维
燃烧,闻气味
D
分离KCl和MnO2的固体混合物
加适量水溶解,过滤
A、A B、B C、C D、D11. 化学就在我们身边。下列知识归纳有错误的是( )选项
知识归纳
A.化学与家居
①由含有化学合成纤维的衣料制成的衣服,牢固耐穿
②新装修的房屋中放置活性炭包除异味,利用了活性炭的吸附性
B.化学与出行
①“共享电动车”方便市民绿色出行,减少了大气污染
②高铁车头用到的玻璃钢是应用最广泛的复合材料
C.化学与环境
①塑料制品的使用方便了人类的生活,但废弃塑料带来“白色污染”
②露天焚烧垃圾以保持环境整洁
D.化学与健康
①为了保障食品安全,防止滥用食品添加剂
②人体缺乏维生素C,会引起坏血病
A、A B、B C、C D、D12. 镉(Cd)及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是一种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为+2.根据金属化学性质的一般规律,下列预测合理的是:( )①镉能与氢氧化钠溶液反应
②H2或CO能将镉的氧化物转化为金属镉
③镉能与盐酸或稀硫酸反应
④硫酸镉溶液中的硫酸锌可加入镉粉除去
A、①② B、②③ C、③④ D、②④13. 向 100g 质量分数为 4%的氢氧化钠溶液中逐滴加入氯化镁溶液,相关量的变化如下图。下列说法错误的是( ) A、a点的值为2.9 B、b 点对应的溶液能使无色酚酞溶液变红 C、c 点时两者恰好完全反应 D、d 点对应的溶液含有三种溶质14. 人类常利用化学反应得到所需要的物质,如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现),则X、Y、Z、W依次可能是( )
A、a点的值为2.9 B、b 点对应的溶液能使无色酚酞溶液变红 C、c 点时两者恰好完全反应 D、d 点对应的溶液含有三种溶质14. 人类常利用化学反应得到所需要的物质,如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现),则X、Y、Z、W依次可能是( ) A、C、CO、CO2、H2CO3 B、H2O2、O2、H2O、H2 C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO415. 在粗盐提纯的分组实验中,小民同学在计算产率时发现产率明显偏高,他进行了深刻的反思,造成产率偏高的原因可能是( )
A、C、CO、CO2、H2CO3 B、H2O2、O2、H2O、H2 C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO415. 在粗盐提纯的分组实验中,小民同学在计算产率时发现产率明显偏高,他进行了深刻的反思,造成产率偏高的原因可能是( )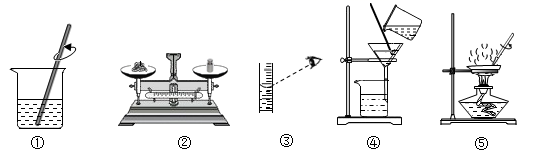 A、操作①中粗盐没有充分溶解 B、操作④中有液体溅出 C、操作⑤中水分没有完全蒸干 D、操作⑤中没有使用玻璃棒搅拌
A、操作①中粗盐没有充分溶解 B、操作④中有液体溅出 C、操作⑤中水分没有完全蒸干 D、操作⑤中没有使用玻璃棒搅拌二、综合题
-
16. “十四五”期间,我国将独立完成“天宫二号”空间实验室建造。(1)、运载火箭使用的燃料有液氢、煤油等。
①氢气目前还不能在生活和生产中大规模使用的原因之一是(填字母)。
a.制取成本高 b.产物无污染 c.燃烧热值高
②为使煤油充分燃烧,一是要有足够的氧气,二是。
(2)、长期驻留空间实验室会导致航天员肌肉萎缩、骨钙丢失。通过航天食品摄取优质蛋白质、补充钙元素有利于维持航天员的身体健康。①下列航天食品中富含蛋白质的是(填字母)。
a.脱水米饭 b.鱼香肉丝 c.冻干水果
②可在航天食品中添加(填字母)来补钙。
a.C12H22O14Ca b. FeC6H6O7 c.KIO3
(3)、舱段建造使用的新型铝基碳化硅复合材料是由颗粒状的铝和碳化硅(SiC)复合而成。①铝在空气中具有很好的抗腐蚀性能,原因是。
②制取SiC的反应为 。关于该反应说法正确的是(填字母)。
a.SiO2是由Si原子和O2分子构成 b.反应前后元素的化合价均未发生变化
c.反应后固体减少的质量等于生成的CO质量
17. 新型高导热镁合金常用作电动汽车和消费电子产品的散热器。请根据图回答有关问题。 (1)、由图1可知,镁的相对原子质量为。(2)、图2为镁离子的结构示意图,则X的数值为。表示镁离子的符号为。(3)、以化合价为纵坐标、物质类别为横坐标所绘制的图叫价类二维图。图3为镁的价类二维图,B处的物质类别是。MgO中镁元素与氧元素的质量比为。(4)、价类二维图中的物质在一定条件下可以相互转化,例如:
(1)、由图1可知,镁的相对原子质量为。(2)、图2为镁离子的结构示意图,则X的数值为。表示镁离子的符号为。(3)、以化合价为纵坐标、物质类别为横坐标所绘制的图叫价类二维图。图3为镁的价类二维图,B处的物质类别是。MgO中镁元素与氧元素的质量比为。(4)、价类二维图中的物质在一定条件下可以相互转化,例如:①镁单质可以跟一种单质反应生成一种氧化物,则该反应的化学方程式为。
②金属镁和水发生反应可以生成A和一种单质,则该反应的化学方程式为。
三、实验题
-
18. 如图是实验室制取气体的有关仪器和装置,据图回答下列问题。
 (1)、用加热氯酸钾和二氧化锰混合物的方法制取氧气,应选择(从A~G中选择,填字母序号,下同)组合装置,反应的化学方程式为。收集完气体后,应将装满气体的集气瓶(选填“正放”或“倒立”)在桌面上。(2)、实验室制取二氧化碳,反应的化学方程式为。为了便于控制反应速率,组合发生装置应选择。将气体通入H装置(从m口进入),还可以进行许多实验。下列实验不能达到预期目的的是(填序号)。
(1)、用加热氯酸钾和二氧化锰混合物的方法制取氧气,应选择(从A~G中选择,填字母序号,下同)组合装置,反应的化学方程式为。收集完气体后,应将装满气体的集气瓶(选填“正放”或“倒立”)在桌面上。(2)、实验室制取二氧化碳,反应的化学方程式为。为了便于控制反应速率,组合发生装置应选择。将气体通入H装置(从m口进入),还可以进行许多实验。下列实验不能达到预期目的的是(填序号)。①收集二氧化碳
②H中盛澄清石灰水,检验二氧化碳
③H中盛满水,n口连接量筒,测二氧化碳的体积
④H中盛氢氧化钠溶液,除去二氧化碳中的氯化氢气体
(3)、小明同学设计一套实验室制取二氧化碳的发生装置(如图),其突出优点是。该发生装置(填“能”或“不能”)用于稀硫酸和锌粒反应制氢气。
四、科学探究题
-
19. 化学社团的同学在探究金属化学性质时,进行了如图1所示的实验。

 (1)、图1实验中观察到的现象是:锌片表面产生气泡,铜片表面。锌和稀硫酸反应的化学方程式为。
(1)、图1实验中观察到的现象是:锌片表面产生气泡,铜片表面。锌和稀硫酸反应的化学方程式为。实验过程中小李意外发现:当两种金属发生触碰时(如图2),铜片表面产生了气泡。
(2)、【提出问题】图2中铜是否发生了化学反应?产生的气体是什么?【作出猜想】同学们对产生的气体进行了以下猜想:
小文猜想是二氧化硫:小李猜想是氧气;小华猜想是氢气。他们作出猜想的理论依据是。
(3)、【查阅资料】①将锌片、铜片用导线连接后平行插入稀硫酸中,铜片表面产生气体。该反应过程中金属失去的电子通过导线发生了转移。
②二氧化硫能使品红溶液褪色。
【设计并进行实验】他们设计了图3装置进行实验,将产生的气体分别通过导管与图4中的装置连接,验证自己的猜想。
实验操作
实验现象
实验结论
小文
连接导管a与导管d,向品红溶液中通入气体一段时间
小华的猜想正确
小李
选用正确方法收集气体一段时间后,向试管内伸入带火星的木条
木条
小华
连接导管a与导管(填序号),收集气体后用拇指堵住试管口,靠近酒精灯火焰,移开拇指点火
气体燃烧,听到轻微的“噗”声
(4)、【教师释疑】图1实验中,锌与稀硫酸反应,锌失去电子,酸溶液中氢离子在锌片表面获得电子生成氢气。【学生感悟】图3实验中,酸溶液中的氢离子从铜片表面获得(选填“锌”或“铜”)失去的电子生成了氢气。
(5)、【得出结论】图2中两种金属触碰后铜(选填“有”或“没有”)发生化学反应。(6)、【延伸应用】制造钢制船闸门时,为防止铁被腐蚀,常在钢闸门表面安装比铁更活泼的金属。这种金属可以是____(填序号)A、锌 B、铜 C、银五、流程题
-
20. 海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图1)回答问题:

 (1)、海水“晒盐”是通过(“蒸发结晶”或“降温结晶”)的方法获取粗盐。海水“制碱”的产物可用作氮肥的是。(2)、步骤I除杂中,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是____。A、①Ca(OH)2②Na2CO3 B、①Na2CO3②Ca(OH)2 C、①KOH ②Na2CO3 D、①NaOH ②Na2CO3(3)、步骤Ⅲ先向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水的pH值(填“>”“=”或“<”)7。先通入氨气再通入二氧化碳,这样做的目的是 , 写出步骤Ⅲ反应的化学方程式。(4)、步骤IV发生的反应属于反应(填基本反应类型)。(5)、步骤Ⅲ的产物中NaHCO3比NH4Cl先结晶析出。请结合生产原理及图2溶解度曲线解释其原因。(6)、我国化学家侯德榜创立的联合制碱法的优点有____。A、无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境 B、大大提高了食盐的利用率,节约了成本 C、将“制碱”与制氨生产联合起来,同时反应均不需要加热,可节约能源
(1)、海水“晒盐”是通过(“蒸发结晶”或“降温结晶”)的方法获取粗盐。海水“制碱”的产物可用作氮肥的是。(2)、步骤I除杂中,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是____。A、①Ca(OH)2②Na2CO3 B、①Na2CO3②Ca(OH)2 C、①KOH ②Na2CO3 D、①NaOH ②Na2CO3(3)、步骤Ⅲ先向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水的pH值(填“>”“=”或“<”)7。先通入氨气再通入二氧化碳,这样做的目的是 , 写出步骤Ⅲ反应的化学方程式。(4)、步骤IV发生的反应属于反应(填基本反应类型)。(5)、步骤Ⅲ的产物中NaHCO3比NH4Cl先结晶析出。请结合生产原理及图2溶解度曲线解释其原因。(6)、我国化学家侯德榜创立的联合制碱法的优点有____。A、无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境 B、大大提高了食盐的利用率,节约了成本 C、将“制碱”与制氨生产联合起来,同时反应均不需要加热,可节约能源六、计算题
-
21. 实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。
 (1)、某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水g。(2)、在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是。(3)、为测定该瓶溶液的溶质质量分数,他们取35g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
(1)、某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水g。(2)、在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是。(3)、为测定该瓶溶液的溶质质量分数,他们取35g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):反应时间/min
0
1
2
3
4
5
6
锥形瓶+瓶内物质的总质量/g
340.00
338.78
335.64
335.2
335.20
335.20
335.20
请回答:
①反应生成氧气的总质量为 ▲ g。
②该瓶过氧化氢溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
-
-
-