河南省南阳市六校2021-2022学年高一下学期4月份期中联考化学试题
试卷更新日期:2022-05-05 类型:期中考试
一、单选题
-
1. 变废为宝历来是化学重要的研究领域,二氧化碳催化循环再利用制备甲烷的过程如图所示。该图示中涉及的下列元素中不属于短周期元素的是( )
 A、碳 B、氧 C、镁 D、钯2. 二氧化氯(ClO2)具有强氧化性,可用于处理工业废水中的 , 下列有关说法正确的是( )A、的结构示意图:
A、碳 B、氧 C、镁 D、钯2. 二氧化氯(ClO2)具有强氧化性,可用于处理工业废水中的 , 下列有关说法正确的是( )A、的结构示意图: B、CO2分子的空间结构是角形
C、中子数为8的氮原子:
D、的电子式:
B、CO2分子的空间结构是角形
C、中子数为8的氮原子:
D、的电子式: 3. 下列过程的能量变化符合图示过程的是( )
3. 下列过程的能量变化符合图示过程的是( ) A、煅烧石灰石 B、水分解 C、碘升华 D、铁生锈4. 下列关于化学反应速率和化学反应限度的说法正确的是( )A、化学反应速率只能用单位时间内反应物浓度的减少来表示 B、反应速率数值大的反应进行得一定快 C、对于可逆反应而言,物质的浓度不变时,反应一定达到了该条件下的限度 D、一定条件下,可逆反应达到最大限度时,反应没有停止5. 浩瀚的海洋里蕴藏着丰富的化学资源。实验室里从海带灰中提取碘单质的操作涉及的装置为( )A、
A、煅烧石灰石 B、水分解 C、碘升华 D、铁生锈4. 下列关于化学反应速率和化学反应限度的说法正确的是( )A、化学反应速率只能用单位时间内反应物浓度的减少来表示 B、反应速率数值大的反应进行得一定快 C、对于可逆反应而言,物质的浓度不变时,反应一定达到了该条件下的限度 D、一定条件下,可逆反应达到最大限度时,反应没有停止5. 浩瀚的海洋里蕴藏着丰富的化学资源。实验室里从海带灰中提取碘单质的操作涉及的装置为( )A、 B、
B、 C、
C、 D、
D、 6. 在反应中,下列表示的该反应速率最快的是( )A、 B、 C、 D、7. 如图所示,在锥形瓶中放入一支试管,试管中加入下列物质中的一种:①NaOH固体、②生石灰、③晶体、④固体、⑤粉末。U形玻璃管中盛有品红溶液,开始时溶液两端高度一致,用胶头滴管向试管中加入适量水,U形玻璃管中的品红溶液呈现如图状态,判断试管中加入的物质可能是( )
6. 在反应中,下列表示的该反应速率最快的是( )A、 B、 C、 D、7. 如图所示,在锥形瓶中放入一支试管,试管中加入下列物质中的一种:①NaOH固体、②生石灰、③晶体、④固体、⑤粉末。U形玻璃管中盛有品红溶液,开始时溶液两端高度一致,用胶头滴管向试管中加入适量水,U形玻璃管中的品红溶液呈现如图状态,判断试管中加入的物质可能是( ) A、①②④ B、只有③ C、③⑤ D、全部8. 某水果电池的结构如图所示,下列说法正确的是( )
A、①②④ B、只有③ C、③⑤ D、全部8. 某水果电池的结构如图所示,下列说法正确的是( ) A、锌片作负极,发生还原反应 B、电池工作时,电子从锌片经灯流向铜片 C、电池工作时,锌片变细铜片变粗 D、电池工作结束后柠檬的酸性变强9. 1919年,卢瑟福用α粒子轰击氮核发现了质子,其核反应为。下列说法错误的是( )A、的质量数为14 B、X元素位于第二周期ⅥA族 C、与互为同位素 D、上述反应属于化学变化10. 用一根铁钉与30mL3 mol∙L−1硫酸反应制取 , 若要增大反应速率,可采取的措施是( )
A、锌片作负极,发生还原反应 B、电池工作时,电子从锌片经灯流向铜片 C、电池工作时,锌片变细铜片变粗 D、电池工作结束后柠檬的酸性变强9. 1919年,卢瑟福用α粒子轰击氮核发现了质子,其核反应为。下列说法错误的是( )A、的质量数为14 B、X元素位于第二周期ⅥA族 C、与互为同位素 D、上述反应属于化学变化10. 用一根铁钉与30mL3 mol∙L−1硫酸反应制取 , 若要增大反应速率,可采取的措施是( )①改用40mL3 mol∙L−1硫酸 ②改用30mL6 mol∙L−1硫酸 ③改用30mL18 mol∙L−1硫酸 ④适当升高温度 ⑤滴入少量溶液
A、①②③④ B、②③④⑤ C、①②④ D、②④⑤11. 下列离子方程式书写错误的是( )A、向硅酸钠溶液中加入稀硫酸: B、向氯化铝溶液中加入过量氨水: C、碘单质与浓氢氧化钠溶液反应: D、氯气与水反应:12. 下列说法正确的是( )A、放热反应中反应物的总能量小于生成物的总能量 B、将Mg、Al片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极 C、由甲烷、空气和稀硫酸构成的燃料电池的正极反应是O2+4e-+2H2O=4OH- D、充电电池可以无限制地反复放电、充电13. 短周期元素R的最高价含氧酸对应钾盐的化学式为 , 若R原子的质量数为x,则R元素形成的a g简单气态氢化物M中含氢原子的物质的量是( )A、 B、 C、 D、14. 短周期元素W、X、Y、Z的原子序数依次增大,W与Z同主族,Y的核外电子数是W的2倍,W与Z的原子序数之和是X的2倍,W是空气中含量最多的元素。下列说法正确的是( )A、原子半径:Y>Z>X>W B、简单氢化物的稳定性:Z>W>Y C、X、Y、Z属于同周期元素 D、四种元素的单质中,W单质的熔沸点最高15. 一定温度下,在某恒容密闭容器中发生反应: , 其中气体的物质的量变化曲线如图所示。下列说法正确的是( ) A、Q点Y的正反应速率和逆反应速率相等 B、从开始到达到平衡时用X表示的平均反应速率是 C、达到平衡后气体的平均相对分子质量不再改变 D、达到平衡后,再充入氩气,反应速率增大16. 五种短周期主族元素a、b、c、d、e在周期表中的相对位置如图所示,下列说法错误的是( )
A、Q点Y的正反应速率和逆反应速率相等 B、从开始到达到平衡时用X表示的平均反应速率是 C、达到平衡后气体的平均相对分子质量不再改变 D、达到平衡后,再充入氩气,反应速率增大16. 五种短周期主族元素a、b、c、d、e在周期表中的相对位置如图所示,下列说法错误的是( )a
b
c
d
e
A、五种元素可能都是非金属元素 B、五种元素原子的最外层电子数之和可能为30 C、若a的一种单质是自然界最硬的物质,则五种元素中最高价氧化物的水化物为强酸的只有e D、若五种元素中只有一种是金属元素,则c的最高价氧化物的水化物能与其简单氢化物反应二、元素或物质推断题
-
17. 短周期主族元素X、Y、Z、W的原子序数依次增大,Z可与X形成淡黄色固体化合物G;X与W可形成化合物W2X,该化合物溶于水可生成具有漂白性的物质;Y、W的最外层电子数相同。请回答下列问题:(1)、X的元素符号为;Y的原子结构示意图为。(2)、G中含有的化学键类型有;用电子式表示G的形成过程:。(3)、W2X的结构式为 , 其溶于水发生反应的化学方程式为。18. 短周期主族元素X、Y、Z和M的原子序数依次增大,相关信息如下表:
元素
相关信息
X
最外层电子数是核外电子总数的
Y
地壳中含量最多的元素
Z
Z的质子数比Y的质子数多1
M
M与X同主族
请回答下列问题:
(1)、Z的元素符号是 , X元素灼烧时火焰呈现的颜色是。(2)、Y原子的得电子能力比Z原子的得电子能力(填“强”或“弱”),原因是(从原子结构角度分析)。(3)、写出X的单质在单质中燃烧的化学方程式: , 单质 , 与单质的关系是。(4)、设计实验比较X与M原子的失电子能力强弱:。三、填空题
-
19. 已知反应:。将一定量气体充入某恒容密闭容器中,控制反应温度为T。(1)、该反应为吸热反应,则断开化学键所需要的总能量(填“大于”“小于”或“等于”)形成化学键放出的总能量。(2)、下列可以说明该反应达到平衡的是____(填序号)。A、气体的压强不再变化 B、 C、容器内气体的颜色不再变化 D、容器内气体的密度不再变化(3)、在温度为T的条件下,向某恒容密闭容器中充入 , 随时间的变化曲线如图所示。

①在图中画出时间段内,随时间的变化曲线。
②内用表示的平均反应速率v(NO2)= ;四个点中,v正>v逆的点有。
20. 能量转化是化学变化的主要特征之一,按要求回答下列问题。(1)、页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是____(填序号)。A、页岩气属于新能源 B、页岩气和氧气的反应是放热反应 C、甲烷中每个原子的最外层电子排布都达到8电子稳定结构 D、页岩气可以作燃料电池的负极燃料(2)、有关的电池装置如下:电池装置
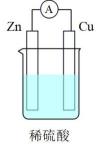
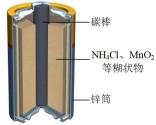
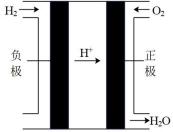
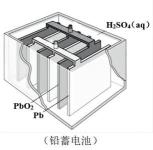
编号
a
b
c
d
①上述四种电池中,属于二次电池的是(填序号,下同),属于干电池的是。
②a装置中,外电路中电子的流向是(填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若电解质改为碱性介质,则负极的电极反应式为。
(3)、氧化还原反应一般可以设计成原电池。若将反应设计成原电池,则:①该电池的电解质溶液可以是。
②当外电路中转移1mol e-时,电解质溶液增加的质量是g。
四、综合题
-
21. 为了验证Cl、Br、S原子的得电子能力,设计如下实验装置图。

请回答下列问题:
(1)、仪器b的名称是。(2)、装置A中导管a的作用是。(3)、若装置发生堵塞,则装置B中可以观察到的现象是。(4)、该实验装置中能说明Cl原子的得电子能力比Br原子的强的离子方程式为。(5)、装置D中进行的实验存在的明显不足之处是(答一点)。(6)、溶液X可能是。