浙教科学八下第三章1-4节培优卷
试卷更新日期:2022-04-30 类型:单元试卷
一、单选题
-
1. 下列有关对质量守恒定律的理解,正确的是( )A、10g水加热产生10g水蒸气,物质的总质量不变,遵循质量守恒定律 B、化学反应前后分子的总数一定不会发生变化 C、1g氢气和8g氧气完全反应后,生成水的质量为9g D、镁条燃烧后质量增加,不遵循质量守恒定律2. 某盐的化学式为MaNb , 其电离方程式正确的是( )A、MaNb=aMa++bNb- B、MaNb=bMa-+aNb- C、MaNb=aMb++bNa- D、MaNb=Mb++Na-3. 物质的性质决定用途.下列有关二氧化碳的用途不正确的是( )A、用于灭火 B、作气体肥料 C、供给呼吸 D、作化工原料4. 中美贸易战加剧,我国通信设备制造商中兴公司遭美国封杀。华为公司最新芯片麒麟980处理器的应用,摆脱了对美国产品的依赖。芯片主要以高纯度的单质硅(Si)为原料制成,在半导体硅元件生产中,常用氢氟酸(HF)来清除硅表面的氧化膜,反应原理可表示为SiO2+6HF=H2SiF6+2X。已知硅元素显+4价。下列说法错误的是( )A、生成物X的化学式是H2O B、H2SiF6中氟元素显-1价 C、该反应是复分解反应 D、地壳中硅元素含量仅次于氧元素5. 有碳酸钙和氧化钙的混合物16g,其中含钙元素的质量分数为50%,与一定量某浓度的稀盐酸恰好完全反应,得到不饱和溶液157.2g,则所加稀盐酸的溶质质量分数为( )
A、7.3% B、10% C、14.6% D、20%6. 一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )A、5.6g B、8.8g C、4.4g D、4.8g7. 在一只盛有稀硫酸的烧杯中,漂浮着一块木块(如图),往烧杯中加入少量某种固体物质后,木块浸没在水中的体积变大(假设此过程中溶液的体积变化忽略不计),加入固体物质可能是( ) A、Fe B、Cu C、Ba(OH)2 D、Ba(NO3)28. 实验室为了收集干燥的二氧化碳气体,让制取的气体先后经过甲、乙两装置。下列关于甲、乙两装置导管的连接方式正确的是( )
A、Fe B、Cu C、Ba(OH)2 D、Ba(NO3)28. 实验室为了收集干燥的二氧化碳气体,让制取的气体先后经过甲、乙两装置。下列关于甲、乙两装置导管的连接方式正确的是( ) A、a接c B、a接d C、b接c D、b接d9. 有甲、乙、丙三种纯净物,甲为黑色固体,乙、丙为无色气体.点燃时,甲既能生成乙,也能生成丙;丙点燃也能生成乙.在以下关于这三种物质推断的叙述中,正确的是( )A、甲是一种化合物 B、乙是一氧化碳 C、丙是一氧化碳 D、丙是二氧化碳10.
A、a接c B、a接d C、b接c D、b接d9. 有甲、乙、丙三种纯净物,甲为黑色固体,乙、丙为无色气体.点燃时,甲既能生成乙,也能生成丙;丙点燃也能生成乙.在以下关于这三种物质推断的叙述中,正确的是( )A、甲是一种化合物 B、乙是一氧化碳 C、丙是一氧化碳 D、丙是二氧化碳10.把盛有5g 16%的NaOH溶液的短试管放入盛有10g 16%的CuSO4溶液的锥形瓶里,如图所示,倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是( )
 A、产生蓝色沉淀0.98g B、锥形瓶内物质总质量不变 C、所得溶液的Na2SO4质量分数大于9.5% D、所得的Na2SO4溶液质量与原CuSO4溶液质量相等
A、产生蓝色沉淀0.98g B、锥形瓶内物质总质量不变 C、所得溶液的Na2SO4质量分数大于9.5% D、所得的Na2SO4溶液质量与原CuSO4溶液质量相等二、填空题
-
11. 黑白复印机用的墨粉中常添加Fe3O4粉末.Fe3O4是由Fe2+、Fe3+和O2﹣按1:2:4的个数比构成的.下图是氧化沉淀法生产复印用Fe3O4粉末的流程简图.已知第④步反应中各元素化合价保持不变.
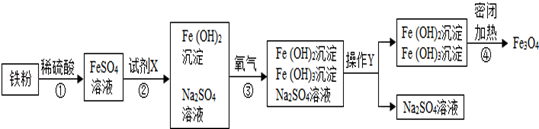 (1)、Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是色.(2)、第②步加入试剂X,生成Fe(OH)2的反应方程式为.(3)、在第③步反应中要控制通入O2的量,以使生成的Fe(OH)2和Fe(OH)3的质量比等于 , 才能确保最终生成Fe3O4.
(1)、Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是色.(2)、第②步加入试剂X,生成Fe(OH)2的反应方程式为.(3)、在第③步反应中要控制通入O2的量,以使生成的Fe(OH)2和Fe(OH)3的质量比等于 , 才能确保最终生成Fe3O4.三、解答题
-
12. 实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g。某实验小组将这份样品完全溶解,配成50 g溶液。然后缓慢滴入溶质质量分数为7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如表所示:
测量次数
第1次
第6次
第16次
第21次
第26次
滴加的稀盐酸总质量/g
0
5
15
20
25
溶液总质量/g
50
55
m
69.78
74.78
溶液pH
12.4
12.1
7.0
2.2
2.1
请分析计算:
(1)、第次测量时,溶液中只有一种溶质。(2)、表中m=。(3)、样品中碳酸钠的质量分数。(计算结果精确到0.1%)(4)、1.5g样品中氢氧化钠固体的质量。13. 某科学兴趣小组对潜艇的制氧原理产生了好奇,通过查阅资料得知,潜艇中制取氧气的主要原料是固体过氧化钠(Na2O2),过氧化钠分别能和二氧化碳、水反应,都能生成氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2↑为测定潜艇中过氧化钠的质量分数,该小组的同学在教师的指导下,利用下图所示的装置(固定装置已略去)开展探究,并得出正确结论。
已知装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物。整套装置气密性良好,反应所需试剂均足量。

请回答下列问题:
(1)、装置B的作用是;(2)、在A中不用稀硫酸而用稀盐酸原因;(3)、装置E作用;(4)、装置D中过氧化钠样品的质量为m g,装置D在反应前后质量分别为n1g和n2g,若样品中所含杂质既不溶于水,也不参加化学反应,求样品中过氧化钠的质量分数?14. 竹炭包是集观赏与空气净化为一体的产品。这种产品可对车内及室内空气中的一氧化碳、甲醛等有害气体进行吸附。某小组利用下图所示装置来对竹炭中是否含有碳元素进行初步探究。实验中,C装置中产生白色沉淀,E装置中新鲜的鸡血变为暗红色。(查阅资料可知新鲜的血液,遇一氧化碳由鲜红变为暗红色) (1)、由实验现象可知,竹炭燃烧后的产物是。(2)、装置A的作用是。(3)、小科认为可以用F装置,替换E装置,你认为是否可行并且说明原因。
(1)、由实验现象可知,竹炭燃烧后的产物是。(2)、装置A的作用是。(3)、小科认为可以用F装置,替换E装置,你认为是否可行并且说明原因。
-