浙江省绍兴市柯桥区2020-2021学年高一下学期期末教学质量调测化学试题
试卷更新日期:2022-04-22 类型:期末考试
一、单选题
-
1. 乙炔的分子式为( )A、 B、 C、 D、2. 按物质的组成进行分类,氧化钠属于( )A、酸性氧化物 B、碱性氧化物 C、两性氧化物 D、碱3. 下列物质不能做食品添加剂的是( )A、氯化镁 B、山梨酸钾 C、亚硝酸钠 D、三聚氰胺4. 在某体检报告中,表示血糖指标的物理量一般是( )A、物质的量浓度 B、质量分数 C、溶解度 D、摩尔质量5. 下列物质中,含有自由移动的是( )A、溶液 B、熔融态的 C、溶液 D、气体6. 下列物质之间的转化,需要加入还原剂才能实现的是( )A、 B、 C、 D、7. 下列说法正确的是( )A、煤的液化和气化发生的均是物理变化 B、化合价发生变化是氧化还原反应的本质特征 C、处方药需要凭医生处方,其包装上有“OTC”标识 D、门捷列夫将元素按相对原子质量由小到大排列,并将化学性质相似的元素放在一个纵列,制出了第一张元素周期表8. 用化学用语表示中的相关微粒,其中正确的是( )A、氧气的电子式:
 B、钠离子的结构示意图:
B、钠离子的结构示意图: C、的结构式:
D、固体中含有非极性共价键和离子键
9. 下列说法不正确的是( )A、金刚石和石墨互为同素异形体 B、表示质子数为6、中子数为8的核素 C、乙醇和二甲醚互为同系物 D、丙烷的一氯代物和正丁烷的一氯代物种数相同10. 下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是( )
C、的结构式:
D、固体中含有非极性共价键和离子键
9. 下列说法不正确的是( )A、金刚石和石墨互为同素异形体 B、表示质子数为6、中子数为8的核素 C、乙醇和二甲醚互为同系物 D、丙烷的一氯代物和正丁烷的一氯代物种数相同10. 下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是( )选项
A
B
C
D
生活中的物质
食盐
小苏打
复方氢氧化铝片
漂白粉
有效成分的化学式
用途
做调味品
做发酵粉
做抗酸药
做消毒剂
A、A B、B C、C D、D11. 下列说法正确的是( )A、晶体溶于水时,离子键被破坏,共价键不受影响 B、氢化物稳定性比较:;酸性比较: C、的热稳定性小于 D、易分解是因为分子间作用力弱12. 下列离子方程式书写正确的是( )A、与水溶液反应: B、氯气溶于水且与水反应: C、二氧化硅和氢氧化钠溶液反应: D、铜和氯化铁溶液反应:13. 下列有关实验操作的说法,不正确的是( )A、实验室可以将金属钾保存在煤油中 B、可用溶液鉴别、和 C、碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗 D、用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体14. 下列说法不正确的是( )A、石油的裂化主要是为了得到更多的轻质油 B、强酸、强碱、重金属盐等可使蛋白质变性 C、花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物 D、油脂、多糖和蛋白质都能发生水解反应15. 下列说法正确的是( )A、光照下,等物质的量的甲烷与氯气反应的产物是 B、属于加成反应 C、乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈 D、可用含氢氧化钠的氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸16. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.下列图示对应的操作规范的是( )A、 称量
B、
称量
B、 溶解
C、
溶解
C、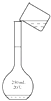 转移
D、
转移
D、 定容
17. 当光束通过下列物质时,会出现丁达尔效应的是( )
定容
17. 当光束通过下列物质时,会出现丁达尔效应的是( )①酒精溶液 ②胶体 ③溶液 ④云、雾 ⑤泥浆水
A、②④ B、①③⑤ C、③④⑤ D、①②④18. 下列说法正确的是( ) A、图1所示装置能将化学能转变为电能 B、图2所示反应为吸热反应 C、锌锰干电池属于一次电池,其中的石墨棒作负极 D、蓄电池在充电时发生了氧化还原反应19. 五种短周期元素的信息见下表,下列叙述正确的是( )
A、图1所示装置能将化学能转变为电能 B、图2所示反应为吸热反应 C、锌锰干电池属于一次电池,其中的石墨棒作负极 D、蓄电池在充电时发生了氧化还原反应19. 五种短周期元素的信息见下表,下列叙述正确的是( )元素代号
L
M
Q
R
T
原子半径/
0.160
0.089
0.143
0.102
0.074
化合价
,
A、L,M的单质与稀盐酸反应速率 B、Q,T两元素间可形成两性化合物 C、R,T两元素的氢化物分子间均能形成氢键 D、L,Q,T三种元素的简单离子的离子半径:20. 已知:X(g)+2Y(g) 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是( ) A、0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol B、达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C、达到化学平衡状态时,反应放出的总热量可达a kJ D、升高反应温度,逆反应速率增大,正反应速率减小21. 工业上合成乙苯的反应为:
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是( ) A、0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol B、达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C、达到化学平衡状态时,反应放出的总热量可达a kJ D、升高反应温度,逆反应速率增大,正反应速率减小21. 工业上合成乙苯的反应为: , 下列说法不正确的是( ) A、该反应属于加成反应 B、化合物丙的一氯取代物有5种 C、化合物甲由碳原子以单键、双键相互交替结合而成 D、等质量的甲和乙充分燃烧消耗的量:甲<乙22. 下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
, 下列说法不正确的是( ) A、该反应属于加成反应 B、化合物丙的一氯取代物有5种 C、化合物甲由碳原子以单键、双键相互交替结合而成 D、等质量的甲和乙充分燃烧消耗的量:甲<乙22. 下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( ) A、在通常情况下,O2比N2稳定 B、吸热反应一定需要加热才能发生 C、1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量 D、1 mol N2(g)和NA个O2(g)充分反应生成2 mol NO(g)放出的能量为180kJ23. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
A、在通常情况下,O2比N2稳定 B、吸热反应一定需要加热才能发生 C、1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量 D、1 mol N2(g)和NA个O2(g)充分反应生成2 mol NO(g)放出的能量为180kJ23. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )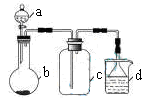
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸(70%)
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A、A B、B C、C D、D24. 某电镀厂有两种废水,分别含有CN-和Cr2O等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
下列说法不正确的是( )
A、上述流程图中,NaClO作氧化剂,Na2S2O3作还原剂 B、可以用ClO2代替NaClO除去CN- C、Cr3+的进一步处理方法可以是调节pH值使其生成Cr(OH)3沉淀,过滤而除去。 D、反应②中每消耗1mol Cr2O转移电子的数目为3NA (NA表示阿伏加德罗常数)25. 下列实验操作、现象和得出的结论正确的是( )选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有
B
向溶液中加入盐酸酸化的氯化钡
产生白色沉淀
溶液中一定含有
C
把铝片插入浓硫酸中
无明显现象
常温下铝与浓硫酸不反应
D
取溶液于试管中,加入溶液,充分反应后滴入5滴溶液
溶液变血红色
与的反应有一定限度
A、A B、B C、C D、D二、填空题
-
26.(1)、①写出胆矾的化学式
②写出葡萄糖的结构简式
(2)、写出红热的铁与水蒸气反应的化学方程式(3)、写出氯化铝溶液中滴加过量氨水的离子反应方程式三、综合题
-
27. 丙烯酸乙酯是一种食品用合成香料,可用以下方法合成:

请回答:
(1)、乙烯的电子式为;有机物A中含有的官能团名称为;(2)、有机物B的结构简式为;(3)、下列说法不正确的是____A、乙烯生成有机物A的反应类型为取代反应 B、聚乙烯、丙烯和丙烯酸乙酯均可使酸性高锰酸钾溶液褪色 C、丙烯酸乙酯可以发生氧化、加成、水解、聚合等反应 D、可以用新制碱性悬浊液区分有机物A、B、C(4)、有机物A和C反应的化学方程式为(5)、请写出发生聚合反应的方程式28. 某化合物X由三种元素组成,其转化关系如下图所示:
已知:无色气体3在空气中转变为红棕色气体1。
回答以下问题:
(1)、在元素周期表中的位置;(2)、步骤②的化学反应方程式是;(3)、气体1与水发生反应的离子反应方程式;(4)、鉴别红棕色气体1与蒸气的下列方法中,合理的是____A、通入水中观察溶液的颜色变化 B、直接观察两种气体的颜色 C、分别通入溶液中观察有否沉淀 D、用湿润的淀粉试纸检验是否变蓝色(5)、化合物X的化学式为29. 实验室制备少量的方法是:在不断搅拌下,控制反应温度在左右,向过饱和溶液中通入足量 , 即可制得。实验装置如下:
已知:焦亚硫酸钠是常见的抗氧化剂,在空气中、受热均易分解;
酸性:
请回答:
(1)、任写一个能得到的化学反应方程式(2)、在锥形瓶中生成的反应分两个过程,分别可表示为(用离子方程式表示)、。(3)、下列说法正确的是____A、装置X中通气体的末端是带许多小孔的玻璃球泡,其主要作用是防止堵塞 B、装置Y的作用是防止倒吸 C、装置Z中的溶液A可以是溶液 D、过饱和碳酸钠溶液性质稳定,在相同条件下其浓度小于饱和溶液的浓度(4)、实验制得的固体中含一定量和 , 其可能的原因是。四、计算题
-
30. 由铜和三氧化二铁组成的混合粉末共 , 加入到浓度为的硫酸中,使之充分反应。(1)、若硫酸溶液过量,且测得反应后溶液中和的物质的量相等,则原混合物中铜的质量为g;(2)、若固体混合物恰好能全部溶解在硫酸中,且消耗的硫酸体积为 , 求V的最小值,并简要写出推理及计算过程。
-