四川省巴中市2020-2021学年高一下学期期末学情检测化学试题
试卷更新日期:2022-04-22 类型:期末考试
一、单选题
-
1. “无色而具图画的灿烂,无声而有音乐的和谐”描述书法之美。书法之美尽在笔墨纸砚之间(如图所示钟繇的“宣示帖”)。下列说法不正确的是( )
 A、墨汁是一种水溶液 B、宣纸主要成分是纤维素 C、砚石主要成分属于无机非金属材料 D、制笔的羊毫主要含有、、、元素2. 蒸馏是常见分离或提纯操作,下列仪器不需要用到的是( )A、
A、墨汁是一种水溶液 B、宣纸主要成分是纤维素 C、砚石主要成分属于无机非金属材料 D、制笔的羊毫主要含有、、、元素2. 蒸馏是常见分离或提纯操作,下列仪器不需要用到的是( )A、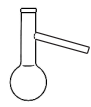 B、
B、 C、
C、 D、
D、 3. 下列物质属于纯净物的是( )A、油脂 B、铝热剂 C、煤焦油 D、乙酸乙酯4. 下列说法不正确的是( )A、疫苗一般应冷藏存放,以避免蛋白质变性 B、用水煤气可合成液态碳氢化合物和含氧有机物 C、煤的液化属于物理变化 D、火棉是一种纤维素硝酸酯5. 下列指定反应的离子方程式正确的是( )A、银与稀反应: B、溶液中滴加少量溴水: C、钾与水反应: D、溶液中通入少量:6. 下列说法不正确的是( )A、乙烷室温下能与氯水发生取代反应 B、乙烯可以用作生产食品包装材料的原料 C、乙酸乙酯可用作食品添加剂 D、乙醛可用于制取乙酸7. 下列表示正确的是( )A、氮气的电子式 B、乙酸的球棍模型
3. 下列物质属于纯净物的是( )A、油脂 B、铝热剂 C、煤焦油 D、乙酸乙酯4. 下列说法不正确的是( )A、疫苗一般应冷藏存放,以避免蛋白质变性 B、用水煤气可合成液态碳氢化合物和含氧有机物 C、煤的液化属于物理变化 D、火棉是一种纤维素硝酸酯5. 下列指定反应的离子方程式正确的是( )A、银与稀反应: B、溶液中滴加少量溴水: C、钾与水反应: D、溶液中通入少量:6. 下列说法不正确的是( )A、乙烷室温下能与氯水发生取代反应 B、乙烯可以用作生产食品包装材料的原料 C、乙酸乙酯可用作食品添加剂 D、乙醛可用于制取乙酸7. 下列表示正确的是( )A、氮气的电子式 B、乙酸的球棍模型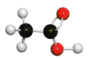 C、硫原子结构示意图
C、硫原子结构示意图 D、甲酸乙酯的结构简式
8. 已知NA是阿伏加德罗常数的值,下列说法不正确的是( )A、含有的中子数为NA B、与足量盐酸反应,转移电子数为0.2NA C、溶液中含有的氧原子数目为0.2NA D、正丁烷和异丁烷的混合物中共价键数目为13NA9. 下列化学反应,属于取代反应的是( )A、 B、HOCH2CH2OH+
D、甲酸乙酯的结构简式
8. 已知NA是阿伏加德罗常数的值,下列说法不正确的是( )A、含有的中子数为NA B、与足量盐酸反应,转移电子数为0.2NA C、溶液中含有的氧原子数目为0.2NA D、正丁烷和异丁烷的混合物中共价键数目为13NA9. 下列化学反应,属于取代反应的是( )A、 B、HOCH2CH2OH+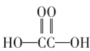
 +H2O
C、nCH2=CH-CH3
+H2O
C、nCH2=CH-CH3 D、
D、 +NaOH→
+NaOH→ +H2O
10. 下列事实不能说明元素的金属性或非金属性相对强弱的是( )
+H2O
10. 下列事实不能说明元素的金属性或非金属性相对强弱的是( )选项
事实
推论
A
与冷水反应,比剧烈
金属性:
B
的碱性强于
金属性:
C
与溶液反应生成
非金属性:
D
非金属性:
A、A B、B C、C D、D11. 实验室制取硝基苯常采用如图装置,下列说法不正确的是( ) A、导管①有冷凝回流的作用 B、该反应条件为:浓硫酸、水浴加热 C、试管②中硝化反应属于加成反应 D、反应产物可用蒸馏方法提纯12. 实验室制取乙酸乙酯:CH3COOH + C2H5OHCH3COOC2H5 +H2O。下列操作或装置能达到实验目的的是( )
A、导管①有冷凝回流的作用 B、该反应条件为:浓硫酸、水浴加热 C、试管②中硝化反应属于加成反应 D、反应产物可用蒸馏方法提纯12. 实验室制取乙酸乙酯:CH3COOH + C2H5OHCH3COOC2H5 +H2O。下列操作或装置能达到实验目的的是( )A
B
C
D




混合反应物
生成乙酸乙酯
收集乙酸乙酯
分离乙酸乙酯
A、A B、B C、C D、D13. 某有机物的结构简式如图所示,则下列有关说法不正确的是( ) A、分子式为 B、苯环及侧链上均可发生取代反应 C、该有机物最多能和反应 D、分子中的所有原子都在同一平面上14. 利用固体表面催化工艺进行分解的过程如下图所示。
A、分子式为 B、苯环及侧链上均可发生取代反应 C、该有机物最多能和反应 D、分子中的所有原子都在同一平面上14. 利用固体表面催化工艺进行分解的过程如下图所示。
下列说法不正确的是( )
A、属于共价化合物 B、含有非极性共价键 C、过程②断键吸热,其中黑色小球代表N原子 D、标准状况下,分解生成 , 转移电子数为15. 火箭常用联氨()作燃料,四氧化二氮()作助燃剂,生成物不会对大气造成污染。下列叙述正确的是( )A、中的氮元素为-3价 B、与四氧化二氮反应后的产物是与 C、与相比,后者的沸点更高 D、的结构式为: 16. 某烃分子中同时存在这四种基团:、、
16. 某烃分子中同时存在这四种基团:、、 、
、 , 则该烃最少含有的碳原子数应是( ) A、6 B、7 C、8 D、917. 乙烯是一种重要的化工原科。下利物质中,不能通过乙烯的加成反应一步制得的是( )A、CH3COOH B、CH3CH2OH C、CH3CH2Cl D、BrCH2CH2Br18. 、、为原子序数依次增大的短周期元素,原子的最外层电子数是其电子层数的3倍。、在同一主族,且、均与相邻。下列说法正确的是( )A、非金属性: B、元素最高价氧化物对应水化物属于强酸 C、简单氢化物的稳定性: D、简单离子半径:19. 下列“实验结论”与“实验操作及现象”不相符的一组是( )
, 则该烃最少含有的碳原子数应是( ) A、6 B、7 C、8 D、917. 乙烯是一种重要的化工原科。下利物质中,不能通过乙烯的加成反应一步制得的是( )A、CH3COOH B、CH3CH2OH C、CH3CH2Cl D、BrCH2CH2Br18. 、、为原子序数依次增大的短周期元素,原子的最外层电子数是其电子层数的3倍。、在同一主族,且、均与相邻。下列说法正确的是( )A、非金属性: B、元素最高价氧化物对应水化物属于强酸 C、简单氢化物的稳定性: D、简单离子半径:19. 下列“实验结论”与“实验操作及现象”不相符的一组是( )选项
实验操作及现象
实验结论
A
向某溶液中加入足量稀盐酸,无明显现象;再加入 溶液,有白色沉淀产生
原溶液中一定含有
B
某溶液中滴加 溶液,无明显现象;再滴加氯水,溶液呈红色
原溶液一定含
C
向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体
该溶液中一定含有
D
向某溶液中加入浓 溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
该溶液中一定含有
A、A B、B C、C D、D20. 下列说法不正确的是( )A、金刚石和石墨、和均属于同素异形体 B、、、互为同位素 C、、、互为同系物 D、乙醇和甲醚互为同分异构体21. 下列“类比”合理的是( )A、与冷反应生成和 , 则与冷反应生成和 B、溶液与少量液反应生成和 , 则氨水与少量溶液反应生成和 C、含有离子键的物质一定是离子化合物,含有共价键的物质一定是共价化合物 D、葡萄糖不能水解,果糖也不能水解22. 下列有关性质的比较,能用元素周期律解释的是( )A、密度: B、酸性: C、沸点: D、稳定性:23. 分子式为C3H6ClBr的有机物共有(不考虑立体异构):( )A、2种 B、3种 C、4种 D、5种24. 过量排放对环境影响很大,发展“低碳经济”是全社会的共识。下列说法不正确的是( )A、大量排放导致酸雨 B、将转变为稳定的碳酸盐,可实现的长期封存 C、利用合成聚碳酸酯类可降解塑料,可实现“碳”的循环利用 D、利用化学试剂吸收可实现“碳捕捉”25. 我国碘盐中常加入碘酸钾()。已知在溶液中和可发生反应:。为验证食盐中存在 , 可供选用的试剂和常见的物质有:①自来水;②碘化钾淀粉试纸;③淀粉;④蓝色石蕊试纸;⑤食醋。进行实验时必须使用的物质是( )A、①②④ B、②③ C、②⑤ D、②④⑤二、填空题
-
26. 如图将元素周期表左侧对齐,每格代表一种元素。回答下列问题:
 (1)、表中元素⑤的最高化合价为 , 元素⑧的原子序数为。(2)、元素②、③、④的原子半径从大到小的顺序是(用元素符号表示),元素⑤、⑦的单质中熔、沸点较高的是(填分子式),解释熔、沸点较高的原因。(3)、高温灼烧由元素⑤、⑥组成的化合物时,火焰呈色。(4)、元素①与②组成含有18电子化合物的结构式为 , 其中共价键类型为。(5)、某种化合物由元素①、②、③组成,取该化合物与足量元素④的单质反应,标况下生成 , 该反应的化学方程式为。
(1)、表中元素⑤的最高化合价为 , 元素⑧的原子序数为。(2)、元素②、③、④的原子半径从大到小的顺序是(用元素符号表示),元素⑤、⑦的单质中熔、沸点较高的是(填分子式),解释熔、沸点较高的原因。(3)、高温灼烧由元素⑤、⑥组成的化合物时,火焰呈色。(4)、元素①与②组成含有18电子化合物的结构式为 , 其中共价键类型为。(5)、某种化合物由元素①、②、③组成,取该化合物与足量元素④的单质反应,标况下生成 , 该反应的化学方程式为。三、综合题
-
27. 硫酸是重要的实验试剂。根据相关实验填空:
 (1)、仪器的名称是;装置中的现象为 , 证明产物中含有(填分子式);装置作用为;圆底烧瓶中发生反应的化学方程式为。(2)、利用乙醇、浓硫酸和乙酸制取乙酸乙酯。向试管中首先加入的试剂是 , 实验中浓硫酸的作用为。(3)、淀粉在稀硫酸催化下,水解为葡萄糖,化学反应方程式为。28. 高分子化合物是一种重要工业原料,其单体不溶于水,可以发生如图变化。请回答下列问题:
(1)、仪器的名称是;装置中的现象为 , 证明产物中含有(填分子式);装置作用为;圆底烧瓶中发生反应的化学方程式为。(2)、利用乙醇、浓硫酸和乙酸制取乙酸乙酯。向试管中首先加入的试剂是 , 实验中浓硫酸的作用为。(3)、淀粉在稀硫酸催化下,水解为葡萄糖,化学反应方程式为。28. 高分子化合物是一种重要工业原料,其单体不溶于水,可以发生如图变化。请回答下列问题: (1)、有机物的分子式是。(2)、有机物
(1)、有机物的分子式是。(2)、有机物 中官能团的名称为、。 (3)、反应①的反应类型为;反应⑤的反应类型为。(4)、的某种同分异构体符合下列条件,其结构简式为。
中官能团的名称为、。 (3)、反应①的反应类型为;反应⑤的反应类型为。(4)、的某种同分异构体符合下列条件,其结构简式为。①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气
(5)、反应②的化学方程式是。(6)、写出高分子化合物的结构简式:。29. 利用菱镁矿(含杂质、)制取镁的工艺流程如图:
已知:a.呈絮状,不易从溶液中除去。
b.常温下金属阳离子形成氢氧化物开始沉淀至完全沉淀的见下表:
阳离子
开始沉淀
2.7
7.6
9.6
完全沉淀
3.7
9.6
11.1
(1)、“酸浸”时,提高菱镁矿利用率可采取的措施是(任写一条)。(2)、“氧化”过程中试剂最佳选择为( )A、氯气 B、溶液 C、 D、(3)、氧化过程的离子方程式为 , 氧化过程中需要控制温度不宜过高,原因是。(4)、“调值”控制的范围是。(5)、沉淀混合物的成分是(填化学式)(6)、将溶液置于某容器中,经过、(操作②名称),过滤,洗涤烘干,制得晶体备用。(7)、常用电解法制备、单质,写出工业制铝的化学反应方程式。
-