陕西省渭南市富平县2020-2021学年高一下学期期末考试化学试题
试卷更新日期:2022-04-22 类型:期末考试
一、单选题
-
1. 物质之间发生化学反应时,一定发生变化的是( )A、颜色 B、状态 C、化学键 D、原子核2. 下列设备工作时,主要将化学能转化为热能的是( )A、家用燃气灶
 B、锌锰干电池
B、锌锰干电池 C、锂离子电池
C、锂离子电池 D、硅太阳能电池
D、硅太阳能电池 3. 某元素离子Am-的核内有n个中子,核外有x个电子。该元素原子的质量数为( )A、x-n+m B、x+m+n C、m+n-x D、x-m+n4. 下列物质中既含有离子键又含有共价键的是( )A、 B、 C、 D、5. 如图是某有机物的球棍模型,该有机物是( )
3. 某元素离子Am-的核内有n个中子,核外有x个电子。该元素原子的质量数为( )A、x-n+m B、x+m+n C、m+n-x D、x-m+n4. 下列物质中既含有离子键又含有共价键的是( )A、 B、 C、 D、5. 如图是某有机物的球棍模型,该有机物是( )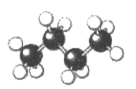 A、乙醇 B、丙烷 C、正丁烷 D、异丁烷6. 下列关于乙烯的说法中不正确的是( )A、乙烯可作为水果的催熟剂 B、乙烯的结构式为
A、乙醇 B、丙烷 C、正丁烷 D、异丁烷6. 下列关于乙烯的说法中不正确的是( )A、乙烯可作为水果的催熟剂 B、乙烯的结构式为 C、乙烯的含碳量低于甲烷
D、乙烯能使酸性高锰酸钾溶液褪色
7. 下列关于电子式的描述正确的是( )A、的电子式: H+
C、乙烯的含碳量低于甲烷
D、乙烯能使酸性高锰酸钾溶液褪色
7. 下列关于电子式的描述正确的是( )A、的电子式: H+ B、的形成过程:
B、的形成过程: →
→ C、的电子式:
C、的电子式: D、氨气的电子式:
D、氨气的电子式: 8. 某种塑料的结构可表示为
8. 某种塑料的结构可表示为 , 合成该塑料所需的原料是( ) A、CH3Cl B、CH2=CHCl C、CH3CH2Cl D、CHCl=CHCl9. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法不正确的是( )A、蚕丝的主要成分是蛋白质 B、“蜡炬成灰”的过程中发生了氧化反应 C、古代的蜡是高级脂肪酸酯,属于高分子化合物 D、现代蜡烛的主要成分可以通过石油的分馏得到10. 如图为的能量变化示意图,下列说法正确的是( )
, 合成该塑料所需的原料是( ) A、CH3Cl B、CH2=CHCl C、CH3CH2Cl D、CHCl=CHCl9. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法不正确的是( )A、蚕丝的主要成分是蛋白质 B、“蜡炬成灰”的过程中发生了氧化反应 C、古代的蜡是高级脂肪酸酯,属于高分子化合物 D、现代蜡烛的主要成分可以通过石油的分馏得到10. 如图为的能量变化示意图,下列说法正确的是( ) A、过程1释放能量 B、过程2吸收能量 C、该反应是放热反应 D、反应物的总键能大于生成物的总键能11. 镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是( )A、镭的金属性比钙弱 B、单质能与水反应生成H2 C、在化合物中呈+2价 D、碳酸镭难溶于水12. 用水就能鉴别的一组物质是( )A、苯、乙酸 B、乙醇、乙酸 C、苯、己烷 D、苯、汽油13. 工业上制硝酸的重要反应为 , 该反应在密闭条件下进行,下列说法不正确的是( )A、使用催化剂可以加快反应速率 B、达到平衡时,的浓度和的浓度相等 C、达到平衡时, D、在上述条件下,不可能全部转变为14. 某烃或该烃的某种同分异构体的一氯代物只有一种。则该烃的分子式不可以是( )A、C2H6 B、C4H10 C、C5H12 D、C8H1815. 图中装置或操作不能达到实验目的的是( )
A、过程1释放能量 B、过程2吸收能量 C、该反应是放热反应 D、反应物的总键能大于生成物的总键能11. 镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是( )A、镭的金属性比钙弱 B、单质能与水反应生成H2 C、在化合物中呈+2价 D、碳酸镭难溶于水12. 用水就能鉴别的一组物质是( )A、苯、乙酸 B、乙醇、乙酸 C、苯、己烷 D、苯、汽油13. 工业上制硝酸的重要反应为 , 该反应在密闭条件下进行,下列说法不正确的是( )A、使用催化剂可以加快反应速率 B、达到平衡时,的浓度和的浓度相等 C、达到平衡时, D、在上述条件下,不可能全部转变为14. 某烃或该烃的某种同分异构体的一氯代物只有一种。则该烃的分子式不可以是( )A、C2H6 B、C4H10 C、C5H12 D、C8H1815. 图中装置或操作不能达到实验目的的是( )


 A、图1中的实验现象能证明非金属性: B、图2可结合秒表测量锌与稀硫酸的反应速率 C、图3中,气体从口进入时,可用于收集、、等气体 D、图4可验证甲烷和氯气能发生反应16. 如表是元素周期表的一部分,、、、为短周期主族元素,与的最高化合价之和为8。下列说法不正确的是( )A、的单质能稳定存在是因为分子内部的共价键很难破坏 B、原子半径: C、的最高价氧化物对应的水化物是强酸 D、的最高价氧化物对应的水化物能溶于 , 不溶于氨水17. 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验。下列说法不正确的是( )
A、图1中的实验现象能证明非金属性: B、图2可结合秒表测量锌与稀硫酸的反应速率 C、图3中,气体从口进入时,可用于收集、、等气体 D、图4可验证甲烷和氯气能发生反应16. 如表是元素周期表的一部分,、、、为短周期主族元素,与的最高化合价之和为8。下列说法不正确的是( )A、的单质能稳定存在是因为分子内部的共价键很难破坏 B、原子半径: C、的最高价氧化物对应的水化物是强酸 D、的最高价氧化物对应的水化物能溶于 , 不溶于氨水17. 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验。下列说法不正确的是( )实验序号
实验温度/K
有关物质
溶液颜色褪至无色所用时间/s
酸性KMnO4溶液
H2C2O4溶液
H2O
V/mL
C/mol·L-1
V/mL
C/mol·L-1
V/mL
①
293
2
0.02
4
0.1
0
t1
②
293
2
0.02
3
0.1
1
8
③
313
2
0.02
3
0.1
1
t2
A、实验①②探究的是浓度对反应速率的影响 B、实验①③探究的是温度对反应速率的影响 C、t2<8 D、计算可得实验②中v(KMnO4)≈8.3×10-4mol•L-1•s-1(忽略溶液体积变化)18. 实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中不正确的是( ) A、②③ B、①③④ C、①②④ D、②③④19. 某烷烃在氧气中完全燃烧,生成物先通过浓硫酸,再通过碱石灰,如果生成物完全全被二者吸收,浓硫酸增重27g,碱石灰增重44g。该有机物的化学式为( )A、CH4 B、C2H6 C、C3H8 D、C4H1020. 下列实验操作能达到实验目的的是( )
A、②③ B、①③④ C、①②④ D、②③④19. 某烷烃在氧气中完全燃烧,生成物先通过浓硫酸,再通过碱石灰,如果生成物完全全被二者吸收,浓硫酸增重27g,碱石灰增重44g。该有机物的化学式为( )A、CH4 B、C2H6 C、C3H8 D、C4H1020. 下列实验操作能达到实验目的的是( )选项
实验操作
实验目的
A
取尿液,加入溶液,微热,观察现象
检验糖尿病人尿液中的葡萄糖
B
加入溶液洗涤、分液
除去乙酸乙酯中的少量乙酸
C
向2支盛有不同浓度的溶液中,一支加入少量 , 一支加入几滴溶液
探究催化剂对反应速率的影响
D
取一小块鸡皮置于蒸发皿中,滴3~5滴浓硝酸并在酒精灯上微热,变黄
证明鸡皮中含有蛋白质
A、A B、B C、C D、D二、综合题
-
21. 乙烯和苯是来自石油和煤的两种重要化工原料。回答下列问题:(1)、下列物质中,不能通过乙烯发生加成反应得到的是____(填字母)。A、 B、 C、(2)、工业上可由乙烯在一定条件下水合法生产乙醇,写出该反应的化学方程式。(3)、下列关于苯的叙述中不正确的是____(填字母)。A、常温下苯是一种无色无味的有毒气体 B、苯可以燃烧并伴有浓烈的黑烟 C、苯分子为平面正六边形结构 D、苯中含有碳碳双键,化学性质与乙烯相似(4)、某同学用如图所示装置制取硝基苯:

①用水浴加热的优点是 , 分离硝基苯和水的混合物的方法是。
②写出制取硝基苯的化学方程式。
22. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入的溶液中,乙同学将电极放入的溶液中,如图所示: (1)、甲中移向极(填“”或“”,下同)。(2)、乙中负极为 , 写出总反应的离子方程式。(3)、若甲、乙两池中负极质量的减少量相等,则两池产生氢气的物质的量之比为。(4)、通过该实验得出的下列结论正确的有____(填字母)。A、利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B、镁的金属性不一定比铝的金属性强 C、该实验说明金属活动性顺序表已过时,没有实用价值了 D、该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析(5)、若将甲中镁片换成碳棒,电解质溶液换为溶液,则负极反应式为 , 正极的现象为。23. 某校化学兴趣小组围绕乙醇的性质进行了相关探究,请你参与并完成对有关问题的解答。(1)、甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象。请在表中将实验现象及结论补充完全。
(1)、甲中移向极(填“”或“”,下同)。(2)、乙中负极为 , 写出总反应的离子方程式。(3)、若甲、乙两池中负极质量的减少量相等,则两池产生氢气的物质的量之比为。(4)、通过该实验得出的下列结论正确的有____(填字母)。A、利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B、镁的金属性不一定比铝的金属性强 C、该实验说明金属活动性顺序表已过时,没有实用价值了 D、该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析(5)、若将甲中镁片换成碳棒,电解质溶液换为溶液,则负极反应式为 , 正极的现象为。23. 某校化学兴趣小组围绕乙醇的性质进行了相关探究,请你参与并完成对有关问题的解答。(1)、甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象。请在表中将实验现象及结论补充完全。实验现象
实验结论
①
钠沉在烧杯底部
钠的密度乙醇(填“大于”或“小于”)
②
反应有气体产生
(2)、乙同学探究了乙醇的催化氧化反应,反应装置如图。实验操作流程为:点燃酒精灯,加热片刻后,再间歇性地挤压气囊鼓入空气。
①反应时中铜丝的颜色变化为。
②一段时间后中收集到一种新物质,写出生成该物质的化学方程式 , 该实验说明乙醇具有性(填“氧化”或“还原”)。
(3)、丙同学根据教材中制备乙酸乙酯的实验装置图进行了改进,如图,继续实验。
乙醇
乙酸
乙酸乙酯
98%浓硫酸
熔点/℃
16.6
——
沸点/℃
78.5
117.9
77.5
338.0
资料:温度高于140℃时发生副反应:
①水从冷凝管的 (填“”或“”)处进入。
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是 (填字母)。
A. B. C.
(4)、用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是g。24. 现有、、、、、、七种短周期元素,原子序数依次增大。已知与、与分别同主族,、、同周期;、的最外层电子数之和与的最外层电子数相等,与形成的化合物常温下为液态,分别与、形成的气体分子电子总数相等,有多种同素异形体,其中一种是目前已知自然界中最硬的物质,可做首饰品或做切削工具。请回答下列问题:(1)、在周期表中的位置是。(2)、灼烧的化合物,焰色为色,和形成的一种化合物与发生氧化还原反应,该反应的离子方程式为。(3)、和的简单气态氢化物中稳定性较强的是(填化学式),、、的简单离子半径由大到小的顺序为(用离子符号表示)。(4)、下列能说明和G非金属性强弱的事实是(填序号)。①的单质能与的简单气态氢化物反应得到
②酸性:
③的单质与反应得到 , 的单质与反应得到
④常温下,的单质为固体,的单质为气体