江苏省南通市如东县2022年中考模拟化学试题
试卷更新日期:2022-04-22 类型:中考模拟
一、单选题
-
1. 下列做法不符合绿色可持续发展理念的是( )A、分类处理垃圾,以节约回收资源 B、践行低碳生活,以减缓“温室效应” C、大量使用农药化肥,以提高农作物产量 D、用可降解材料替代传统塑料,以降低“白色污染”2. 分类是化学学习、研究的重要方法。下列有关分类正确的是( )A、塑料、合成纤维、合金是合成材料 B、氯化钠、硝酸钾、纯碱是盐 C、磁铁矿、二氧化锰、二氧化碳是氧化物 D、钙、铁、锌、硒是人体中的微量元素3. 下列做法中正确的是( )A、锌、碘元素都属于人体必需微量元素 B、空气中氮气的质量分数为78% C、氧气易溶于水,供给水生生物呼吸 D、锈蚀后铁制品没有回收价值4. 规范实验操作是实验成功的基础和关键,下列实验基本操作正确的是( )A、检验装置气密性
 B、倾倒液体
B、倾倒液体  C、铁丝在氧气中燃烧
C、铁丝在氧气中燃烧  D、镁条和稀盐酸反应
D、镁条和稀盐酸反应  5. 小刘对某溶液所含溶质的记录,合理的是( )A、NaNO3、AlCl3、HCl、ZnSO4 B、NH4Cl、K2SO4、KOH、Na2CO3 C、K2CO3、NaCl、KNO3、H2SO4 D、BaCl2、HCl、CaCl2、K2CO36. 甲、乙、丙有如图所示的转化关系( “→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
5. 小刘对某溶液所含溶质的记录,合理的是( )A、NaNO3、AlCl3、HCl、ZnSO4 B、NH4Cl、K2SO4、KOH、Na2CO3 C、K2CO3、NaCl、KNO3、H2SO4 D、BaCl2、HCl、CaCl2、K2CO36. 甲、乙、丙有如图所示的转化关系( “→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( ) A、C、CO、 CO2 B、C、CO2、H2CO3 C、H2O2、H2O、O2 D、H2O2、H2、H2O7. 甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
A、C、CO、 CO2 B、C、CO2、H2CO3 C、H2O2、H2O、O2 D、H2O2、H2、H2O7. 甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( ) A、甲的溶解度随温度的升高而增大 B、40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法 C、20℃时,向50g溶剂中加入20g的乙固体并充分溶解,溶液的溶质质量分数约为28.6% D、将甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大8. Ⅰ是80℃含有120g水的NH4Cl溶液,经过如下操作,得到10g NH4Cl固体。
A、甲的溶解度随温度的升高而增大 B、40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法 C、20℃时,向50g溶剂中加入20g的乙固体并充分溶解,溶液的溶质质量分数约为28.6% D、将甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大8. Ⅰ是80℃含有120g水的NH4Cl溶液,经过如下操作,得到10g NH4Cl固体。

下列说法正确的是( )
A、溶液Ⅰ中溶质的质量可能大于65.6g B、溶液Ⅱ中溶质与溶剂的质量比为65.6:100 C、溶液Ⅲ中溶质的质量分数约为37.2% D、溶液Ⅱ→Ⅲ的过程中,开始析出固体的温度必定在40℃~60℃之间9. 下列操作能达到实验目的的是( )选项
实验目的
实验方法
A
除去N2中的少量O2
将气体通过灼热的铜网
B
配制10%的NaCl溶液
向盛有10g NaCl固体的烧杯中,加入100 mL蒸馏水,搅拌
C
除去铁粉中混有的铜粉
加入过量稀硫酸,过滤
D
鉴别浓硫酸和蒸馏水
打开瓶塞,观察是否产生白雾
A、A B、B C、C D、D10. 已知:在650℃时,CuSO4分解为CuO与气体。在1400℃时,CuO受热发生如下反应:4CuO2Cu2O+O2↑,现将16gCuSO4高温加热一段时间。冷却后称量剩余固体为7.6g。下列说法不正确的是( )A、剩余固体为混合物 B、产生的气体中,硫、氧的质量比为4:13 C、剩余固体中含6.4g铜元素 D、剩余固体用足量CO还原,可产生CO23.3g二、填空题
-
11. 建立“宏观-微观-符号”之间的联系,是化学学科特有的重要思维方式。(1)、保持一氧化碳化学性质的最小粒子是。(2)、如图是氧、硫、硒三种元素的原子结构示意图。

①硫原子的结构示意图是(填字母序号)。
②氧、硫、硒三种元素化学性质相似的原因是。
③画出O2-的结构示意图是。
(3)、2020年5月,科学家在Science期刊上首次报道了原子与分子的“最简单”反应存在两种路径,并用先进技术手段拍下了该反应的影像资料,其中一种路径的简化示意图如图所示。
此“最简单”反应中,
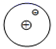 表示H原子,
表示H原子,  表示D原子。此反应中涉及的元素种类有种,该反应可表示为:H +→ H2 + 。(4)、以化合价为纵坐标、物质类别为横坐标所绘制的图像叫价类图,铁的价类图如图所示。
表示D原子。此反应中涉及的元素种类有种,该反应可表示为:H +→ H2 + 。(4)、以化合价为纵坐标、物质类别为横坐标所绘制的图像叫价类图,铁的价类图如图所示。
①X表示的物质类别是。
②铁和硫酸铜反应生成的含铁化合物属于图中的(填字母序号),该反应的化学方程式为。
③某同学想用物质a制取物质b,设计了如图实验步骤:

物质a与稀盐酸反应的化学反应方程式为 , 溶液乙中的溶质一定有。
12. 生产、生活中处处有化学。(1)、用洗洁精清洗油污,是利用了洗洁精的作用;(2)、当森林或草场发生火灾时,救火的措施之一是铲除火场周围一定宽度的树木和杂草,形成一道“防火墙”,其原理是;(3)、蒙阴奥德燃气公司给用户输送的是天然气,天然气属于再生能源(填“可”或“不可”),请写出天然气燃烧的化学方程式;(4)、打开汽水瓶盖,汽水会自动喷出,说明气体在水中的溶解度与有关;(5)、皮蛋是大家喜欢的食品,但皮蛋往往带点苦涩的味道,这是因为它在制作过程中加入了“碱水”(呈碱性的物质),因而吃皮蛋时,要加点(选填“米酒”“食盐”或“食醋”)以减少苦涩味。(6)、若要测定汶河河水的酸碱度,最适宜的是(填字母序号)A 紫色石蕊溶液
B 无色酚酞溶液

C pH试纸
三、综合题
-
13. 现代工业上生产硫酸的流程图如图所示,分析并回答问题。
 (1)、发烟硫酸进入稀释室可得到不同浓度的硫酸。稀释浓硫酸的操作是沿容器壁缓慢地把 , 并用玻璃棒不断搅拌。(2)、流程中SO2转化为SO3的化学方程式:。(3)、工厂制取硫酸主要用黄铁矿(主要成分:FeS2)作原料,在高温条件下与空气中的氧气反应,产生一种能形成酸雨的气体和一种红色的氧化物。该反应的化学方程式为。(4)、小明想要制取大量的氢气,稀硫酸消耗太快,因此小明想要使用浓硫酸制取氢气,以达到少补充药品的目的,在实验中发现反应剧烈,有刺激性气味产生,小明通过查阅资料知道浓硫酸与锌反应并不会产生氢气,会有刺激性气味气体和锌的盐溶液生成。写出浓硫酸与锌反应的化学方程式:。现有130g锌与浓硫酸恰好完全反应,且反应后溶液中硫元素的质量与气体中硫元素的质量比为2:1,则完全反应后生成的气体的总质量为g,参加反应的硫酸中溶质的质量为g。14. 在对三星堆考古挖掘中出土了许多青铜面具,这些面具表面都有一层绿色的铜锈[化学式为Cu2(OH)2CO3(碱式碳酸铜)],某学习小组对性质进行实验探究。(1)、I、分析碱式碳酸铜的组成
(1)、发烟硫酸进入稀释室可得到不同浓度的硫酸。稀释浓硫酸的操作是沿容器壁缓慢地把 , 并用玻璃棒不断搅拌。(2)、流程中SO2转化为SO3的化学方程式:。(3)、工厂制取硫酸主要用黄铁矿(主要成分:FeS2)作原料,在高温条件下与空气中的氧气反应,产生一种能形成酸雨的气体和一种红色的氧化物。该反应的化学方程式为。(4)、小明想要制取大量的氢气,稀硫酸消耗太快,因此小明想要使用浓硫酸制取氢气,以达到少补充药品的目的,在实验中发现反应剧烈,有刺激性气味产生,小明通过查阅资料知道浓硫酸与锌反应并不会产生氢气,会有刺激性气味气体和锌的盐溶液生成。写出浓硫酸与锌反应的化学方程式:。现有130g锌与浓硫酸恰好完全反应,且反应后溶液中硫元素的质量与气体中硫元素的质量比为2:1,则完全反应后生成的气体的总质量为g,参加反应的硫酸中溶质的质量为g。14. 在对三星堆考古挖掘中出土了许多青铜面具,这些面具表面都有一层绿色的铜锈[化学式为Cu2(OH)2CO3(碱式碳酸铜)],某学习小组对性质进行实验探究。(1)、I、分析碱式碳酸铜的组成根据化学式可知,碱式碳酸铜中的阴离子符号为。
(2)、Ⅱ、探究碱式碳酸铜与酸的作用(实验过程)取样品少量于试管中,加水,固体不溶解。继续加入足量稀盐酸,有气泡产生,得到蓝色溶液。
(实验结论)碱式碳酸铜能与稀盐酸发生反应,生成的盐为(填化学式)。
(3)、Ⅲ、探究碱式碳酸铜受热的变化小组设计了如图装置(夹持仪器已略去),并用于探究碱式碳酸铜的分解产物。
图示加入样品和试剂,加热一段时间后,试管中固体变黑,U形管中无水硫酸铜变蓝(无水硫酸铜为白色固体,遇水变蓝),澄清石灰水变浑浊。

①仪器a的名称为。
②已知黑色固体为CuO,写出碱式碳酸铜受热分解的化学方程式。
(4)、小明在对碱式碳酸铜粉末加热时发现,绿色固体先变成黑色,继续高温灼烧黑色固体变成红色,同时有气体产生,为弄清红色固体的成分,进行了如下探究:(查阅资料)Cu和Cu2O均为红色固体,且Cu2O + H2SO4=Cu + CuSO4 + H2O。
(提出猜想)红色固体是:I、Cu; Ⅱ、Cu2O; III、。
(5)、(进行实验)操作
现象
结论
①取灼烧后的红色固体2.72g于试管中,加入足量稀硫酸加热并充分振荡,静置
溶液由无色变蓝色,固体减少
2.72g红色固体一定有。
②过滤、洗涤、干燥
得红色固体
根据上述实验现象,小明认为猜想Ⅲ正确,但有同学认为小明的判断不严谨,因为猜想Ⅱ也有相同现象,所以如要确定2.72g红色固体成分,还需要补充的操作是 , 再通过计算得出论。
四、计算题
-
15. 某固体物质中可能含有 NaCl、BaCl2、NaOH 中的一种或几种。某校课外小组同学为了探究其成分,取该固体物质 30g 完全溶于水中,测得溶液的pH 为 7,然后将 70g 某稀硫酸加入该溶液中,充分反应,所加稀硫酸的量与产生沉淀的关系如图所示。请根据图示及相关知识回答问题。
 (1)、该固体物质中一定不含有的物质是(化学式)。(2)、通过计算确定原固体物质中各成分的质量。
(1)、该固体物质中一定不含有的物质是(化学式)。(2)、通过计算确定原固体物质中各成分的质量。