2022年中考化学二轮专题复习-生活中的酸和碱、中和反应、pH
试卷更新日期:2022-04-17 类型:二轮复习
一、单选题
-
1. 人被蚊虫叮咬之后,皮肤红肿疼痛,这是因为被注入了一种叫做蚁酸的物质。此时为减轻疼痛,可涂抹的物质是( )A、食盐水 B、肥皂水 C、橘子汁 D、米醋2. 紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )A、食醋 B、食盐 C、味精 D、香油3. 下列能发生中和反应的是( )A、氢氧化钠与二氧化碳 B、石灰水与稀盐酸 C、稀硫酸与氧化铜 D、二氧化碳与氧化钠4. 下表是日常生活中常见物质的pH,酸性最强的物质是( )
物质
柠檬汁
酱油
肥皂液
炉具清洁剂
pH
2~3
4~5
9~10
12~13
A、柠檬汁 B、酱油 C、肥皂液 D、炉具清洁剂5. 下列关于氢氧化钠的描述错误的是( )A、对皮肤有强烈的腐蚀作用 B、氢氧化钠应密封保存 C、能去油污,可作炉具清洁剂 D、其水溶液能使石蕊溶液变红6. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说正确的是( )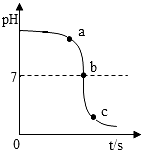 A、由a点到c点溶液温度下降 B、图中a点所示溶液中,含有的溶质是Na2SO4和NaOH C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、c点对应溶液中硫酸钠的质量大于b点7. 物质酸碱性对生命活动具有重要意义。一些食物的pH范围如下表所示,其中碱性最强的是( )
A、由a点到c点溶液温度下降 B、图中a点所示溶液中,含有的溶质是Na2SO4和NaOH C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、c点对应溶液中硫酸钠的质量大于b点7. 物质酸碱性对生命活动具有重要意义。一些食物的pH范围如下表所示,其中碱性最强的是( )食物
西红柿
鸡蛋清
胡萝卜
西瓜




pH
4.0~4.4
7.6~8.0
4.9~5.2
5.2~5.8
A、西红柿 B、鸡蛋清 C、胡萝卜 D、西瓜8. 将36.5克10%稀盐酸和4克10%氢氧化钠溶液混合,反应后滴加紫色石蕊颜色变成( )A、红色 B、蓝色 C、无色 D、紫色9. 通过对微观世界的探析,可以辨识宏观世界的变化。如图是盐酸和氢氧化钠溶液混合前后溶液中微粒的示意图。下列结论中,不正确的是( )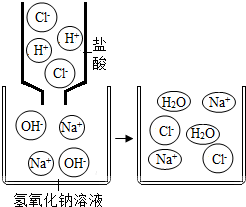 A、混合前后溶液的pH发生了明显变化 B、氢离子和氢氧根离子的数量没有变化 C、盐酸和氢氧化钠溶液发生了中和反应 D、过程中,钠离子和氯离子并没有消耗10. 除去热水瓶胆内的水垢(主要成分是碳酸钙),最好采用的方法是( )A、猛击后用大量水冲洗 B、加入石灰水浸泡 C、加入食醋浸泡 D、通入石蕊试液中11. 下列做法正确的是( )A、胃溃疡患者用小苏打治疗胃酸过多症 B、医疗上用食盐配制生理盐水 C、为了消除蚊虫叮咬后的痛痒,在患处涂肥皂水 D、用pH试纸检验雨水的pH为5.5,确定此雨水是酸雨12. 黑枸杞浸泡在不同pH值的溶液中,溶液呈现的颜色情况如图。下列与黑构杞浸泡会呈现蓝绿色的液体是( )
A、混合前后溶液的pH发生了明显变化 B、氢离子和氢氧根离子的数量没有变化 C、盐酸和氢氧化钠溶液发生了中和反应 D、过程中,钠离子和氯离子并没有消耗10. 除去热水瓶胆内的水垢(主要成分是碳酸钙),最好采用的方法是( )A、猛击后用大量水冲洗 B、加入石灰水浸泡 C、加入食醋浸泡 D、通入石蕊试液中11. 下列做法正确的是( )A、胃溃疡患者用小苏打治疗胃酸过多症 B、医疗上用食盐配制生理盐水 C、为了消除蚊虫叮咬后的痛痒,在患处涂肥皂水 D、用pH试纸检验雨水的pH为5.5,确定此雨水是酸雨12. 黑枸杞浸泡在不同pH值的溶液中,溶液呈现的颜色情况如图。下列与黑构杞浸泡会呈现蓝绿色的液体是( )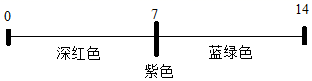 A、稀盐酸 B、纯碱溶液 C、食盐水 D、蒸馏水13. 下列有关pH的说法错误的是( )A、用水润湿试纸测量稀盐酸的pH,结果偏大 B、通常用蓝色石蕊试纸测定溶液的pH C、pH能定量描述溶液酸碱性的强弱 D、pH大小与一定量溶液中所含氢离子和氢氧根离子的数量多少有关14. 如图在点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。以下说法错误的是( )
A、稀盐酸 B、纯碱溶液 C、食盐水 D、蒸馏水13. 下列有关pH的说法错误的是( )A、用水润湿试纸测量稀盐酸的pH,结果偏大 B、通常用蓝色石蕊试纸测定溶液的pH C、pH能定量描述溶液酸碱性的强弱 D、pH大小与一定量溶液中所含氢离子和氢氧根离子的数量多少有关14. 如图在点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。以下说法错误的是( ) A、孔穴1、4溶液变为蓝色 B、孔穴3是空白对照实验 C、孔穴6溶液变为蓝色说明碳酸钠属于碱 D、孔穴2、5溶液变红的原因是溶液中都含有H+15. 2019年2月12日陕西省渭南市渭南市华州区少华山国家森林公园附近的一个硫酸厂发生爆炸,造成一定量的硫酸泄漏,为了防止污染的进一步扩散以及人员伤亡,下列措施适宜的是( )A、用土将硫酸掩埋 B、在泄漏的硫酸上撒氯化钡 C、用水冲洗泄露的硫酸 D、将熟石灰洒在泄漏出的硫酸上16. 将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是( )A、两者溶质质量分数都变大 B、两者溶质质量分数都不变 C、两者溶质质量分数都变小 D、浓盐酸溶质质量分数变小,浓硫酸溶质质量分数变大17. 某溶液中可能含有氢氧化钠、碳酸钠、氢氧化钡、氢氧化钙的一种或几种,某兴趣小组取少量溶液向其中滴加稀盐酸测得产生气体的质量与加入的稀盐酸的质量关系如图,分析图像,有关说法错误的是( )
A、孔穴1、4溶液变为蓝色 B、孔穴3是空白对照实验 C、孔穴6溶液变为蓝色说明碳酸钠属于碱 D、孔穴2、5溶液变红的原因是溶液中都含有H+15. 2019年2月12日陕西省渭南市渭南市华州区少华山国家森林公园附近的一个硫酸厂发生爆炸,造成一定量的硫酸泄漏,为了防止污染的进一步扩散以及人员伤亡,下列措施适宜的是( )A、用土将硫酸掩埋 B、在泄漏的硫酸上撒氯化钡 C、用水冲洗泄露的硫酸 D、将熟石灰洒在泄漏出的硫酸上16. 将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是( )A、两者溶质质量分数都变大 B、两者溶质质量分数都不变 C、两者溶质质量分数都变小 D、浓盐酸溶质质量分数变小,浓硫酸溶质质量分数变大17. 某溶液中可能含有氢氧化钠、碳酸钠、氢氧化钡、氢氧化钙的一种或几种,某兴趣小组取少量溶液向其中滴加稀盐酸测得产生气体的质量与加入的稀盐酸的质量关系如图,分析图像,有关说法错误的是( )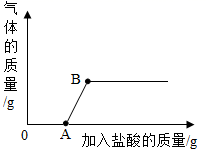 A、该实验证明,溶液中的成分是氢氧化钠和碳酸钠 B、图中A点对应的溶液中,阴离子只有 C、溶液在B点之前的pH大于7,B点以后溶液的pH小于7 D、图中B点对应的溶液中只有一种溶质18. 向氢氧化钡溶液中逐滴加入稀硫酸,某个量y随稀硫酸的加入的变化情况如图所示,则y表示( )
A、该实验证明,溶液中的成分是氢氧化钠和碳酸钠 B、图中A点对应的溶液中,阴离子只有 C、溶液在B点之前的pH大于7,B点以后溶液的pH小于7 D、图中B点对应的溶液中只有一种溶质18. 向氢氧化钡溶液中逐滴加入稀硫酸,某个量y随稀硫酸的加入的变化情况如图所示,则y表示( )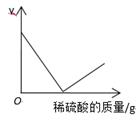 A、溶液的pH B、沉淀的质量 C、溶质的质量 D、氢氧化钡的质量19. 烧杯中盛有硫酸铜和稀硫酸的混合溶液共100.0g,向其中慢慢滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法不正确是( )
A、溶液的pH B、沉淀的质量 C、溶质的质量 D、氢氧化钡的质量19. 烧杯中盛有硫酸铜和稀硫酸的混合溶液共100.0g,向其中慢慢滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法不正确是( ) A、ab 段(不含a、b点)对应的溶液中含三种阳离子 B、c 点对应的溶液的质量为 250.2g C、原混合溶液中硫酸和硫酸铜的质量分别为 9.8g、8.0g D、向d点对应的溶液中滴加无色酚酞溶液,会变红色20. 向盛有一定量Ba(OH)2 溶液的烧杯中逐滴滴加稀硫酸至过量,下列图像与事实不相符的是( )A、
A、ab 段(不含a、b点)对应的溶液中含三种阳离子 B、c 点对应的溶液的质量为 250.2g C、原混合溶液中硫酸和硫酸铜的质量分别为 9.8g、8.0g D、向d点对应的溶液中滴加无色酚酞溶液,会变红色20. 向盛有一定量Ba(OH)2 溶液的烧杯中逐滴滴加稀硫酸至过量,下列图像与事实不相符的是( )A、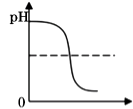 加入稀硫酸的质量
B、
加入稀硫酸的质量
B、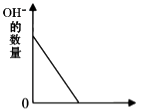 加入稀硫酸的质量
C、
加入稀硫酸的质量
C、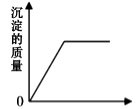 加入稀硫酸的质量
D、
加入稀硫酸的质量
D、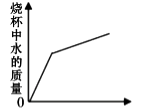 加入稀硫酸的质量
加入稀硫酸的质量
二、填空题
-
21. 下表为北京市某监测点监测到的空气质量。依据表格回答问题:
污染项目
PM2.5
PM10
SO2
CO
NO2
污染指数
69
95
9
0.8
42
①首要污染物是;其中会形成酸雨的是(填1种即可)
22. 向盛有蒸馏水的试管中滴加几滴石蕊试液,并通入二氧化碳气体,现象是 , 该现象说明所得溶液的pH值7(填“>”、“<”或“=”),用方程式解释产生该现象的原因。23. 制作“叶脉书签”需要用到10%的氢氧化钠溶液。若用氢氧化钠固体配制200g溶质质量分数为10%的氢氧化钠溶液,需称量氢氧化钠的质量为g;若用湿润的pH试纸测定该氢氧化钠溶液的pH,测量结果会(选填“偏小”、“偏大”或“不变”)。24. 探究NaOH溶液与稀盐酸反应。反应过程中温度和pH的变化。测定结果如图所示。
①该反应过程属于(填“放热”或“吸热”),化学方程式为。
②分析坐标,推测操作方案是。(填序号)
a.向一定量的氢氧化钠溶液中滴加稀盐酸
b.向一定量的稀盐酸中滴加氢氧化钠溶液
25. 现有甲、乙两种溶液,共含有8种离子,分别为,Ba2+、H+、Ag+、K+、OH﹣、Cl﹣、NO3﹣、CO32﹣ , 且两种溶液里所含的离子各不相同。已知向甲溶液里滴入紫色石蕊试液,溶液变成蓝色,说明甲溶液呈(填“酸性”、“碱性”或“中性”),那么乙溶液里含有的4种离子是(填离子符号)。26. 某石油产品中含有7.35g残余硫酸,需用15%的氢氧化钠溶液来洗涤,反应的化学方程式为;洗涤后溶液呈中性,共消耗g氢氧化钠溶液。27. 有Na2CO3.、BaCl2、HCl三种无色溶液能将它们一次性鉴别出来可选用的指示剂 , 可选用的酸是。取样,两两混合,鉴别出碳酸钠溶液的现象是。28. H2SO4是一种重要的化工原料。(1)、H2SO4溶液的pH7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法。(2)、浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是(填写序号)。①H2
②CO2
③NH3
④HCl
(3)、实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2 , 请写出该反应的化学方程式:。(4)、向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系如图所示,请写出b点对应溶液的溶质(填写化学式),原混合溶液中CuSO4的质量分数是。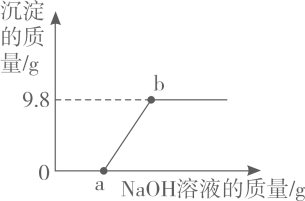 29. 《本草纲目》记载,杨桃具有去风热、生津止渴等功效。回答下列问题:(1)、杨桃的主要成分是水,还含有糖类和蛋白质等。糖类的主要功能是为人体。(2)、经测定杨桃A的pH=1.35,杨桃B的pH=1.81,其中酸性较强的是杨桃(填“A”或“B”)。(3)、杨桃中部分元素含量如下表:
29. 《本草纲目》记载,杨桃具有去风热、生津止渴等功效。回答下列问题:(1)、杨桃的主要成分是水,还含有糖类和蛋白质等。糖类的主要功能是为人体。(2)、经测定杨桃A的pH=1.35,杨桃B的pH=1.81,其中酸性较强的是杨桃(填“A”或“B”)。(3)、杨桃中部分元素含量如下表:每克杨桃中部分元素的质量
元素
K
Ca
Zn
Fe
质量/mg
0.389
0.587
0.049
0.070
给人体补充元素可预防佝偻病,补充元素可预防贫血病(填元素名称)。
30. 归纳总结是学习化学的重要方法,某同学用图1总结了NaOH的四条化学性质(即NaOH能够与四类物质发生化学反应)。
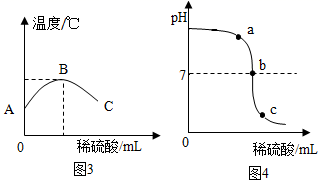 (1)、为了验证图1中反应①,将无色酚酞溶液滴入NaOH溶液中,溶液变成色。(2)、依据图1中反应②写出 NaOH在空气中变质的化学方程式: , 说明NaOH必须密封保存。(3)、图2从微观的角度说明了反应③酸碱中和反应发生的实质是。(4)、图2实验过程中溶液的温度、溶液 pH 变化曲线如图3、图4所示,回答下列问题:
(1)、为了验证图1中反应①,将无色酚酞溶液滴入NaOH溶液中,溶液变成色。(2)、依据图1中反应②写出 NaOH在空气中变质的化学方程式: , 说明NaOH必须密封保存。(3)、图2从微观的角度说明了反应③酸碱中和反应发生的实质是。(4)、图2实验过程中溶液的温度、溶液 pH 变化曲线如图3、图4所示,回答下列问题:①当图2中两种溶液恰好完全反应时,对应的是图3中的点(填“A”“B”或“C”),图4中的点(填“a”“b”或“c”)。
②图4中的c点溶液呈性,此时溶液中含有的阳离子是填离子符号)。
三、推断题
-
31. A~J是初中化学常见的物质,相互之间能发生下列反应:①A+B→C+D ②D+E→B ③C+F→G+H ④B+F→G+I ⑤H+JA其中A是一种黑色固体,C溶液是蓝色,F、H、I、J为单质,通常状况下I、J为气体,反应②是形成硫酸型酸雨的某一步反应,E的分子中两种原子的个数比为1:3,反应③是湿法冶金的先驱。请回答下列问题:(1)、E的化学式为;反应④除生成气体处,还有的现象是;F在使用时易与空气中等物质作用生成一种疏松多孔的物质,造成资源损失。(2)、写出反应的化学方程式;反应③;反应⑤。①~⑤五个反应中,属于置换反应的是(填序号)。(3)、将过量F加入C溶液中充分反应,反应后与反应前相比,溶液质量(填“增大”“减小”或“不变”),过滤后所得固体的成分为。(4)、I在J中燃烧的化学方程式为 , I作为能源,其优势为(答一点)。32. A-H是初中化学常见的物质,C是黑色固体,H是金属单质,煅烧石灰石得到E;这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略,请回答下列问题:
 (1)、E的俗称。(2)、物质A属于(填“酸”“碱”“盐”或“氧化物”)。(3)、写出由D与G反应的化学方程式;(4)、上述转化中没有涉及的基本反应类型是。
(1)、E的俗称。(2)、物质A属于(填“酸”“碱”“盐”或“氧化物”)。(3)、写出由D与G反应的化学方程式;(4)、上述转化中没有涉及的基本反应类型是。四、实验探究题
-
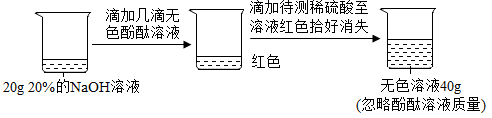
33.(1)、某兴趣小组的同学们以“稀盐酸与氢氧化钡溶液能否反应”为课题进行了科学探究。他们做了如图所示的实验:同学们在烧杯中加入10mL氢氧化钡溶液,然后滴加无色酚酞试液,继续向烧杯中滴加稀盐酸,边滴边搅拌,观察到 , 从而得出稀盐酸与氢氧化钡能发生反应的结论。
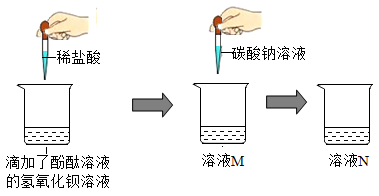
他们继续向溶液M中滴加碳酸钠溶液,发现只有白色沉淀产生,无其它实验现象。由此可知,溶液M中除了含有酚酞外,还含有的溶质是(填化学式)。
(2)、【提出问题】反应最终所得溶液N的溶质成分是什么(不考虑酚酞)?【猜想与假设】甲同学猜想:NaCl、BaCl2
乙同学猜想:NaCl
丙同学猜想:NaCl、Na2CO3
【分析与交流】上述猜想中不合理是同学的猜想。甲同学猜想溶液N中含有NaCl的依据是(用化学方程式表示)。
(3)、【活动与探究】同学们取少量溶液N,向其中滴加 , 观察到 , 即可确定乙同学的猜想正确。(4)、【总结与提升】通过上述探究可知:一般我们都是从生成物和反应物两个角度对反应后溶质成分做出猜想,并结合排除不合理猜想。然后再设计实验验证猜想。34. 某化学兴趣小组在学习“酸碱中和反应”时,将学生分成若干小组,在老师引导下开展探究活动。以下是探究学习片段,请你参与学习并帮助填写空格(包括表中空格)。(查阅资料)Na2SO4溶液呈中性。
(1)、(演示实验)将一定量的稀硫酸加入盛有无色酚酞和NaOH混合溶液的小烧杯中。当看到(填现象),证明它们确实发生了化学反应。(2)、(学生板书)该反应的化学方程式:。(3)、(提出问题)该烧杯内溶液中的溶质是什么?(假设猜想)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4 , H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的猜想是。理由是。
(4)、(实验探究)①丙组同学取少量烧杯中的溶液加入试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
②为了验证其余猜想,各学习小组利用烧杯中溶液,并选用老师提供的pH试纸,铜片,BaCl2溶液、溶液,进行如下三个方案的探究。
实验方案
测溶液的pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作

实验现象
试纸变色,对比标准比色卡,pH<7
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(5)、(评价反思)老师对同学们能用多种方法进行探究,并且能够得出正确结论给予表扬,同时指出(实验探究)的(2)中存在两处明显不正确,请大家反思,同学们经过反思后发现了这两处不正确:①实验操作中的不正确是。
②实验方案中也有一个是错误的,错误的原因是。
(6)、(反思与拓展)①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑。
②根据所学化学知识验证烧杯内溶液中的溶质含有H2SO4 , 除以上正确方案外,下列哪些物质单独使用也能完成该实验?。
a.铜 b.氧化铜 c.紫色石蕊溶液 d.硝酸银溶液
③烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。
35. 中和反应是一类重要的化学反应。某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。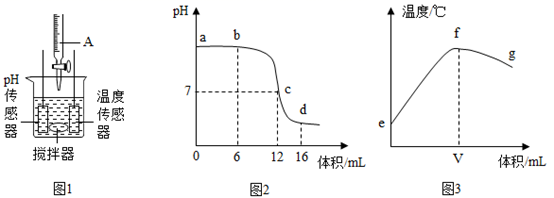
 (1)、烧杯中发生反应的化学方程式为。(2)、仪器A中溶液的溶质是(填化学式);(3)、图3中V的数值最接近(填“6”、“12”或“16”);(4)、下列说法错误的是______(填序号)。A、图2中b点所示溶液中的溶质是NaCl和NaOH B、取图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d所示溶液中NaCl的质量不断增加; D、图3中e→f变化趋势可说明该反应是放热反应(5)、由图4可知,该反应的微观实质是。(6)、若要证明反应已经进行到d点,除了观察pH和温度变化,还可以向反应后的溶液中加入下列物质中的______。(填序号)A、紫色石蕊试液 B、无色酚酞试液 C、镁条 D、碳酸钠 E、硝酸银溶液36. 蚊子、蚂蚁等叮咬人体后,会向人体注射蚁酸,使皮肤红肿、瘙痒。某兴趣小组同学对蚁酸产生了兴趣,决定对蚁酸进行探究。
(1)、烧杯中发生反应的化学方程式为。(2)、仪器A中溶液的溶质是(填化学式);(3)、图3中V的数值最接近(填“6”、“12”或“16”);(4)、下列说法错误的是______(填序号)。A、图2中b点所示溶液中的溶质是NaCl和NaOH B、取图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d所示溶液中NaCl的质量不断增加; D、图3中e→f变化趋势可说明该反应是放热反应(5)、由图4可知,该反应的微观实质是。(6)、若要证明反应已经进行到d点,除了观察pH和温度变化,还可以向反应后的溶液中加入下列物质中的______。(填序号)A、紫色石蕊试液 B、无色酚酞试液 C、镁条 D、碳酸钠 E、硝酸银溶液36. 蚊子、蚂蚁等叮咬人体后,会向人体注射蚁酸,使皮肤红肿、瘙痒。某兴趣小组同学对蚁酸产生了兴趣,决定对蚁酸进行探究。(提出问题)蚁酸的成分是什么?它有什么性质?
(查阅资料)①甲酸的俗名叫蚁酸,是一种有机酸,化学式为HCOOH。在隔绝空气加热时会分解生成水和一种气体氧化物。
②一氧化碳能与氧化铜(或氧化铁)在高温下反应生成铜(或铁)
(实验探究一)探究蚁酸的酸性
(1)、Ⅰ、小组先自制了一种紫汁,分别滴加到下列不同的试剂中,现象如下表所示:请分析紫薯汁(填“能”或“不能”)作酸碱指示剂。试剂
稀盐酸
氢氧化钙溶液
蒸馏水
白醋
肥皂水
颜色
红色
绿色
紫色
红色
绿色
(2)、Ⅱ、进行实验。向盛有蚁酸溶液的试管中滴加紫薯汁,观察到溶液颜色变成色,说明蚁酸溶液显酸性。
(3)、将镁条放入盛有蚁酸溶液的试管中,有气泡产生,该气体是(填化学式)。(4)、(实验探究二)探究蚁酸分解生成的气体氧化物。(推断与猜想)根据蚁酸中的化学式,小组同学对气体氧化物提出两种猜想:猜想一该气体是二氧化碳;猜想二该气体是。
(5)、(进行实验)为了证明自己的猜想,他们将蚁酸分解产生的气体通过下图所示的装置(铁架台已略去),观察现象。
①实验时装置A中无明显变化,则猜想一(选填“成立”或“不成立”)。
②装置B的作用是。
③实验时装置C中的实验现象是黑色固体逐渐变成红色,装置D中的现象是 , 上述实验现象,得出猜想二成立的结论。
(6)、(拓展延伸)当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你肯定不会选择的物质是______。A、牙膏 B、食醋 C、肥皂水 D、烧碱37. 氢氧化钠是初中学习的一种重要物质,下面是有关氢氧化钠的实验。(1)、(实验项目1)利用图甲装置探究稀盐酸与氢氧化钠溶液反应的过程,仪器A是一种带有刻度的滴管,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到图乙和图丙。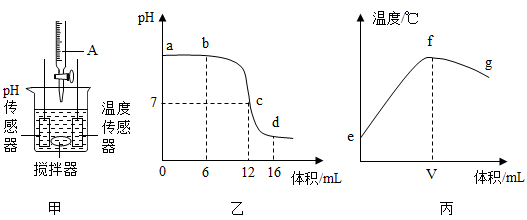
盐酸与氢氧化钠发生中和反应的化学方程式为。
(2)、仪器A中溶液的溶质是(填化学式)。(3)、图乙中,说法错误的是______(填字母)A、b点所示溶液中滴入酚酞试液会变红色 B、c点所示溶液加热蒸干所得固体为纯净物 C、c点所示溶液中的溶质种类比d点多 D、一段时间后,溶液pH会变为0(4)、图丙中,V的数值最接近(填“6”“12”或“16”),中和反应是反应(填“放热”或“吸热”)。(5)、(实验项目Ⅱ)某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,变质程度如何?同学们进行了以下探究:请完成实验报告
实验步骤
实验现象
实验结论
①步骤一:取少量溶液于试管中加入充分反应
溶液中含有碳酸钠
②步骤二:将步骤一试管中的物质过滤,向滤液中加入酚酞
溶液变红
38. 实验课上,老师向滴有无色酚酞试液的NaOH红色溶液中滴加稀HCl,同学们观察到溶液颜色由红色变为无色,说明酸碱发生了中和反应。【提出问题】HCl和NaOH是否恰好完全反应了?
(1)、【查阅资料】I.常温下,酚酞在pH≤8.2的溶液中呈无色,在pH>8.2的溶液中呈红色。Ⅱ.相同温度下,NaOH稀溶液中溶质的质量分数越大,溶液pH越大。
【猜想假设】① , 溶液pH>7;
②恰好完全反应,溶液pH=7;
③HCl过量,溶液pH<7。
(2)、【理论论证】分别取少量反应后的无色溶液于3支试管中,按下列方案实验:实验操作
实验现象
实验结论
方案1
滴加几滴碳酸氢钠溶液
无气泡产生
假设不正确(填序号)
方案2
加热蒸发
蒸发过程中,发现溶液由无色变为红色
假设①正确方案3的化学反应方程式
方案3
滴加几滴硫酸铜溶液
有蓝色沉淀生成
(3)、【结论分析】反应后的无色溶液中还有少量NaOH,此时pH的范围;加热蒸发一段时间后,恢复至常温,当溶液的pH>8.2时,变为红色。(4)、【反思总结】向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后,溶液的颜色变为红色。(填“一定”或“不一定”)(5)、【拓展应用】在探究酸碱性质的实验中,可借助pH传感器监测溶液pH的变化情况。常温下,向盐酸中加水稀释,溶液pH变化与下图吻合的是。(填序号)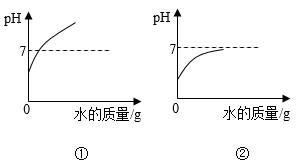
五、计算题