福建省八地市(福州、厦门、泉州、莆田、南平、宁德、三明、龙岩)2022届高三毕业班4月诊断性联考化学试题
试卷更新日期:2022-04-15 类型:高考模拟
一、单选题
-
1. 在冬奥会上,中国使用了多项高科技。下列说法正确的是( )A、滑道使用二氧化碳超临界制冰的相变过程是物理变化 B、火炬“飞扬”使用的碳纤维和高性能树脂属于无机非金属材料 C、颁奖礼仪服饰“瑞雪样云”使用的保温材料石墨烯属于有机高分子材料 D、冬奥会场馆使用的氢燃料车是利用电解池原理提供电能2. 卤族元素在生产生活中有重要应用。下列有关化学用语表述正确的是( )A、的球棍模型:
 B、的电子式:
B、的电子式: C、溴原子结构示意图:
C、溴原子结构示意图: D、中子数为74的碘原子:
3. NA是阿伏加德罗常数的值。消毒剂需科学使用,84消毒液不能和医用酒精混用的原因是4NaClO+CH3CH2OH=CHCl3+HCOONa+2NaOH+NaCl+H2O。下列说法正确的是( )A、1L 0.2 NaClO溶液中含有ClO-离子数为0.2NA B、23g CH3CH2OH中含有σ键数为3.5NA C、标准状况下,2.24L CHCl3中含有原子数为0.5NA D、每生成1mol HCOONa,该反应转称电子数为8NA4. 从废感光胶片中回收银的流程如下,相关离子方程式不正确的是( )A、FeCl3溶液呈酸性: B、反应①: C、反应②: D、反应③:5. 糠醛可选择性转化为糠醇或2-甲基喃(如图)。下列说法不正确的是( )
D、中子数为74的碘原子:
3. NA是阿伏加德罗常数的值。消毒剂需科学使用,84消毒液不能和医用酒精混用的原因是4NaClO+CH3CH2OH=CHCl3+HCOONa+2NaOH+NaCl+H2O。下列说法正确的是( )A、1L 0.2 NaClO溶液中含有ClO-离子数为0.2NA B、23g CH3CH2OH中含有σ键数为3.5NA C、标准状况下,2.24L CHCl3中含有原子数为0.5NA D、每生成1mol HCOONa,该反应转称电子数为8NA4. 从废感光胶片中回收银的流程如下,相关离子方程式不正确的是( )A、FeCl3溶液呈酸性: B、反应①: C、反应②: D、反应③:5. 糠醛可选择性转化为糠醇或2-甲基喃(如图)。下列说法不正确的是( ) A、糠醛中所有的碳原子可能共平面 B、糠醛与
A、糠醛中所有的碳原子可能共平面 B、糠醛与 互为同系物
C、糠醛在钢催化条件下生成糠醇为加成反应
D、2-甲基味喃的一氯代物有4种
6. 一种高储能电池的电解液微观结构如图,R、W、X、Y、Z、M为原子序数依次增大的短周期元素,M的原子半径大于Z。下列说法正确的是( )
互为同系物
C、糠醛在钢催化条件下生成糠醇为加成反应
D、2-甲基味喃的一氯代物有4种
6. 一种高储能电池的电解液微观结构如图,R、W、X、Y、Z、M为原子序数依次增大的短周期元素,M的原子半径大于Z。下列说法正确的是( ) A、电负性:R<W B、简单氢化物的熔点:W<M C、呈四面体 D、最高价氧化物对应水化物的酸性:Y<X7. 下列实验方案与实验目的不匹配的是( )
A、电负性:R<W B、简单氢化物的熔点:W<M C、呈四面体 D、最高价氧化物对应水化物的酸性:Y<X7. 下列实验方案与实验目的不匹配的是( )选项
实验目的
实验方案
A
探究既有氧化性又有还原性
将分别通入溴水和溶液
B
证明甲苯中甲基能活化苯环
将酸性溶液分别加入苯和甲苯中并振荡
C
比较水解程度和电离程度大小
常温下,用pH试纸测一定浓度溶液的pH
D
除去乙酸乙酯中的乙酸和乙醇
用饱和溶液洗涤后分液
A、A B、B C、C D、D8. 二氧化锰矿粉中含量测定实验流程如图。下列说法不正确的是( ) A、将还原为 B、滴定终点溶液的颜色从无色变为浅紫色 C、含量为 D、若滴定终点时滴定管尖嘴处出现气泡,则测得含量偏小9. 已知反-2-丁烯转化为顺-2-丁烯反应如下, , 和随温度变化的曲线如图。下列有关该反应的说法正确的是( )
A、将还原为 B、滴定终点溶液的颜色从无色变为浅紫色 C、含量为 D、若滴定终点时滴定管尖嘴处出现气泡,则测得含量偏小9. 已知反-2-丁烯转化为顺-2-丁烯反应如下, , 和随温度变化的曲线如图。下列有关该反应的说法正确的是( )
 A、反-2-丁烯与顺-2-丁烯互为位置异构体 B、温度变化对的影响程度小于对的影响程度 C、正反应的活化能大于逆反应的活化能 D、顺-2-丁烯比反-2-丁烯稳定10. 用Ph表示苯基,三苯基胺()失去一个电子后形成的结构较为稳定。一种铝胺电池工作原理示意如图。下列说法不正确的是( )
A、反-2-丁烯与顺-2-丁烯互为位置异构体 B、温度变化对的影响程度小于对的影响程度 C、正反应的活化能大于逆反应的活化能 D、顺-2-丁烯比反-2-丁烯稳定10. 用Ph表示苯基,三苯基胺()失去一个电子后形成的结构较为稳定。一种铝胺电池工作原理示意如图。下列说法不正确的是( ) A、和中Al原子的杂化方式相同 B、放电时,负极的电极反应式为 C、充电时,向铝电极移动 D、理论上每生成1mol , 外电路通过1mol电子
A、和中Al原子的杂化方式相同 B、放电时,负极的电极反应式为 C、充电时,向铝电极移动 D、理论上每生成1mol , 外电路通过1mol电子二、非选择题
-
11. 含铬电镀废水的主要成分如下表,常用“沉淀法”和“药剂还原沉淀法”进行处理。
离子
Cr(Ⅵ)
含量/
28.38
12.92
0.34
0.069
0.014
(1)、Ⅰ.“沉淀法”工艺流程如下图。
金属离子沉淀完全时()及沉淀开始溶解时的pH如下。
金属离子
pH
沉淀完全
6.7
8.3
2.8
8.2
5.6
沉淀开始溶解
-
13.5
14.0
10.5
12.0
“氧化”过程中转化为的离子方程式为。
(2)、“沉降”过程中应调节pH范围是~10.5。(3)、已知25℃时、;。“沉铬”过程中:①生成铬黄的离子方程式为。
②从平衡角度分析pH对沉铬率的影响。
(4)、Ⅱ.“药剂还原沉淀法”工艺流程如下图。
“还原”过程中,被Cr(Ⅵ)氧化为。
(5)、比较“沉淀法”和“药剂还原沉淀法”工艺的优劣(写出一条即可)。12. 可用“沉淀法”除去粗盐中的、、杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
沉淀剂1
沉淀剂1
沉淀剂1
过滤方式
检测结果
实验1
溶液
NaOH溶液
溶液
逐一过滤
少量浑浊
实验2
溶液
溶液
NaOH溶液
逐一过滤
少量浑浊
实验3
NaOH溶液
溶液
溶液
逐一过滤
大量沉淀
实验4
溶液
NaOH溶液
溶液
一起过滤
大量沉淀
(1)、实验1中加入沉淀剂3后会生成(填化学式)。(2)、“除杂4”发生反应的离子方程式有。(3)、“操作X”为。(4)、查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。①提出假设:
依据
假设
假设1
实验1和2中检测时出现少量浑浊
(填化学式)能增大溶解度
假设2
实验3中检出量明显高于1和2
NaOH能明显增大溶解度
假设3
(将内容补充完整)
NaOH或能明显增大溶解度
②设计实验:探究不同试剂对硫酸钡溶解度的影响程度
探究1
探究2
探究3
探究4
实验流程

试剂
饱和食盐水
2 NaOH溶液
0.5 溶液
蒸馏水
现象
少量浑浊
大量沉淀
大量沉淀
无明显现象
“滤液处理”需用到的试剂有。
③实验分析:实验3中溶液的用量为理论值的1.5倍,最后仍检出的原因是该体系中“同离子效应”“盐效应”(填“大于”或“小于”)。
④实验结论:粗盐提纯时,为了有效降低产品中含量,必须。
13. 基于载氮体的碳基化学链合成氨技术示意图如下。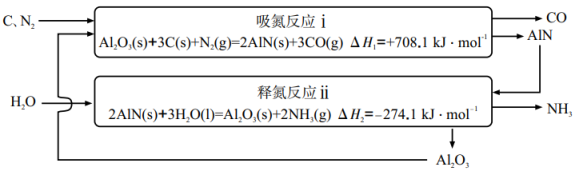 (1)、总反应 。(2)、有利于提高反应ⅰ平衡转化率的条件为____(填标号)。A、高温高压 B、高温低压 C、低温高压 D、低温低压(3)、在温度t、100kPa条件下进行反应ⅰ,平衡时若氮气转化率为50%,则压强为 , 平衡常数(以分压表示,分压=总压×物质的量分数)。(4)、60℃、100kPa条件下,反应ⅰ中溶液pH随时间变化如图,120min~180min持续收集到氨气,但溶液pH几乎不变的原因是。
(1)、总反应 。(2)、有利于提高反应ⅰ平衡转化率的条件为____(填标号)。A、高温高压 B、高温低压 C、低温高压 D、低温低压(3)、在温度t、100kPa条件下进行反应ⅰ,平衡时若氮气转化率为50%,则压强为 , 平衡常数(以分压表示,分压=总压×物质的量分数)。(4)、60℃、100kPa条件下,反应ⅰ中溶液pH随时间变化如图,120min~180min持续收集到氨气,但溶液pH几乎不变的原因是。 (5)、为探究反应ⅱ中15min时反应速率突然加快的原因,我国科学家利用计算机模拟了反应ⅱ的反应路径。
(5)、为探究反应ⅱ中15min时反应速率突然加快的原因,我国科学家利用计算机模拟了反应ⅱ的反应路径。
①比较不同路径,路径1能垒较低的原因是的键能大于的键能。
②15min时反应速率突然加快的原因是。
(6)、相较于哈伯法合成氨,碳基化学链合成氨的优势有能够降低能耗、减少原料成本。(写出一条即可)。14. 耐HF腐蚀的催化剂 , 可应用于氟化工行业中的氯循环(如图)。 (1)、Ru的价电子排布式为 , 该元素位于第周期族。(2)、上述转化过程中涉及的有机反应类型有。(3)、可通过液化分离出HCl中大多数的HF,从结构角度解释两者沸点差异的原因。(4)、、、的晶体结构如图(和中实线部分为晶胞)
(1)、Ru的价电子排布式为 , 该元素位于第周期族。(2)、上述转化过程中涉及的有机反应类型有。(3)、可通过液化分离出HCl中大多数的HF,从结构角度解释两者沸点差异的原因。(4)、、、的晶体结构如图(和中实线部分为晶胞)
①晶胞中有个Ru,O在晶胞的位置为。
②已知与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。载体中掺杂的原因是。
15. 戊炔草胺常用于控制阔叶杂草的生长。其合成路线如下。
回答下列问题:
(1)、A中官能团的名称为。(2)、B的结构简式为。(3)、D的名称为。(4)、C+H→戊炔草胺的化学方程式为。(5)、D的一种同分异构体苯环上有两个取代基,核磁共振氢谱有3组峰,峰面积之比为3:2:2,其结构简式为。(6)、已知:苯环电子云密度越大,越容易与 , 发生取代反应;-COOH为吸电子间位定位基,-NH2为给电子邻对位定位基。不直接使用苯甲酸而使用D合成G的原因是。