北京市西城区2022届高三一模化学试题
试卷更新日期:2022-04-15 类型:高考模拟
一、单选题
-
1. 化合物M是一种治疗脑卒中药物中间体,其结构简式如下图。下列关于该有机物的说法不正确的是( )
 A、存在顺反异构 B、分子中有3种含氧官能团 C、能与发生取代反应和加成反应 D、1mol该有机物最多消耗2mol2. 中国科学家经过光谱分析发现了一颗锂元素含量极高的恒星。下列说法不正确的是( )A、LiOH的碱性弱于Be(OH)2 B、在碱金属元素中,锂元素的第一电离能最大 C、依据对角线规则,锂元素和镁元素的有些性质相似 D、原子光谱的产生与电子跃迁有关,可利用原子光谱中的特征谱线来鉴定锂元素3. 下列说法正确的是( )A、和分子中均含有s-p键 B、和的VSEPR模型和空间结构均一致 C、熔点:金刚石>碳化硅>晶体硅 D、酸性:4. 新冠病毒是一种具有包膜的RNA病毒,包膜的主要成分是蛋白质和脂质。核酸检测就是检测新冠病毒的RNA。下列说法不正确的是( )A、核酸和蛋白质都是生物大分子 B、核酸和蛋白质都不能发生水解反应 C、核酸中核苷酸之间通过磷酯键连接 D、一定浓度的含氯消毒液可使新冠病毒中的蛋白质变性5. 氮掺杂的碳材料可以有效催化燃料电池中的还原反应,其催化机理如图。
A、存在顺反异构 B、分子中有3种含氧官能团 C、能与发生取代反应和加成反应 D、1mol该有机物最多消耗2mol2. 中国科学家经过光谱分析发现了一颗锂元素含量极高的恒星。下列说法不正确的是( )A、LiOH的碱性弱于Be(OH)2 B、在碱金属元素中,锂元素的第一电离能最大 C、依据对角线规则,锂元素和镁元素的有些性质相似 D、原子光谱的产生与电子跃迁有关,可利用原子光谱中的特征谱线来鉴定锂元素3. 下列说法正确的是( )A、和分子中均含有s-p键 B、和的VSEPR模型和空间结构均一致 C、熔点:金刚石>碳化硅>晶体硅 D、酸性:4. 新冠病毒是一种具有包膜的RNA病毒,包膜的主要成分是蛋白质和脂质。核酸检测就是检测新冠病毒的RNA。下列说法不正确的是( )A、核酸和蛋白质都是生物大分子 B、核酸和蛋白质都不能发生水解反应 C、核酸中核苷酸之间通过磷酯键连接 D、一定浓度的含氯消毒液可使新冠病毒中的蛋白质变性5. 氮掺杂的碳材料可以有效催化燃料电池中的还原反应,其催化机理如图。
途径一:A→B→C→F
途径二:A→B→C→D→E
下列说法不正确的是( )
A、途径一中存在极性共价键的断裂与形成 B、途径一的电极反应是 C、途径二,1mol 得到4mol D、氮掺杂的碳材料降低了反应的焓变6. 室温下,将充满NO2的试管倒立在水中,实验现象如图。下列分析不正确的是( ) A、NO2易溶于水,不能用排水法收集 B、试管中剩余的无色气体是未溶解的NO2 C、取试管中的溶液,滴加紫色石蕊溶液,溶液显红色,是因为NO2与H2O反应生成了酸 D、向试管中再缓缓通入一定量的O2 , 试管中的液面上升7. 下列方程式不能准确解释相应实验现象的是( )A、和浓盐酸共热产生黄绿色气体: B、Na加入滴有酚酞的水中,溶液变红: C、加热Fe和S的混合物生成黑色固体: D、加热蓝色的溶液,溶液变绿: [Cu(H2O)4]2+(aq,蓝色) +4Cl-(aq)[CuCl4]2-(aq,黄色)+4H2O(l)8. 用下图装置(夹持、加热装置已略)进行实验,②中现象不能证实①中发生了反应的是( )
A、NO2易溶于水,不能用排水法收集 B、试管中剩余的无色气体是未溶解的NO2 C、取试管中的溶液,滴加紫色石蕊溶液,溶液显红色,是因为NO2与H2O反应生成了酸 D、向试管中再缓缓通入一定量的O2 , 试管中的液面上升7. 下列方程式不能准确解释相应实验现象的是( )A、和浓盐酸共热产生黄绿色气体: B、Na加入滴有酚酞的水中,溶液变红: C、加热Fe和S的混合物生成黑色固体: D、加热蓝色的溶液,溶液变绿: [Cu(H2O)4]2+(aq,蓝色) +4Cl-(aq)[CuCl4]2-(aq,黄色)+4H2O(l)8. 用下图装置(夹持、加热装置已略)进行实验,②中现象不能证实①中发生了反应的是( )
①中实验
②中现象
A
加热1-溴丁烷与NaOH的乙醇溶液的混合物
酸性溶液褪色
B
加热溶液和浓NaOH溶液的混合物
溶液先变浑浊后澄清
C
加热乙酸、乙醇和浓硫酸的混合物
饱和溶液的上层有无色油状液体产生
D
将铁粉、碳粉和NaCl溶液的混合物放置一段时间
导管中倒吸一段水柱
A、A B、B C、C D、D9. 向盛有溶液的烧杯中,加入少量氨水,再加入过量Mg粉,有大量气泡产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的pH随时间的变化如图。
下列说法不正确的是( )
A、随着反应的进行,降低 B、产生的气体是混合物 C、pH=9时,溶液中 D、溶液的pH升高可能是Mg与、反应的结果10. ORP传感器(如下图)测定物质的氧化性的原理:将Pt电极插入待测溶液中,Pt电极、Ag/AgCl电极与待测溶液组成原电池,测得的电压越高,溶液的氧化性越强。向NaIO3溶液、FeCl3溶液中分别滴加2滴H2SO4溶液,测得前者的电压增大,后者的几乎不变。
下列说法不正确的是( )
A、盐桥中的Cl-移向Ag/AgCl电极 B、Ag/AgCl电极反应是Ag-e-+Cl-=AgCl C、酸性越强,的氧化性越强 D、向FeCl3溶液中滴加浓NaOH溶液至碱性,测得电压几乎不变11. 聚乳酸(PLA)是最具潜力的可降解高分子材料之一,对其进行基团修饰可进行材料的改性,从而拓展PLA的应用范围。PLA和某改性的PLA的合成路线如图。
注:Bn是苯甲基(
 )
)下列说法不正确的是( )
A、反应①是缩聚反应 B、反应②中,参与聚合的F和E的物质的量之比是m:n C、改性的PLA中,m:n越大,其在水中的溶解性越好 D、在合成中Bn的作用是保护羟基,防止羟基参与聚合反应12. 向100mL 溶液中滴加 溶液,测得溶液电导率的变化如图。下列说法不正确的是( ) A、和都是强电解质 B、A→B电导率下降的主要原因是发生了反应: C、B→C,溶液中的减小 D、A,B,C三点水的电离程度:A<B<C13. 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: , 相关数据见下表。
A、和都是强电解质 B、A→B电导率下降的主要原因是发生了反应: C、B→C,溶液中的减小 D、A,B,C三点水的电离程度:A<B<C13. 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: , 相关数据见下表。容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
Ⅰ
0.2
0.2
0.1
Ⅱ
0.2
0.2
0.12
下列说法不正确的是( )
A、 B、Ⅰ中反应达到平衡时,CO的转化率为50% C、达到平衡所需要的时间:Ⅱ>Ⅰ D、对于Ⅰ,平衡后向容器中再充入0.2mol CO和0.2mol , 平衡正向移动14. 某小组对FeCl3溶液与Cu粉混合后再加KSCN溶液的实验进行如下研究。①向2mL 0.1mol/L FeCl3溶液中加入过量Cu粉,充分反应后,溶液变蓝。2天后,溶液变为浅蓝色,有白色不溶物生成。
②取①中浅蓝色的上层清液,滴加KSCN溶液,溶液变红,出现白色浑浊。振荡后白色浑浊物增多,红色褪去。经检验,白色不溶物是CuSCN。
③向2mL 0.1mol/LCuSO4溶液中滴加KSCN溶液,未观察到白色浑浊。放置24小时后,出现白色不溶物。
已知:CuCl和CuSCN均为白色不溶固体
下列说法不正确的是( )
A、①中产生白色不溶物的可能原因是Cu+Cu2++2Cl-=2CuCl↓ B、由③可知②中白色浑浊不是Cu2+与SCN-直接反应生成的 C、②中红色褪去的原因是Fe3+被完全消耗了 D、实验表明:Ksp(CuSCN)<Ksp(CuCl)二、非选择题
-
15. Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。
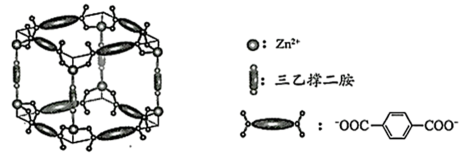 (1)、 Zn2+的价层电子排布式是。(2)、C、O、N的电负性从大到小的顺序是。(3)、三乙撑二胺(
(1)、 Zn2+的价层电子排布式是。(2)、C、O、N的电负性从大到小的顺序是。(3)、三乙撑二胺(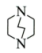 )与Zn2+能形成配位键的原因是。 (4)、在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1 , 晶胞示意图如图。一定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2 , 被称为“会呼吸”的晶体。
)与Zn2+能形成配位键的原因是。 (4)、在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1 , 晶胞示意图如图。一定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2 , 被称为“会呼吸”的晶体。
晶体
装载分子
晶胞中Zn2+个数
晶胞体积/cm3
M1
顺式偶氮苯
x
M2
反式偶氮苯
4
资料:ⅰ.
ⅱ.M1和M2相互转化时,Zn2+的配体和配体数均不变
①N2的电子式是。
②偶氮苯(
 )中N的杂化轨道类型是。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在(填“σ键”或“π键”)。
)中N的杂化轨道类型是。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在(填“σ键”或“π键”)。③x=。
④晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是光照射。
16. 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟氧化结合溶液吸收法同时脱除和NO的过程示意图如下。 (1)、气体反应器中的主要反应原理及相关数据如下表。
(1)、气体反应器中的主要反应原理及相关数据如下表。反应
平衡常数(25℃)
活化能/(kJ/mol)
反应a:
24.6
反应b:
3.17
反应c:
58.17
①已知: , 则。
②其他条件不变时,高于150℃,在相同时间内和NO的转化率均随温度升高而降低,原因是。
③其他条件不变,和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,和NO的转化率随的浓度的变化如图。结合数据分析NO的转化率高于的原因。
 (2)、其他条件不变,和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,与NO的物质的量之比对和NO脱除率的影响如图。
(2)、其他条件不变,和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,与NO的物质的量之比对和NO脱除率的影响如图。
①溶液显碱性,用化学平衡原理解释:。
②的浓度很低时,的脱除率超过97%,原因是。
③在吸收器中,与反应生成和的离子方程式是。
④在吸收器中,随着吸收过程的进行,部分被转化为 , 反应中和的物质的量之比为1:1,该反应的离子方程式是。
17. 普卡必利可用于治疗某些肠道疾病,其合成路线如下(部分条件和产物略去):
已知:ⅰ.RNH2

ⅱ.
ⅲ.

 (1)、A中的官能团名称是氨基和。(2)、试剂a的结构简式是。(3)、E→F的反应类型是。(4)、D→E的化学方程式是。(5)、I的核磁共振氢谱只有一组峰,I的结构简式是。(6)、下列说法正确的是(填序号)。
(1)、A中的官能团名称是氨基和。(2)、试剂a的结构简式是。(3)、E→F的反应类型是。(4)、D→E的化学方程式是。(5)、I的核磁共振氢谱只有一组峰,I的结构简式是。(6)、下列说法正确的是(填序号)。a.J→K的反应过程需要控制不过量
b.G与溶液作用显紫色
c.普卡必利中含有酰胺基和氨基,能与盐酸反应
(7)、K→L加入的作用是。(8)、以G和M为原料合成普卡必利时,在反应体系中检测到有机物Q,写出中间产物P、Q的结构简式:、。 18. 制备锂离子电池的正极材料的前体的一种流程如下:
18. 制备锂离子电池的正极材料的前体的一种流程如下:
资料:i.磷灰石的主要成分是
ii.可溶于水,微溶于水
ii.
iv.
(1)、制备①用溶液、溶液分步浸取磷灰石生成HF、和 , 主要反应是和。
②增大酸浸反应速率的措施有(只写1条)。
③其他条件不变时,若仅用溶液酸浸,浸取的速率低于用、分步浸取法,原因是。
(2)、制备将、、混合并调节溶液的pH制备。
①酸性条件下,生成的离子方程式是。
②含磷各微粒的物质的量分数与pH的关系如图。

pH=1时,溶液中的 , 则。再加入晶体、溶液使溶液中的 , 不考虑溶液体积的变化,通过计算说明此时能否产生沉淀。
③的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
ⅰ.研究表明,沉淀时可加入含的溶液,的作用是。
ⅱ.其他条件不变时,工业上选择pH=2而不是更高的pH制备 , 可能的原因是(答出2点)。
19. 探究溶液中与单质s的反应。资料:不溶于盐酸,和在盐酸中均发生沉淀的转化
实验Ⅰ 将10mL 溶液与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)、研究黑色固体b的组成①根据S具有性,推测b中可能含有、Ag、或。
②检验黑色固体b的成分
实验Ⅱ 具体操作如图所示

ⅰ.取少量滤液c,先加入足量稀盐酸,再滴加溶液,未出现白色沉淀,判断黑色固体b中不含。
ⅱ.用滤液c继续实验证明了黑色固体b中不含 , 可选择的试剂是(填序号)。
a.酸性溶液 b.和的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有 , 写出同时生成Ag和的离子方程式:。
(2)、研究无色溶液a的组成结合上述实验结果,分析溶液a中可能存在或 , 依据是。
实验Ⅲ 具体操作如图所示

①说明溶液a中不含的实验证据是。
②加入足量稀盐酸的作用是。
(3)、在注射器中进行实验Ⅳ,探究溶液与S的反应,所得产物与实验Ⅰ相同。①向注射器中加入的物质是。
②改用溶液的目的是。
(4)、用溶液与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中与S反应的离子方程式并简要说明的作用:。