北京市门头沟区2022届高三一模化学试题
试卷更新日期:2022-04-15 类型:高考模拟
一、单选题
-
1. 第24届冬季奥林匹克运动会在北京市和张家口市成功举办。下列不属于化学变化的是( )
A
B
C
D




冬奥场馆使用CO2跨临界直接制冰(“水立方”场馆中的水冰转换)
北京冬奥会菜单上有678道菜,其中工作人员对食材进行的煎、炒、烹、炸过程
冬奥会开幕式中火炬“飞扬”中氢燃料的燃烧
冬奥会上采用紫外杀菌技术使蛋白质变性
A、A B、B C、C D、D2. 下列化学用语或表示不正确的是( )A、甲基的电子式: B、乙烯的分子结构模型:
B、乙烯的分子结构模型: C、中子数为18的氯原子:Cl
D、基态Cr的电子排布式:1s22s22p63s23p63d44s2
3. 下列表述不正确的是( )A、原子轨道能量:1s<2s<3s<4s B、M电子层存在3个能级、9个原子轨道 C、4s电子能量较高,总是在比3s电子离核更远的地方运动 D、同一周期,碱金属元素的第一电离能最小,最容易失电子4. 将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述不正确的是( )
C、中子数为18的氯原子:Cl
D、基态Cr的电子排布式:1s22s22p63s23p63d44s2
3. 下列表述不正确的是( )A、原子轨道能量:1s<2s<3s<4s B、M电子层存在3个能级、9个原子轨道 C、4s电子能量较高,总是在比3s电子离核更远的地方运动 D、同一周期,碱金属元素的第一电离能最小,最容易失电子4. 将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述不正确的是( ) A、H2S和空气通过上述循环的目的是降低活化能,提高总反应速率 B、在转化过程中能循环利用的物质是FeCl3和CuCl2 C、该过程的总反应式为:2H2S+O22H2O+2S↓ D、若有1molH2S发生图示转化的同时消耗O2为0.4mol,则混合液中Fe3+浓度增大5. 下列装置能达到相应实验目的的是( )
A、H2S和空气通过上述循环的目的是降低活化能,提高总反应速率 B、在转化过程中能循环利用的物质是FeCl3和CuCl2 C、该过程的总反应式为:2H2S+O22H2O+2S↓ D、若有1molH2S发生图示转化的同时消耗O2为0.4mol,则混合液中Fe3+浓度增大5. 下列装置能达到相应实验目的的是( )去除CO2中少量HCl
制取氯气
分离酒精和水
收集NO2




A
B
C
D
A、A B、B C、C D、D6. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1L0.2mol·L-1NH4Cl溶液中,NH的数目为0.2NA B、标准状况下,11.2LCCl4含共用电子对数为2NA C、24g正丁烷和5g异丁烷的混合物中含共价键数目为6.5NA D、等质量的O2和O3中,所含电子数之比为2∶37. 近期,我国研究人员报道了温和条件下实现固氮的一类三元NiFeV催化剂,如图为其电催化固氮的机理示意图。以下关于该电催化机理过程的描述不正确的是( ) A、反应在酸性条件下进行 B、反应过程涉及N2的氧化反应 C、1个N2分子反应生成2个NH3分子 D、反应分多步进行,中间产物为几种不同的氮氢化物8. 下列用于解释实验事实的离子方程式不正确的是( )A、酚酞滴入碳酸钠溶液中,溶液变红色:CO+2H2OH2CO3+2OH- B、向NaHCO3溶液中加入少量澄清石灰水,有白色沉淀生成:2HCO+Ca2++2OH-=CaCO3↓+CO+2H2O C、FeSO4溶液滴入溴水中,溴水颜色变浅:2Fe2++Br2=2Fe3++2Br- D、苯酚钠溶液中通入少量CO2气体,溶液变浑浊:C6H5O-+CO2+H2O=C6H5OH+HCO9. 已知[Co(H2O)6]2+呈粉红色、[CoCl4]2—呈蓝色、[ZnCl4]2—为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl—[CoCl4]2—+6H2O △H,将该溶液分为三份做实验,溶液的颜色变化如表:
A、反应在酸性条件下进行 B、反应过程涉及N2的氧化反应 C、1个N2分子反应生成2个NH3分子 D、反应分多步进行,中间产物为几种不同的氮氢化物8. 下列用于解释实验事实的离子方程式不正确的是( )A、酚酞滴入碳酸钠溶液中,溶液变红色:CO+2H2OH2CO3+2OH- B、向NaHCO3溶液中加入少量澄清石灰水,有白色沉淀生成:2HCO+Ca2++2OH-=CaCO3↓+CO+2H2O C、FeSO4溶液滴入溴水中,溴水颜色变浅:2Fe2++Br2=2Fe3++2Br- D、苯酚钠溶液中通入少量CO2气体,溶液变浑浊:C6H5O-+CO2+H2O=C6H5OH+HCO9. 已知[Co(H2O)6]2+呈粉红色、[CoCl4]2—呈蓝色、[ZnCl4]2—为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl—[CoCl4]2—+6H2O △H,将该溶液分为三份做实验,溶液的颜色变化如表:装置
序号
操作
现象

①
将试管置于冰水浴中
溶液均呈粉红色
②
加水稀释
③
加少量ZnCl2固体
以下结论和解释正确的是( )
A、等物质的量的[Co(H2O)6]2+和[CoCl4]2—中σ键数之比为3:2 B、由实验①可知:△H<0,由实验②可推知加水稀释,浓度熵Q<K,平衡逆向移动 C、由实验③可知:Zn2+络合Cl—能力比Co2+络合Cl—能力弱 D、实验①②③可知:配合物的形成与温度、配体的浓度及配体的种类等有关10. 工业上可通过甲醇羰基化法制取甲酸甲酯:CH3OH(g)+CO(g)HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示,下列说法正确的是( ) A、反应速率vb>vd B、由图可知生产时反应温度控制在80~85℃为宜 C、向该容器中充入N2 , CH3OH的转化率增大 D、d→e,CO的转化率随温度的升高而减小,是因为该反应是吸热反应,升高温度反应正向移动11. 高聚物A在生物医学上有广泛应用。以N—乙烯基吡咯烷酮(NVP)和甲基丙烯酸β—羟乙酯(HEMA)为原料合成路线如图:
A、反应速率vb>vd B、由图可知生产时反应温度控制在80~85℃为宜 C、向该容器中充入N2 , CH3OH的转化率增大 D、d→e,CO的转化率随温度的升高而减小,是因为该反应是吸热反应,升高温度反应正向移动11. 高聚物A在生物医学上有广泛应用。以N—乙烯基吡咯烷酮(NVP)和甲基丙烯酸β—羟乙酯(HEMA)为原料合成路线如图:
下列说法正确的是( )
A、HEMA具有顺反异构 B、1mol高聚物A可以与2molNaOH反应 C、NVP分子式为C6H9NO D、HEMA和NVP通过缩聚反应生成高聚物A12. 下表中的实验操作能达到实验目的或能得出相应结论的是( )选项
实验操作
实验目的或结论
A
向2mL0.1mol·L-1MgCl2溶液中加入5mL0.1mol·L-1NaOH溶液,出现白色沉淀后,继续滴入几滴FeCl3浓溶液,静置,出现红褐色沉淀
相同温度下,Fe(OH)3比Mg(OH)2更难溶
B
向某溶液中滴加少量KSCN溶液,无现象,再滴加几滴新制氯水,溶液变红
该溶液中含有Fe2+
C
向BaCl2溶液中通入SO2和X气体,产生白色沉淀
气体X一定具有强氧化性
D
室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液pH约为10,0.1mol·L-1NaHSO3溶液pH约为5
HSO结合H+的能力比SO的强
A、A B、B C、C D、D13. 在实验室中以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料制备NixOy和CoCO3的工艺流程如图。
下列说法不正确的是( )
A、“滤渣I”中含硅和钡元素 B、“氧化”“调pH”时均需要加过量的试剂 C、“沉钴”过程发生的反应为Co2++2HCO=CoCO3↓+CO2↑+H2O D、“沉钴”时,若c(Co2+)=0.02mol·L-1 , 为了防止沉钴时生成Co(OH)2 , 常温下应控制溶液pH<7.5(已知Ksp[Co(OH)2]=2×10-15)14. 25℃时,向15mL0.1mol·L-1的NaOH溶液中逐滴滴入0.1mol·L-1的CH3COOH溶液,加入CH3COOH溶液的体积与混合溶液pH的关系如图所示(混合过程中忽略溶液体积变化)。下列分析不正确的是( ) A、c点对应溶液中,=1 B、b点与c点所示溶液中水的电离程度:b>c C、a点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D、b点对应的溶液中c(CH3COO-)+c(CH3COOH)=0.1mol·L-1
A、c点对应溶液中,=1 B、b点与c点所示溶液中水的电离程度:b>c C、a点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D、b点对应的溶液中c(CH3COO-)+c(CH3COOH)=0.1mol·L-1二、综合题
-
15. CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善。由CO2合成甲醇是CO2资源化利用的重要方法。(1)、Ⅰ.合成甲醇
由CO2催化加氢合成甲醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3 , 它们随温度变化的曲线如图所示。
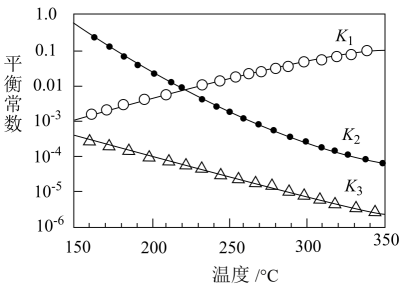
①则△H2△H3(填“>”“<”或“=”)。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法不正确的是(填字母)。
a.增大初始投料比 , 有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
(2)、电化学原理将CO2转化为甲醇。在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在(填“阴”或“阳”)极生成;
②氧化反应为。
(3)、Ⅱ.甲醇是重要的化工原料,也可用作甲醇燃料电池。以稀硫酸为电解质溶液,甲醇燃料电池的工作原理如图所示。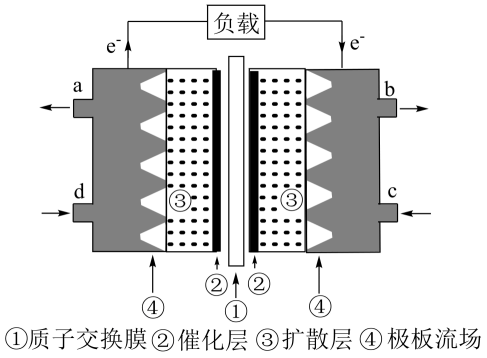
该电池工作时,c口通入的物质是。
(4)、该电池负极的电极反应式是。16. 碳酸二甲酯( )是一种环保性能优异,用途广泛的化工原料,其合成方法有多种。 (1)、Ⅰ.在催化剂作用下由CO2制备碳酸二甲酯的过程如图:
)是一种环保性能优异,用途广泛的化工原料,其合成方法有多种。 (1)、Ⅰ.在催化剂作用下由CO2制备碳酸二甲酯的过程如图:
尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而电离能较低;
②。
(2)、下列关于氨气的叙述不正确的是(填字母)。a.NH3的键角小于CH4的键角,是因为NH3的中心原子上孤电子对有较大斥力
b.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
c.NH3的沸点比PH3的高,是因为N—H的键能比P—H的大
(3)、Ⅱ.在CeO2—ZrO2固溶体的催化体系中也能将CO2转化为碳酸二甲酯。氧化锆(化学式为ZrO2)晶胞结构如图所示,Zr4+在晶胞中的配位数是 , 若该晶胞的密度为ρg·cm-3 , 用NA表示阿伏加德罗常数的值,则该晶胞的体积是cm3(列出计算式)。(氧化锆的摩尔质量M=123g·mol-1)
 (4)、Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如表所示。
(4)、Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如表所示。元素
电离能(kJ·mol-1)
I1
I2
I3
Mn
717
1509
3248
Fe
759
1561
2957
①铁元素位于元素周期表族,属于区。
②比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子更难,请从原子结构分析原因。
17. 我国科学家发现化合物J对消除由蜈蚣叮咬产生的严重临床症状有良好效果。J的两条合成路线如图所示。
已知:ⅰ.R—NH2
 R—NH2(R代表烃基)
R—NH2(R代表烃基)ⅱ.—NH2易被氧化
回答下列问题:
(1)、A中官能团有:硝基和。(2)、D→E的化学方程式是。F的结构简式是。(3)、反应中 的作用。 (4)、B有多种同分异构体,写出任意一种同时满足下列条件的M的结构简式是。
的作用。 (4)、B有多种同分异构体,写出任意一种同时满足下列条件的M的结构简式是。①含有—NO2的芳香族化合物
②能发生水解反应且水解产物之一含有醛基
③苯环上一氯代物有两种
(5)、G→H的反应类型是。(6)、I→J的反应还可能有副产物,请写出其中一种的结构简式。(7)、苯胺( )和乙二酸(HOOC—COOH)为起始原料,可以制备
)和乙二酸(HOOC—COOH)为起始原料,可以制备 。选用必要的试剂完成合成路线。 18. 废弃的锂离子电池中含有大量Co、Ni、Mn、Cu、Al等金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液,下列是某小组研究从柠檬酸浸出液中去除铜的方法。(1)、方法一:调pH去除铜
。选用必要的试剂完成合成路线。 18. 废弃的锂离子电池中含有大量Co、Ni、Mn、Cu、Al等金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液,下列是某小组研究从柠檬酸浸出液中去除铜的方法。(1)、方法一:调pH去除铜资料1:金属离子沉淀的pH
Al(OH)3
Cu(OH)2
Ni(OH)2
Co(OH)2
Mn(OH)2
开始沉淀pH
3.53
4.91
6.88
7.40
8.14
完全沉淀pH
4.89
6.67
8.87
9.39
10.14
由数据分析,甲同学提出可以控制溶液pH至去除溶液中铜离子。
(2)、设计实验,测得不同pH下铜的沉淀率如表。pH
5
8
10
12
铜的沉淀率
2.3
7.2
9.8
12
由数据分析pH=12时铜的沉淀率为12%,远小于理论分析结果,分析可能原因。
结论:不可以通过调pH去除铜。
(3)、方法二:还原法去除铜资料2:抗坏血酸(C6H8O6)具有较强的还原性,氧化后为脱氢抗坏血酸(C6H6O6);受热易分解。
向柠檬酸浸出液中加入抗坏血酸能有效的将Cu2+还原成金属Cu。某实验小组研究了相同条件下,pH、反应时间和温度分别对Cu沉淀率的影响。
依据图1和图2,判断沉淀铜选择最佳pH为 , 理由是。
 (4)、从图3可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降。分析原因。
(4)、从图3可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降。分析原因。 (5)、由上述实验可知:抗坏血酸还原铜离子可能存在的路径 , 。(用离子方程式表示)
(5)、由上述实验可知:抗坏血酸还原铜离子可能存在的路径 , 。(用离子方程式表示)结论:可以通过还原法去除铜。
19. 某实验小组探究Mn2+的检测方法。查阅资料:Mn2+的稀溶液几乎无色,在酸性介质中,S2O能将Mn2+氧化成MnO。
(1)、资料中检测Mn2+方法的反应为(用离子方程式表示)。甲同学设计实验如表。
序号
实验操作
实验现象
Ⅰ
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体
5min无明显现象
(2)、实验Ⅰ并未观察到预期现象,查阅资料,并进行以下实验。序号
实验操作
实验现象
Ⅱ
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,加热至沸腾
溶液变棕黄色,1min后出现紫红色
Ⅲ
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,再滴入2滴0.1mol·L-1AgNO3溶液
溶液变棕黄色,5min出现紫红色
Ⅳ
向1mL0.05mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,加热至沸腾
迅速生成棕黑色沉淀
①对比实验Ⅱ、Ⅲ,推测实验Ⅰ无明显现象的原因。
②解释实验Ⅱ、Ⅲ中溶液变棕黄色的原因。
③结合离子方程式解释实验Ⅳ中产生棕黑色沉淀的原因。
(3)、乙同学继续设计实验序号
实验操作
实验现象
V
向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体+ , 微热
1min后出现紫红色
完成表格中空白处。
(4)、总结:探究Mn2+的检测方法需要考虑的因素有。