北京市海淀区2022届高考一模考试化学试题
试卷更新日期:2022-04-15 类型:高考模拟
一、单选题
-
1. 北京2022年冬奥会中使用了大量新材料。下列属于金属材料的是( )
A
B
C
D




速滑冰刀中的钛合金
“飞扬”火炬中的聚硅氮烷树脂
颁奖礼服中的石墨烯发热材料
可降解餐具中的聚乳酸材料
A、A B、B C、C D、D2. 下列化学用语或图示表达正确的是( )A、N2的结构式: B、顺-2-丁烯的球棍模型: C、的空间填充模型:
C、的空间填充模型: D、基态氮原子的轨道表示式:
D、基态氮原子的轨道表示式: 3. 下列说法正确的是( )A、标准状况下,的体积为22.4L B、同温同压下,等体积的和CO所含分子数相同 C、丁烷所含碳原子数是相同质量乙烷的2倍 D、的盐酸中, 为4. 下列方程式能准确解释事实的是( )A、呼吸面具中用吸收并供氧: B、自然界的高能固氮: C、苯酚钠溶液通入后变浑浊:2
3. 下列说法正确的是( )A、标准状况下,的体积为22.4L B、同温同压下,等体积的和CO所含分子数相同 C、丁烷所含碳原子数是相同质量乙烷的2倍 D、的盐酸中, 为4. 下列方程式能准确解释事实的是( )A、呼吸面具中用吸收并供氧: B、自然界的高能固氮: C、苯酚钠溶液通入后变浑浊:2 +H2O+CO22
+H2O+CO22 +Na2CO3
D、白醋可除去水壶中的水垢:
5. 下列实验现象中的颜色变化与氧化还原反应无关的是( )
+Na2CO3
D、白醋可除去水壶中的水垢:
5. 下列实验现象中的颜色变化与氧化还原反应无关的是( )A
B
C
D
实验
溶液滴入溶液中
通入溶液中
溶液滴入浊液中
铜丝加热后,伸入无水乙醇中
现象
产生白色沉淀,最终变为红褐色
产生淡黄色沉淀
沉淀由白色逐渐变为黄色
先变黑,后重新变为红色
A、A B、B C、C D、D6. 铋可改善钢的加工性能。周期表中铋与砷同主族,其最稳定的同位素是。下列说法不正确的是( )A、是第六周期元素 B、的中子数是126 C、的原子半径比的小 D、和具有相同的电子数7. 配制银氨溶液并进行实验,过程如下图。
下列对该实验的说法不正确的是( )
A、用银镜反应可以检验醛基 B、滴加稀氨水后沉淀溶解,是因为生成了 C、实验后,可以用硝酸洗掉试管上的银镜 D、将乙醛换成蔗糖,同样可以得到光亮的银镜8. 某科研团队研究用不同金属氧化物催化肉桂醛制苯甲醛(反应如下,部分产物略去)。反应时间和其它条件相同时,测得实验数据如下表。
催化剂
金属元素的电负性
肉桂醛转化率/%
苯甲醛选择性/%
0.9
80.79
71.93
1.0
78.27
60.51
1.5
74.21
54.83
1.6
76.46
48.57
1.9
75.34
41.71
已知:i.选择性
ii.与同主族。
下列说法不正确的是( )
A、肉桂醛制苯甲醛的反应属于氧化反应 B、用作催化剂可以获得比用更大的主反应速率 C、使用作催化剂时,反应后副产物最多 D、金属氧化物中金属元素的电负性越小,苯甲醛选择性越好9. 硅橡胶是一种兼具有机物和无机物性质、热稳定性好的高分子材料。两种硅橡胶L和M的结构如下图(图中~表示链延长)。
已知:的性质与C相似,L可由 , 在酸催化下水解、聚合制得。下列关于硅橡胶的说法不正确的是( )
A、L、M的热稳定性好与键键能大有关 B、由制得L的过程中,有产生 C、M可通过加成反应实现交联,得到网状结构 D、硅橡胶的抗氧化性:10. 下列有关实验现象的解释或所得结论正确的是( )选项
实验操作
现象
解释或结论
A
向某补血口服液中滴加几滴酸性溶液
酸性溶液紫色褪去
该补血口服液中一定含有
B
用蒸馏水溶解固体,并继续加水稀释
溶液由绿色逐渐变为蓝色
正向移动
C
将25℃溶液加热到40℃,用传感器监测溶液pH变化
溶液的pH逐渐减小
温度升高,水解平衡正向移动
D
将铜与浓硫酸反应产生的气体通入溶液中
产生白色沉淀
该气体中一定含有
A、A B、B C、C D、D11. 实验小组用双指示剂法准确测定样品(杂质为)的纯度。步骤如下:①称取m g样品,配制成100mL溶液;
②取出25mL溶液置于锥形瓶中,加入2滴酚酞溶液,用浓度为的盐酸滴定至溶液恰好褪色(溶质为和),消耗盐酸体积为;
③滴入2滴甲基橙溶液,继续滴定至终点,消耗盐酸体积为。
下列说法正确的是( )
A、①中配制溶液时,需在容量瓶中加入100mL水 B、②中溶液恰好褪色时: C、样品纯度为 D、配制溶液时放置时间过长,会导致最终测定结果偏高12. 铁粉在弱酸性条件下去除废水中的反应原理如下图。
下列说法正确的是( )
A、上述条件下加入的能完全反应 B、正极的电极反应式: C、的产生与被氧化和溶液pH升高有关 D、废水中溶解氧的含量不会影响的去除率13. 合成氨原料气中的可通过水煤气变换反应除去。某合成氨原料气中、、、的体积分数分别为20%、50%、25%、5%。一定温度下按不同投料比通入水蒸气,平衡后混合气体中的体积分数如下表。投料比
的体积分数/%
温度/℃
200
1.70
0.21
0.02
250
2.73
0.30
0.06
300
6.00
0.84
0.43
350
7.85
1.52
0.80
下列说法不正确的是( )
A、从表中数据可知,水煤气变换反应的 B、温度相同时,投料比大,的转化率高 C、按=1通入水蒸气后,反应前在混合气体中的体积分数为20% D、根据=1时数据推算,300℃时水煤气变换反应的平衡常数K为4614. 实验小组探究双氧水与KI的反应,实验方案如下表。序号
①
②
③
实验装置及操作



实验现象
溶液无明显变化
溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色
溶液立即交为棕黄色,产生少量无色气体;溶液颜色逐渐加深,温度无明显变化;最终有紫黑色沉淀析出溶液无明显变化
下列说法不正确的是( )
A、对分解有催化作用 B、对比②和③,酸性条件下氧化的速率更大 C、对比②和③,②中的现象可能是因为分解的速率大于H2O2氧化的速率 D、实验②③中的温度差异说明,氧化的反应放热二、非选择题
-
15. 硅是地壳中储量仅次于氧的元素,在自然界中主要以和硅酸盐的形式存在。(1)、基态硅原子的价电子排布式为。(2)、硅、金刚石和碳化硅晶体的熔点从高到低依次为。(3)、晶态的晶胞如图。

①硅原子的杂化方式为。
②已知晶胞的棱长均为a pm,则晶体的密度(列出计算式)。
(4)、硅元素最高价氧化物对应的水化物为原硅酸。资料:原硅酸(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠溶液吸收空气中的会生成 , 结合元素周期律解释原因:。
②从结构的角度解释脱水后溶解度降低的原因:。
16. 氯碱工业是化工产业的重要基础,其装置示意图如图。生产过程中产生的氯酸盐副产物需要处理。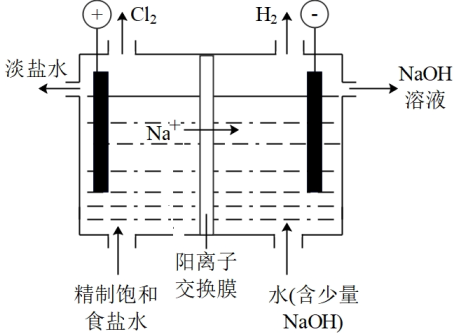
已知:pH升高时,易歧化为和。
(1)、电解饱和食盐水的离子方程式为。(2)、下列关于产生的说法中,合理的是(填序号)。a.主要在阴极室产生
b.在电极上放电,可能产生
c.阳离子交换膜破损导致向阳极室迁移,可能产生
(3)、测定副产物含量的方法如下图。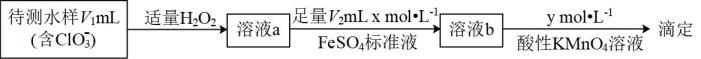
①加入的目的是消耗水样中残留的和。若测定中未加入 , 则测得的水样中的浓度将(填“偏大”“偏小”或“不受影响”)。
②滴定至终点时消耗酸性溶液,水样中的计算式为。
(4)、可用盐酸处理淡盐水中的并回收。①反应的离子方程式为。
②处理时,盐酸可能的作用是:
i.提高 , 使氧化性提高或还原性提高;
ii.提高 , 。
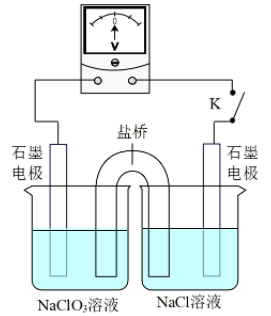
③用如图装置验证i,请补全操作和现象:闭合K,至指针读数稳定后,。
 17. 在电池中有重要应用。以软锰矿(主要成分为)为原料制备粗二氧化锰颗粒的过程如下:
17. 在电池中有重要应用。以软锰矿(主要成分为)为原料制备粗二氧化锰颗粒的过程如下: (1)、浸出
(1)、浸出①用硫酸和可溶解软锰矿,请补全该反应的离子方程式:
□+□ +□ =□+□□
②浸出时可用代替硫酸和。下列说法正确的是(填序号)。
a.在反应中作氧化剂
b.用浸出可减少酸的使用
c.该法可同时处理烟气中的 , 减少大气污染
(2)、净化、分离①软锰矿浸出液中的、可通过加碱转化为沉淀去除,分离出清液的方法是。
②为减少碱用量,可以通过稀释浸出液除去 , 结合离子方程式解释原理:。
(3)、热解在一定空气流速下,相同时间内热解产物中不同价态的占比随热解温度的变化如图。热解过程中涉及如下化学反应:
i.
ii.
iii.

①为了增大产物中的占比,可以采用的措施是(答出两条)。
②温度升高,产物中的占比降低,可能的原因是。
18. 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。【设计实验】
序号
反应温度/℃
①
2.0
2.0
0
20
②
2.0
1.0
1.0
20
(1)、实验①和②的目的是。(2)、甲认为上述实验应控制pH相同,可加入的试剂是(填序号)。a.盐酸 b.硫酸 c.草酸
(3)、【实施实验】小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)无色,在草酸中不能形成配合物;
(b)无色,有强氧化性,发生反应(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生和。
乙同学从氧化还原角度推测阶段i中可能产生 , 你认为该观点是否合理,并说明理由:。(4)、乙同学从氧化还原角度推测阶段i中可能产生 , 你认为该观点是否合理,并说明理由:。(5)、【继续探究】进一步实验证明溶液中含有 , 反应过程中和浓度随时间的变化如下图。

第i阶段中检测到有气体产生,反应的离子方程式为。
(6)、实验②在第ii阶段的反应速率较大,可能的原因是。(7)、据此推测,若在第ii阶段将调节至 , 溶液褪至无色的时间会(填“增加”“减少”或“不变”)。(8)、【结论与反思】上述实验涉及的反应中,草酸的作用是。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
19. 多环化合物Y是一种药物合成的中间体,它的一种合成路线如下图(部分反应条件或试剂略去)。
已知:
i.R1-CHO+


 (1)、A的名称是。(2)、下列说法中,正确的是(填序号)。
(1)、A的名称是。(2)、下列说法中,正确的是(填序号)。a.由A制备B时,需要使用浓硝酸和浓硫酸
b.D中含有的官能团只有硝基
c.D→E可以通过取代反应实现
(3)、E→G的化学方程式是。(4)、I的结构简式是。(5)、J在一定条件下发生反应,可以生成化合物X、乙酸和水,生成物中化合物X和乙酸的物质的量之比是。(6)、K中除苯环外,还含有一个五元环。K的结构简式是。(7)、知:ii.
 +R3-NH2
+R3-NH2
iii.亚胺结构(
 )中键性质类似于羰基,在一定条件下能发生类似i的反应。
)中键性质类似于羰基,在一定条件下能发生类似i的反应。M与L在一定条件下转化为Y的一种路线如下图。

写出中间产物1、中间产物2的结构简式:、。