安徽省合肥市2022届高三第二次教学质量检测理综化学试题
试卷更新日期:2022-04-15 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会不仅是运动健儿的“竞技场”,也是前沿科技的“试验田”。下列有关北京冬奥会中的化学知识叙述正确的是( )A、冬奥礼服内胆添加了石墨烯发热材料,石墨烯属于烯烃类物质 B、“冰丝带”冬奥馆采用二氧化碳跨临界制冰技术,利用了二氧化碳分解吸热原理 C、火炬“飞扬”使用清洁的氢燃料,利用焰色反应给火焰着色,焰色反应是化学变化 D、冬奥餐厅使用了安全的可降解餐具,其材料聚乳酸是由乳酸合成的有机高分子2. 伽罗木醇是制作杀虫剂的常用原料,其结构简式如图所示。下列有关该物质的叙述正确的是( )
 A、分子式为C10H16O B、可发生消去、加成、氧化反应 C、与
A、分子式为C10H16O B、可发生消去、加成、氧化反应 C、与 互为同分异构体
D、1 mol该物质与足量金属钠反应放出11.2L H2
3. 下列实验装置可以达到实验目的是( )
互为同分异构体
D、1 mol该物质与足量金属钠反应放出11.2L H2
3. 下列实验装置可以达到实验目的是( ) A、装置①可用于熔融NaOH 固体 B、装置②可用于测定氯水的pH C、装置③可用于除去NaCl固体中混有的NH4Cl D、装置④可用于制备溴苯并验证发生了取代反应4. 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列叙述不正确的是( )
A、装置①可用于熔融NaOH 固体 B、装置②可用于测定氯水的pH C、装置③可用于除去NaCl固体中混有的NH4Cl D、装置④可用于制备溴苯并验证发生了取代反应4. 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列叙述不正确的是( ) A、该历程中HCHO中所有的C-H键均断裂 B、该过程的总反应为HCHO+O2CO2+H2O C、该反应中反应物的总能量低于生成物的总能量 D、生成物CO2中的氧原子由HCHO和O2共同提供5. X、Y、Z、W是原子序数依次增大的四种短周期元素,X氢化物的水溶液可用于刻蚀玻璃,Y是地壳中含量最高的金属元素,Z原子的核外电子数是X最外层电子数的2倍,W的单质是制作黑火药的原料之一。下列结论正确的是( )A、工业上通过电解法获取Y的单质 B、简单氢化物的沸点:X<W C、简单离子半径大小:X>Y>W D、最高价氧化物水化物的酸性:Z>W6. 中国科学家设计出如图装置实现CO2的转化,可有效解决温室效应及能源问题,总反应为CO2+NaClCO+NaClO。忽略气体在溶液中的溶解及溶液的体积变化,下列叙述正确的是( )
A、该历程中HCHO中所有的C-H键均断裂 B、该过程的总反应为HCHO+O2CO2+H2O C、该反应中反应物的总能量低于生成物的总能量 D、生成物CO2中的氧原子由HCHO和O2共同提供5. X、Y、Z、W是原子序数依次增大的四种短周期元素,X氢化物的水溶液可用于刻蚀玻璃,Y是地壳中含量最高的金属元素,Z原子的核外电子数是X最外层电子数的2倍,W的单质是制作黑火药的原料之一。下列结论正确的是( )A、工业上通过电解法获取Y的单质 B、简单氢化物的沸点:X<W C、简单离子半径大小:X>Y>W D、最高价氧化物水化物的酸性:Z>W6. 中国科学家设计出如图装置实现CO2的转化,可有效解决温室效应及能源问题,总反应为CO2+NaClCO+NaClO。忽略气体在溶液中的溶解及溶液的体积变化,下列叙述正确的是( ) A、A极为太阳能电池的正极 B、电极II的电极反应式为Cl-+2e-+H2O=ClO-+2H+ C、理论上转化44gCO2 , 左室溶液质量增重18g D、电解结束后,电极II所在电极室溶液的pH变小7. 常温下,向100mL0.1mol·L-1的NaA溶液中通入HF(g),溶液中lg(X代表A或F)的值和pH的关系如图所示,已知酸性:HF>HA,忽略溶液体积的变化,下列叙述不正确的是( )
A、A极为太阳能电池的正极 B、电极II的电极反应式为Cl-+2e-+H2O=ClO-+2H+ C、理论上转化44gCO2 , 左室溶液质量增重18g D、电解结束后,电极II所在电极室溶液的pH变小7. 常温下,向100mL0.1mol·L-1的NaA溶液中通入HF(g),溶液中lg(X代表A或F)的值和pH的关系如图所示,已知酸性:HF>HA,忽略溶液体积的变化,下列叙述不正确的是( ) A、HA的电离常数K=10-7.5 B、当c(F-)=c(HA)时,混合溶液pH=7 C、通入0.01molHF时,c(F-)>c(A-)>c(HF) D、随着HF的通入,溶液导电性先增大后减小
A、HA的电离常数K=10-7.5 B、当c(F-)=c(HA)时,混合溶液pH=7 C、通入0.01molHF时,c(F-)>c(A-)>c(HF) D、随着HF的通入,溶液导电性先增大后减小二、非选择题
-
8. 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。利用高浓度的NaClO溶液和异氰尿酸[(CNO) 3H3]固体制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。

已知:①3Cl2+6NaOH5NaCl+NaClO3+3H2O
②2NaClO+(CNO)3H3=(CNO) 3Cl2Na+NaOH+H2O
回答下列问题:
(1)、装置A中发生反应的离子方程式为。(2)、装置B中盛放的试剂为 , 若撤去该装置,对C中制备实验产生的影响是。(3)、三颈烧瓶液面上出现黄绿色气体时,由上口加入(CNO) 3H3固体,反应过程中仍需不断通入Cl2 , 原因是。(4)、装置C中冰水浴的目的是 。(5)、通过下列实验可测定二氯异氰尿酸钠样品中有效氯的含量(样品中不含NaClO):反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O=S4O+2I-
实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是。
②该样品中有效氯含量的表达式为。(有效氯=100%)。
③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将(填“偏高”、“偏低”或“无影响”)。
9. 钛合金是一种重要的航空材料,以下是以钛铁矿(主要成分为FeTiO3 , 含FeO和Fe2O3等杂质)为原料制备金属钛及副产品铁红的工艺流程: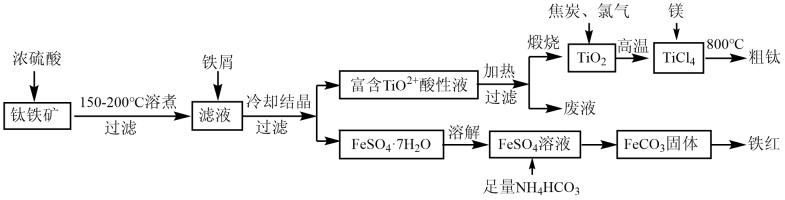
已知:①TiO2+易水解为TiO2·nH2O;高温下钛易与N2、H2等反应。
②常温下,Ksp [Fe(OH)2]=8.0×10-16 , Ksp[FeCO3]=3.2×10-11。
回答下列问题:
(1)、钛铁矿溶煮前需要粉碎,其目的是 。(2)、在“滤液”中加入铁屑的作用是 。(3)、FeSO4溶液中加入NH4HCO3时还有气体放出,写出反应的化学方程式: ,该反应温度不宜过高,原因是 。(4)、制备FeCO3时,若将NH4HCO3换成(NH4)2CO3 , 还会产生Fe(OH)2,原因可能是:FeCO3+2OH-→Fe(OH)2+CO , 计算该反应的平衡常数K=。(5)、“富含TiO2+酸性液”加热并过滤后,所得“废液”中溶质的主要成分是 。(6)、已知TiO2(s)+2Cl2(g)→TiCl4(1)+O2(g) ΔH=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生,从化学平衡的角度解释原因为 。(7)、镁与TiCl,高温下反应制备粗钛时需加保护气,下列可作为保护气的是____(填标号)。A、H2 B、Ar C、CO2 D、N210. 磷石膏是湿法生产磷酸的固体废弃物,主要成分是CaSO4·2H2O。用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。回答下列问题:(1)、用硫磺还原磷石膏。已知下列反应:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) ΔH1
3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) ΔH2
则反应:2CaSO4(s)+S(s)=2CaO(s)+3SO2(g) ,ΔH=(用ΔH1和ΔH2表示)。
(2)、以高硫煤为还原剂焙烧2.5小时,温度对CaSO4转化率的影响如下图所示,CaCl2的作用是;当温度高于1200℃时,无论有无CaCl2 , CaSO4的转化率都趋于相同,可能的原因是 。 (3)、用CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。
(3)、用CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。①温度低于800℃时,主要的还原产物是一种硫的最低价盐,该物质的化学式是。
②1150℃下,向盛有足量CaSO4的真空恒容密闭容器中充入一定量CO,反应体系起始压强为0.1a MPa,主要发生反应:CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g)。该反应达到平衡时,c(SO2)=8.0×10-5mol·L-1 , CO的转化率为80%,则初始时c(CO)=mol·L-1 , 该反应的分压平衡常数KP=MPa(用含a的代数式表示;分压=总压×物质的量分数;忽略副反应)。
(4)、以C作还原剂。向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物,1100℃煅烧至无气体产生,结果如下图所示。当C/S值为0.5时,反应产物主要为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,可能的原因是。 11. 镍锰酸锂(LiNi0.5Mn1.5O4)是一种成本低、原料丰富且环境友好的尖晶石结构材料,被认为是下一代动力锂离子电池首选的正极材料之一。回答下列问题:(1)、基态Mn原子的价电子层电子排布式为。(2)、Ni2+可与丁二酮肟反应生成如下物质:
11. 镍锰酸锂(LiNi0.5Mn1.5O4)是一种成本低、原料丰富且环境友好的尖晶石结构材料,被认为是下一代动力锂离子电池首选的正极材料之一。回答下列问题:(1)、基态Mn原子的价电子层电子排布式为。(2)、Ni2+可与丁二酮肟反应生成如下物质:
①该物质中含有的化学键类型有(填标号)。
A.共价键 B.离子键 C.配位键 D.金属键
②C、N、O的第一电离能由大到小的顺序是。
(3)、[Ni(N2H4)2](N3)2是一种富氮含能材料,N2H4中氮原子的杂化方式为;写出一种与N互为等电子体的分子(填化学式);实验数据表明键角NH3>PH3>AsH3 , 分析原因是。(4)、氮与碳还能形成一种离子液体的正离子 , 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。 (5)、研究人员设计了新款Li3SBF4快离子导体,具有良好导电能力,为锂离子电池的发展做出了有益的贡献。晶胞图如下,其中BF位于体心,则位于(填“顶点”或“棱心”)。若该晶胞最近的与距离为apm,则晶胞密度为g·cm-3(列出计算式)。
, 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。 (5)、研究人员设计了新款Li3SBF4快离子导体,具有良好导电能力,为锂离子电池的发展做出了有益的贡献。晶胞图如下,其中BF位于体心,则位于(填“顶点”或“棱心”)。若该晶胞最近的与距离为apm,则晶胞密度为g·cm-3(列出计算式)。 12. 氧氮杂环是新药研制过程中发现的一类重要活性物质,有抗肿瘤功效。下面是某研究小组提出的一种氧氮杂环类化合物F的合成路线:
12. 氧氮杂环是新药研制过程中发现的一类重要活性物质,有抗肿瘤功效。下面是某研究小组提出的一种氧氮杂环类化合物F的合成路线:
已知:RCH=CHCOOR′+


回答下列问题:
(1)、A的名称是 , B中含氧官能团的名称是。(2)、B生成C的化学方程式为。(3)、C与M一定条件下反应生成D,M的结构简式为 , D生成E的反应类型是。(4)、B的同分异构体中,满足以下条件有种。①不含-CH3 ②含2种官能团 ③含苯环,无其他环,且苯环上仅有2个取代基
其中核磁共振氢谱有三组峰,且峰面积之比为3:2:2的结构简式为。
(5)、参照上述合成路线和信息,写出由 和
和 为原料合成
为原料合成 的合成路线 (其他必要的试剂自选)。
的合成路线 (其他必要的试剂自选)。