广东省广州市天河区2022年九年级毕业班综合测试(一模)化学试题
试卷更新日期:2022-04-11 类型:中考模拟
一、单选题
-
1. 诗词是中国传统文化的瑰宝,下列诗词不涉及化学变化的是( )A、落红不是无情物,化作春泥更护花 B、千锤万凿出深山,烈火焚烧若等闲 C、飞流直下三千尺,疑是银河落九天 D、春蚕到死丝方尽,蜡炬成灰泪始干2. 空气是一种宝贵的资源,保护空气质量是全世界人类的共同使命,空气污染指数简称API。下列说法不正确的是( )A、目前计入API的污染物有SO2、CO2、NO2、可吸入颗粒物(PM10即飘尘)、O3等 B、保卫蓝天的途径有加强大气质量监测,开发新能源,积极植树造林 C、空气中的稀有气体可制成多种用途的电光源,如航标灯,霓虹灯等 D、酸性气体未经处理而排放到空气中,可能导致雨水的pH<5.6,形成酸雨3. 有机锗具有抗肿瘤的效果,锗元素的部分信息见如图。下列说法不正确的是( )

 A、锗属于金属元素 B、X=2 C、锗原子的核外电子数为32 D、锗的化学性质非常活泼4. 运输氢氧化钠固体的包装箱上应张贴的标识是( )A、
A、锗属于金属元素 B、X=2 C、锗原子的核外电子数为32 D、锗的化学性质非常活泼4. 运输氢氧化钠固体的包装箱上应张贴的标识是( )A、 B、
B、 C、
C、 D、
D、 5. 广东地区因气候等原因喜欢饮用凉茶,凉茶具有清热解毒、凉血利咽功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是( )A、黑芥子甙中氢、氧、硫元素的质量比为17:9:2 B、1个黑芥子甙中含有39个原子 C、黑芥子甙中的氮元素的质量分数最小 D、黑芥子甙在氧气中充分燃烧只生成CO2和H2O6. NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图。下列说法正确的是( )
5. 广东地区因气候等原因喜欢饮用凉茶,凉茶具有清热解毒、凉血利咽功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是( )A、黑芥子甙中氢、氧、硫元素的质量比为17:9:2 B、1个黑芥子甙中含有39个原子 C、黑芥子甙中的氮元素的质量分数最小 D、黑芥子甙在氧气中充分燃烧只生成CO2和H2O6. NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图。下列说法正确的是( )
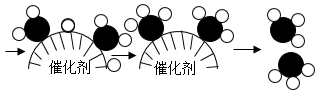 A、
A、 表示氢气分子
B、过程中有“NH”“NH2”原子团生成
C、参加反应的H2与生成的NH3个数比为2:3
D、反应前后各元素的化合价没有变化
7. 物质的性质决定物质的用途。下列因果关系不成立的是( )
表示氢气分子
B、过程中有“NH”“NH2”原子团生成
C、参加反应的H2与生成的NH3个数比为2:3
D、反应前后各元素的化合价没有变化
7. 物质的性质决定物质的用途。下列因果关系不成立的是( )
A、因为磷燃烧能产生白烟,所以可用于制作烟幕弹 B、因为金属钨的熔点高,所以被用来制造灯泡中的灯丝 C、因为石墨具有导电性,所以可用作电极 D、因为氧气能支持燃烧,所以可用作燃料8. 下列实验操作不正确的是( )
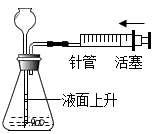


A.粗盐提纯时蒸发结晶
B.检查装置气密性
C.收集氧气
D.收集二氧化碳并验满
A、A B、B C、C D、D9. 古语道:“人要实,火要虚”。意思是做人必须脚踏实地,事业才能有成:燃烧固体燃料需要架空,燃烧才能更旺。从燃烧的条件看,“火要虚”的实质是( )A、增加可燃物 B、提高空气中氧气的含量 C、提高可燃物的着火点 D、增大可燃物与空气的接触面积10. 用以下装置进行CO还原CuO的实验。下列说法正确的是( ) A、实验时先点燃酒精灯,再挤压CO气囊 B、实验中乙、丙的现象分别是红色物质逐渐变黑,澄清石灰水逐渐变浑浊 C、丁的作用是收集尾气,防止CO污染空气 D、实验结束后直接将热的Cu倒出,对实验无影响11. 下列实验内容中的横、纵坐标表示的量符合如图所示趋势是( )
A、实验时先点燃酒精灯,再挤压CO气囊 B、实验中乙、丙的现象分别是红色物质逐渐变黑,澄清石灰水逐渐变浑浊 C、丁的作用是收集尾气,防止CO污染空气 D、实验结束后直接将热的Cu倒出,对实验无影响11. 下列实验内容中的横、纵坐标表示的量符合如图所示趋势是( )
序号
实验内容
横坐标表示的量
纵坐标表示的量
A
向铜、锌混合物粉末中加入盐酸
盐酸的质量
粉末的质量
B
NaOH溶液的稀释
水的质量
溶质的质量分数
C
用稀盐酸除铁锈
稀盐酸的质量
铁锈的质量
D
向Mg(OH)2固体中加入稀硫酸
稀硫酸的质量
固体的质量
A、A B、B C、C D、D12. 三种固体物质a、b、c的溶解度曲线如图所示。下列说法不正确的是( )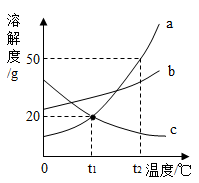 A、t2℃时,将三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数大小为b>a>c B、t2℃时,将30ga物质加入到50g水中充分溶解,所得溶液中溶质的质量分数为37.5% C、t2℃时,三种物质的饱和溶液中溶质的质量分数大小为a>b>c D、a中混有少量b时,可采取降温结晶的方法提纯得到a13. 除去下列物质中少量杂质(括号内为杂质),所用试剂及操作方法均正确的是( )A、KCl():加入适量MnO2 , 加热至不再产生气体 B、CaO(CaCO3):加水溶解、过滤 C、Na2SO4溶液(NaHCO3):加稀盐酸至不再产生气泡为止 D、FeCl2溶液(CuCl2):加过量的铁粉、搅拌、过滤14. 下列实验目的、操作、现象、结论均正确的是( )
A、t2℃时,将三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数大小为b>a>c B、t2℃时,将30ga物质加入到50g水中充分溶解,所得溶液中溶质的质量分数为37.5% C、t2℃时,三种物质的饱和溶液中溶质的质量分数大小为a>b>c D、a中混有少量b时,可采取降温结晶的方法提纯得到a13. 除去下列物质中少量杂质(括号内为杂质),所用试剂及操作方法均正确的是( )A、KCl():加入适量MnO2 , 加热至不再产生气体 B、CaO(CaCO3):加水溶解、过滤 C、Na2SO4溶液(NaHCO3):加稀盐酸至不再产生气泡为止 D、FeCl2溶液(CuCl2):加过量的铁粉、搅拌、过滤14. 下列实验目的、操作、现象、结论均正确的是( )选项
实验目的
实验操作
实验现象
实验结论
A
研究温度对分子运动速率的影响

烧杯①中品红扩散速率比烧杯②中品红快
温度越低,分子运动速率越快
B
鉴别NaCl和NH4NO3固体
分别取等量的a、b固体样品放入盛有等量蒸馏水的小烧林中,搅拌,测量溶解前后液体温度
加a的烧杯液体温度降低,加b的烧杯液体温度升高
a是NH4NO3 , b是NaCl
C
验证硝酸钾溶液的导电性

灯泡发亮
硝酸钾溶液中存在自由移动的离子,溶液能导电
D
探究金属M生锈的条件
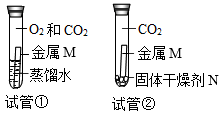
试管①中金属M生锈,试管②中金属M不生锈
金属M生锈需要氧气和水
A、A B、B C、C D、D二、科普阅读题
-
15. 阅读短文并回答问题。
北京冬奥火炬“飞扬”在奥运火炬接力史上首次大规模使用氢燃料,凸显绿色办奥运的理念。按照制取过程及碳排放量的不同,制得的氢气可以分为“灰氢”“蓝氢”和“绿氢”。“灰氢”指采用化石燃料制取的氢气,石油、天然气、煤炭制氢等,制氢过程中有大量的碳排放。“蓝氢”指采用化石燃料制取,但过程中采用了碳捕捉及封存技术的氢气。“绿氢”指采用可再生能源(如风电、水电、太阳能等),通过电解制氢,制氢过程完全没有碳排放:
 (1)、写出火炬中燃料燃烧的化学方程式:。(2)、化石燃料属于(填“可再生”或“不可再生”)能源,过量碳排放会导致的环境问题是。(3)、我国科学家研发的循环制氢和贮存氢气的新工艺如下图所示。
(1)、写出火炬中燃料燃烧的化学方程式:。(2)、化石燃料属于(填“可再生”或“不可再生”)能源,过量碳排放会导致的环境问题是。(3)、我国科学家研发的循环制氢和贮存氢气的新工艺如下图所示。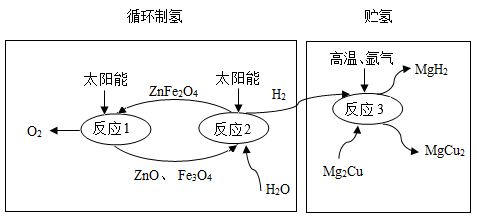
①与传统电解法制取氢气相比,该工艺的优点是。
②ZnFe2O4中铁元素的化合价为 , 其物质分类属于(填字丹)。
A.混合物 B.化合物 C.氧化物 D.碱 E.盐
③反应1的基本反应类型是 , “循环制氢”中需要不断补充加入的物质是。“贮氢”中通入氩气作为保护气,体现氩气的性质为。
三、综合题
-
16. 二氧化碳的制取与性质是初中化学实验的重要内容。
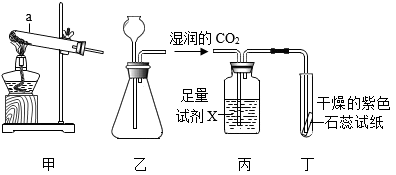 (1)、仪器a的名称是。(2)、实验室用石灰石与稀盐酸反应制取CO2的化学方程式为 , 选择的发生装置是(填“甲”或“乙”)。(3)、若试剂X是水,丁中能观察到紫色石蕊试纸变红,若丁中紫色石蕊试纸没有变红,则试剂X可能是____(填字母)。A、浓硫酸 B、稀盐酸 C、NaOH溶液 D、NaCl溶液(4)、为探究不同形状的碳酸钙和稀盐酸反应的速率,某同学改进了实验装置。该同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,利用传感器技术测得瓶内气压随时间的变化如下图所示。
(1)、仪器a的名称是。(2)、实验室用石灰石与稀盐酸反应制取CO2的化学方程式为 , 选择的发生装置是(填“甲”或“乙”)。(3)、若试剂X是水,丁中能观察到紫色石蕊试纸变红,若丁中紫色石蕊试纸没有变红,则试剂X可能是____(填字母)。A、浓硫酸 B、稀盐酸 C、NaOH溶液 D、NaCl溶液(4)、为探究不同形状的碳酸钙和稀盐酸反应的速率,某同学改进了实验装置。该同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,利用传感器技术测得瓶内气压随时间的变化如下图所示。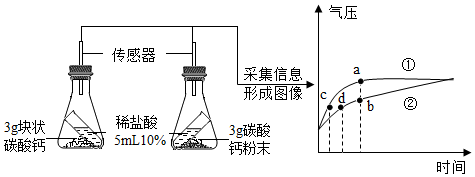
下列说法正确的是____(填字母)。
A、对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸的反应 B、对比分析c、d点可知,达到相同气压时,碳酸钙粉末与稀盐酸反应所需的时间更短 C、反应后期,反应速率逐渐减慢的主要原因是盐酸的浓度降低 D、碳酸钙粉末与稀盐酸反应产生的二氧化碳更多(5)、将100g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为g。17. 金属材料的应用推动了社会发展。(1)、I.被誉为“中国天眼”的FAST是目前世界上最大口径、最灵敏的射电望远镜,支撑它的角钢塔架中含有铁、铜、锰(Mn),现探究三种金属的活动性强弱。【猜想】
猜想1:Mn>Fe>Cu;猜想2:Fe>Cu>Mn;猜想3:。猜想4:Cu>Fe>Mn:猜想5:Cu>Mn>Fe:猜想6:Mn>Cu>Fe。
(2)、【实验】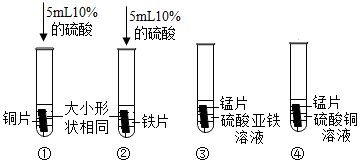
实验过程中发现只有实验①无明显现象。由此可得出猜想(填序号)是正确的。
(3)、实验③反应的化学方程式为(生成物中锰元素显+2价)。(4)、通过实验现象及分析发现,不需要进行实验(选填写①②③④)就能够得出结论。(5)、【拓展】已知金属锰和铁有相似的化学性质,能溶于稀酸,生成含有+2价金属离子的化合物。现将由5.5g金属锰、5.6g金属铁、6.4g金属铜组成的混合物放入一定量的稀硫酸中,充分反应后过滤得到固体12g,同时产生氢气的质量为g。
(6)、Ⅱ.实验室用金属铁制备新型多功能水处理剂高铁酸钾(K2FeO4)的流程如下:
固体B中含有的物质是。
(7)、反应③中沉淀D与H2O2发生化合反应,反应的化学方程式为。四、科学探究题
-
18. 水和溶液在生产生活中应用广泛。(1)、Ⅰ.硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水,对水的硬度、肥皂水的用量与产生泡沫量的关系进行实验探究。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙、镁化合物。
【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不同硬度的硬水。用蒸馏水和两种硬水完成三组实验,记录如下:
组别
第1组
第2组
第3组
实验操作


实验序号
①
②
③
④
⑤
⑥
⑦
⑧
⑨
混合溶液用量/滴
0
0
0
1
x
1
2
2
2
肥皂水用量/滴
5
10
20
5
10
20
5
10
20
产生泡沫量
少
多
很多
无
少
多
无
无
少
【解释与结论】
对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是。
(2)、设计第2组实验时,为控制水的硬度相同,⑤中x应为。(3)、第2组实验的目的是。(4)、由上述三组实验得到的结论是。(5)、Ⅱ.有一包白色粉末,可能是KCl、BaCl2、K2CO3、K2SO4、CuSO4中的一种或几种,为确定白色粉末的成分,进行如下探究:a.取适量白色粉末加入足量的水,搅拌,得到白色沉淀和无色溶液。
b.取a中的白色沉淀,加入过量的稀盐酸,白色沉淀不溶解。
写出产生白色沉淀的化学方程式:。
(6)、白色粉末中一定不含有的成分是。19. 农业上熟石灰可用于改良酸性土壤。某小组做了Ca(OH)2溶液和稀盐酸反应的相关实验探究,如下图所示。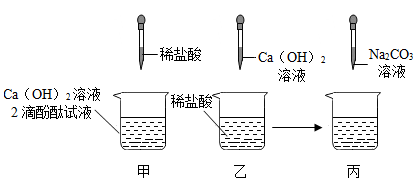
 (1)、甲中酸与碱反应的化学方程式为 , 若酸碱恰好完全中和,观察到的实验现象是。(2)、往乙反应结束后的溶液中滴加质量分数为26.5%的Na2CO3溶液(如丙),溶液pH的变化如图所示。ab段反应结束后,b点对应溶液中所含的溶质为(填化学式)。(3)、丙实验结束后,产生沉淀的质量为g。C点后pH逐渐增大的原因是。20. 疫情防控期间,含氯消毒剂功不可没。氯气(Cl2)是一种黄绿色气体,可用于制备含氯消毒剂。
(1)、甲中酸与碱反应的化学方程式为 , 若酸碱恰好完全中和,观察到的实验现象是。(2)、往乙反应结束后的溶液中滴加质量分数为26.5%的Na2CO3溶液(如丙),溶液pH的变化如图所示。ab段反应结束后,b点对应溶液中所含的溶质为(填化学式)。(3)、丙实验结束后,产生沉淀的质量为g。C点后pH逐渐增大的原因是。20. 疫情防控期间,含氯消毒剂功不可没。氯气(Cl2)是一种黄绿色气体,可用于制备含氯消毒剂。⑴实验室中常用加热二氧化锰和浓盐酸混合物的方法制取氯气: , 将反应时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求:不考虑空气、水)。
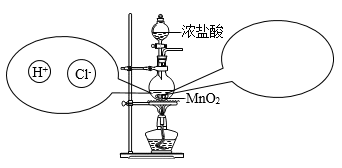
⑵氯气溶于水后得到的溶液称为氯水。氯气溶于水时,部分氯气会与水发生如下反应: 。氯水呈浅黄绿色,氯水含有多种溶质,因而具有多种性质。
已知:次氯酸(HClO)具有强氧化性,能够将有色物质(含酸碱指示剂)氧化为无色物质,但其酸性很弱,不能与碳酸盐反应。
请预测氯水的化学性质,说明预测的依据,并设计实验验证。
限选试剂:Na2SO4溶液、CaCO3固体、AgNO3溶液、紫色石蕊溶液、镁粉、铜片。
预测
预测的依据
验证预测的实验操作与预期现象
①能够与含Ag+的可溶性盐反应
氯水中含有Cl- , Cl-能与Ag+反应生成难溶的AgCl
取少量氯水于试管中,滴加AgNO3溶液,如果观察到 , 则预测成立。
②能够与(填物质类别)反应
取少量于试管中,滴加适量氯水,如果观察到 , 则预测成立
-