广东省广州市黄埔区2022年中考一模化学试题
试卷更新日期:2022-04-11 类型:中考模拟
一、单选题
-
1. 成语是中华民族智慧的结晶。下列成语所描述的变化涉及化学变化的是( )A、刻舟求剑 B、滴水成冰 C、百炼成钢 D、积沙成塔2. 幸福需要辛勤的劳动来创造。下列劳动项目与所涉及的化学知识不相符的是( )
选项
劳动项目
化学知识
A
用发酵粉培制糕点
NaHCO3能产生CO2
B
用布擦干淋湿的自行车
铁部件潮湿易生锈
C
用食醋清除水壶内壁的水垢
醋酸能与水垢反应
D
利用活性炭自制简易净水器
活性炭具有还原性
A、A B、B C、C D、D3. 下列是小刚“配制50g溶质质量分数为8%的氢氧化钠溶液”的实验过程,其中正确的是( )A、计算需要氢氧化钠4g,水46g B、将氢氧化钠放在托盘天平左盘的纸上称量 C、将称取的氢氧化钠放入量筒中溶解 D、将配制好的溶液转移一半后,小刚认为剩余溶液溶质质量分数为4%4. 今年两会上,“碳达峰”、“碳中和”被写入政府工作报告。政府承诺2030年前,CO2的排放达到峰值(即碳达峰)之后逐步降低,最终产生与消耗的CO2平衡,实现CO2的零排放(即碳中和)。下列做法不利于实现这一目标的是( )A、使用化石燃料 B、废气净化后再排放 C、植树造林 D、开发新能源5. 下列实验操作正确的是( )A、 实验室制取O2
B、
实验室制取O2
B、 收集O2
C、
收集O2
C、 制备O2后回收MnO2
D、
制备O2后回收MnO2
D、 称取5.2gNaCl固体
6. 航天员饮用的小分子团水与普通水相比,具有水溶性强、密度高、在人体内储留时间长、排放量少等特点。下列关于小分子团水的说法,正确的是( )A、小分子团水的化学性质与普通水不同 B、小分子团水中水分子间没有间隙 C、小分子团水的部分物理性质与普通水不同 D、小分子团水中水分子停止了运动7. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )
称取5.2gNaCl固体
6. 航天员饮用的小分子团水与普通水相比,具有水溶性强、密度高、在人体内储留时间长、排放量少等特点。下列关于小分子团水的说法,正确的是( )A、小分子团水的化学性质与普通水不同 B、小分子团水中水分子间没有间隙 C、小分子团水的部分物理性质与普通水不同 D、小分子团水中水分子停止了运动7. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )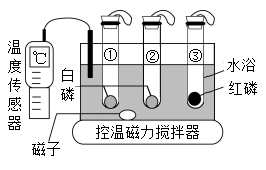 A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用8. 中国工程院院士袁隆平宣布了一项重大突破成果——水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )
A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用8. 中国工程院院士袁隆平宣布了一项重大突破成果——水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )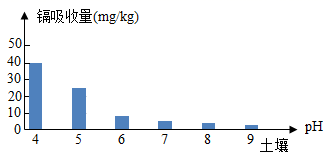 A、熟石灰 B、硫酸铜 C、稀盐酸 D、氯化钠9. 下列归纳和总结完全正确的一组是( )
A、熟石灰 B、硫酸铜 C、稀盐酸 D、氯化钠9. 下列归纳和总结完全正确的一组是( )A.化学史实
B.化学与安全
①拉瓦锡—测定空气组成
②门捷列夫—元素周期表
③张青莲—测定水的组成
①炒菜油锅着火可以用锅盖盖灭
②在室内放一盆水能防止煤气中毒
③夜间发现液化气泄漏应马上开灯寻找泄漏源
C.化学与技术
D.化学与资源
①用钛镍形状记忆合金制成人造卫星天线
②用扫描隧道显微镜获得苯分子图像
③用催化净化装置处理汽车尾气
①防止金属腐蚀是保护金属资源的途径之一
②可燃冰的泄露不会造成温室效应
④海洋中蕴藏着丰富的化学资源
A、A B、B C、C D、D10. 发芽的土豆中含有一种对人体有害的生物碱称龙葵碱,它对人体胃肠黏膜有刺激作用,并有溶血及麻痹呼吸中枢的作用。发芽土豆的芽眼芽根和变绿的部位含量更高,人吃了会有咽喉痒、恶心、呕吐、腹痛等症状,重者会死亡。龙葵碱的化学式为C45H73O15N,下列有关龙葵碱的说法正确的是( )A、龙葵碱中氧元素的质量分数为 B、龙葵碱中碳元素的质量分数最大 C、龙葵碱中碳元素与氧元素的质量比为3:1 D、龙葵碱由45个碳原子、73个氢原子、15个氧原子和1个氮原子构成11. 2021年3月,三星堆遗址出土了黄金面具残片。根据金原子的结构示意图和图中的信息,判断下列说法正确的是( )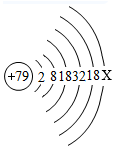
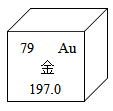 A、X的数值是8 B、金原子的核外电子数是118 C、金原子的质子数是79 D、金的相对原子质量是197.0g12. 科学家发现,可以将树木纤维素转变成超级储能装置。下图是该反应的微观示意图,下列说法不正确的是( )
A、X的数值是8 B、金原子的核外电子数是118 C、金原子的质子数是79 D、金的相对原子质量是197.0g12. 科学家发现,可以将树木纤维素转变成超级储能装置。下图是该反应的微观示意图,下列说法不正确的是( ) A、该反应属于置换反应 B、反应生成的Z、W两种物质的分子个数比为1:1 C、该反应前后原子的种类、数目均保持不变 D、参加反应的X、Y的质量总和等于生成的Z、W的质量总和13. “侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3=NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( )
A、该反应属于置换反应 B、反应生成的Z、W两种物质的分子个数比为1:1 C、该反应前后原子的种类、数目均保持不变 D、参加反应的X、Y的质量总和等于生成的Z、W的质量总和13. “侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3=NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( ) A、0℃时,NH4Cl的溶解度大于NaCl的溶解度 B、20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数 C、20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出 D、NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl14. 如图进行下列实验(U型管内为植物油,初始液面相平,装置气密性良好:滴加的液体适量且等体积,试管中固体等质量且表面积相同),U型管内现象描述不正确的是( )
A、0℃时,NH4Cl的溶解度大于NaCl的溶解度 B、20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数 C、20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出 D、NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl14. 如图进行下列实验(U型管内为植物油,初始液面相平,装置气密性良好:滴加的液体适量且等体积,试管中固体等质量且表面积相同),U型管内现象描述不正确的是( )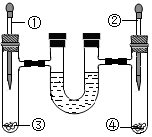
选项
药品①和药品③
药品②和药品④
最终现象
A
食盐水和铁丝
蒸馏水和铁丝
左低右高
B
10%稀硫酸和锌片(足量)
10%稀硫酸和镁带(足量)
左右相平
C
6%双氧水和MnO2固体
6%双氧水(不添加药品④)
左右相平
D
10%稀盐酸和NaCl粉末
10%稀盐酸和石灰石
左高右低
A、A B、B C、C D、D二、填空题
-
15. 能源和环境问题日益成为人们关注的焦点。(1)、化石燃料包括煤、和天然气等,过度使用既造成能源危机,又导致环境污染,如燃煤会影响环境,下列环境问题与燃煤有直接关系的是(填字母序号)。
A.酸雨 B.温室效应 C.可吸入颗粒物
(2)、乙醇(C2H5OH)是一种能溶于汽油的液体。我国推广使用乙醇汽油为车用燃料。制取乙醇的方法是:先将淀粉水解生成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下再转化为乙醇和二氧化碳。根据上述信息分析,回答下列问题:①乙醇汽油属于(选填“纯净物”或“混合物”)。
②由葡萄糖制取乙醇是发展绿色新能源的重要方法,葡萄糖在酶的催化作用下分解为乙醇和二氧化碳的化学方程式为。
(3)、目前,我国面临能源消费结构不合理,区域分布不均衡,利用率不高等问题,下图是我国目前与十二五计划能源结构变化的对比图,从图中可以看出,主要调整是。 16. 纯净的金属锰是一种灰白色、硬脆、有光泽、比铁稍软的金属,和铁的化学性质相似。(1)、锰的化合价有+2、+3、+4、+5、+6和+7,下图表示元素的化合价与物质类别关系,将含锰物质各举一例填入下图(写化学式)。
16. 纯净的金属锰是一种灰白色、硬脆、有光泽、比铁稍软的金属,和铁的化学性质相似。(1)、锰的化合价有+2、+3、+4、+5、+6和+7,下图表示元素的化合价与物质类别关系,将含锰物质各举一例填入下图(写化学式)。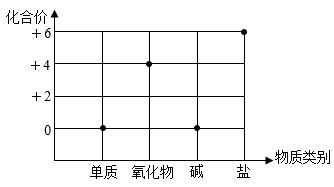
单质 氧化物 碱
(2)、根据金属化学性质的一般规律,下列预测合理的是____(填标号)。A、锰能与稀盐酸反应,并有氢气放出 B、在空气中能氧化 C、锰能与氢氧化钠反应 D、硫酸锰(锰为+2价)可以与镁反应(3)、已知硫酸锰(锰为+2价)常用作微量分析试剂、媒染剂和油漆干燥剂,溶于水,设计三种制备硫酸锰的方案(要求含锰原料分别属于不同的物质类别)。完成下表:方案
预期反应的化学方程式
①
②
③
三、综合题
-
17. 下图所示是Ca(OH)2的部分性质实验,回答有关问题。
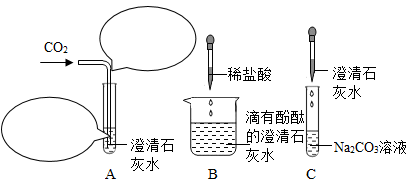 (1)、Ca(OH)2俗称 , 用途是。(2)、将A反应前导管内物质和试管内溶液中一定存在的微观粒子的种类在A图中画出(粒子数目不做要求,不考虑空气、水)。(3)、B中发生反应的化学方程式为;C中的实验现象是。(4)、将这三个实验反应后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀,且无气泡。取少量上层溶液与足量稀盐酸混合,无明显现象。综合分析可知:上层溶液中一定含有的溶质是酚酞和 , 可能含有的溶质是。18. CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。利用NaOH溶液来“捕捉”CO2 , 并将CO2储存或利用,流程如下图(部分条件及物质未标出)。
(1)、Ca(OH)2俗称 , 用途是。(2)、将A反应前导管内物质和试管内溶液中一定存在的微观粒子的种类在A图中画出(粒子数目不做要求,不考虑空气、水)。(3)、B中发生反应的化学方程式为;C中的实验现象是。(4)、将这三个实验反应后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀,且无气泡。取少量上层溶液与足量稀盐酸混合,无明显现象。综合分析可知:上层溶液中一定含有的溶质是酚酞和 , 可能含有的溶质是。18. CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。利用NaOH溶液来“捕捉”CO2 , 并将CO2储存或利用,流程如下图(部分条件及物质未标出)。 (1)、转化室中发生反应的化学方程式为;。(2)、下列有关该过程的叙述正确的是。
(1)、转化室中发生反应的化学方程式为;。(2)、下列有关该过程的叙述正确的是。A.该过程可实现CO2零排放 B.该过程只有1种物质可以循环利用
C.将X物质分离出来的操作是过滤 D.该过程至少发生了4个化学反应
(3)、利用Na2CO3或K2CO3溶液吸收低浓度的CO2 , 将其转化为NaHCO3或KHCO3 , NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。吸收剂
Na2CO3
K2CO3
20℃最高浓度(g/L)
212
1104
价格(元/Kg)
1.25
9.80
根据表中信息,选择K2CO3溶液作吸收液的优点是。
(4)、将CO2作为资源是实现碳中和的有效方法。以CO2和H2为原料,在一定条件可以合成C2H6O和O2 , 参加反应的CO2和H2的质量比为。19. 某兴趣小组对氧气制备进行了如下实验探究: (1)、请写出仪器a的名称;检查B装置气密性的方法是。(2)、从“节约能源”角度分析,实验室制取氧气最佳的方法是(用化学方程式表示),若用E装置收集氧气,当开始收集。(3)、“氧立得”是家庭供氧气的最新产品,它是利用过氧化钠(化学式为:Na2O2)固体压片和水在常温下反应生成氢氧化钠和氧气的原理制成的。若实验室用过氧化钠固体压片制取氧气,可采用的发生装置是。(填编号)(4)、双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂。
(1)、请写出仪器a的名称;检查B装置气密性的方法是。(2)、从“节约能源”角度分析,实验室制取氧气最佳的方法是(用化学方程式表示),若用E装置收集氧气,当开始收集。(3)、“氧立得”是家庭供氧气的最新产品,它是利用过氧化钠(化学式为:Na2O2)固体压片和水在常温下反应生成氢氧化钠和氧气的原理制成的。若实验室用过氧化钠固体压片制取氧气,可采用的发生装置是。(填编号)(4)、双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂。【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
实验序号
KClO3质量
其他物质质量
待测数据
①
1.2g
/
②
1.2g
CuO 0.5g
③
1.2g
MnO2 0.5g
①上述实验应测量的“待测数据”是。
②若实验②比实验①的“待测数据”更(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
③将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,再将黑色粉末放入试管中,。(简述操作和现象)
(5)、【预期结论】氧化铜也能作氯酸钾的催化剂。【评价设计】你认为设计实验③和实验②对比的目的是。
20. K3【Fe(C2O4)3】3H2O(三草酸合铁酸钾)为亮绿色晶体。实验小组在老师的指导下探究K3【Fe(C2O4)3】3H2O的热分解产物。【查阅资料】①碱石灰可用于吸收CO2、水蒸气;
②含有Fe2+的盐溶液可与K3[Fe(CN)6]发生反应产生蓝色沉淀;
③含有Fe3+的盐溶液可与KSCN发生反应生成红色溶液。
【提出问题】样品完全分解后,除水蒸气外还生成哪些产物?
【实验探究】
(1)、探究气体产物:猜想一:气体产物中含有CO:猜想二:气体产物中含有CO2:
猜想三:气体产物中含有。

设计如上图实验(夹持装置及部分装置省略,实验中观察到装置B中澄清石灰水变浑浊,装置D中的固体变为红色。由此判断猜想正确。
(2)、探究固体产物:取固体产物(经实验证明无磁性)于试管中,加水充分溶解、过滤,再进行如表实验:
实验
现象
结论
取滤液加入硫酸
固体产物中含有K2CO3
取滤渣加入硫酸溶解后,分成两份
一份中加入K3[Fe(CN)6]
固体产物中含有FeO
另一份中加入KSCN
溶液变为红色
固体产物中含有
(3)、【实验结论】K3【Fe(C2O4)3】·3H2O的热分解产物有种。(4)、【拓展延伸】晒制蓝图时,用K3【Fe(C2O4)3】·3H2O作感光剂,其光解反应有FeC2O4生成。FeC2O4在一定条件下分解可以得到一种具有磁性的黑色固体和两种含有相同元素的气体,请写出对应的化学方程式。