2022年浙教版科学八下复习阶梯训练:微粒的模型与符号 (优生加练)
试卷更新日期:2022-04-09 类型:复习试卷
一、单选题
-
1. 若一个SO2分子的质量为n千克,一个SO3分子的质量为m千克,若以一个硫原子质量的 作为标准,则SO2的相对分子质量为( )A、 B、 C、 D、2. 某物质R是人类生命活动中不可缺少的物质,已知R的相对分子质量为150,其中含碳元素40%,含氢元素6.7%,其余为氧元素。则R的化学式为( )A、C5H10O2 B、C5H10O5 C、C6H6O D、C6H12O63. 某元素氧化物的相对分子质量为a,价态相同的硫酸盐相对分子质量为b,则此元素的化合价可能是( )A、 B、 C、 D、4. 碱性蓄电池具有体积小、机械强度高、工作电压平稳、能大电流放电、使用寿命长和易于携带等特点。其主要成分就是KOH,现在有一份在空气中暴露过的KOH样品,经分析测知其含水量为7.62%,含有K2CO32.38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发后固体质量约为( )A、3.4g B、4.1g C、4.5g D、无法计算5. 将 Fe3O4、Fe2O3、CuO的固体混合粉末mg,在加热条件下用足量CO还原得到金属混合物2.32g,将生成的CO2气体用足量澄清石灰水吸收后,产生5.00g白色沉淀,则m的数值为( )A、5.32 B、3.12 C、3.59 D、2.376. 一定条件下,在一密闭容器内发生某化学反应,并测得反应前后各物质的质量如图所示。下列说法正确的是( )
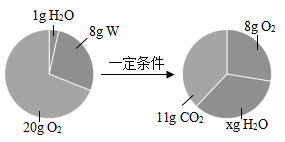 A、x的值为9 B、该反应中氧气与水的质量变化之比为6:5 C、W由碳、氢两种元素组成 D、W中碳、氢元素质量比为3:17. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、8. 由Na2SO4和CaSO4组成的混合物中,测知氧元素的质量分数为46%.若再计算混合物中的下列各项:①硫元素的质量分数 ②钠元素的质量分数 ③CaSO4的质量分数 ④Na2SO4和CaSO4的质量比 ⑤CaSO4的质量,以下判断正确的是( )A、都能确定 B、都不能确定 C、只有①能确定 D、只有⑤不能确定9. 目前农村正在推广“测土配方施肥”技术,农技员对某土地检测后给出了施肥配方,该土壤施加NH4NO3 , K2CO3;若测定该混合化肥中氮元素的质量分数为28%,则固体混合物中K2CO3的质量分数为( )A、85% B、20% C、25% D、80%10. 小智和小临在校实验室发现一锥形瓶内盛有盐酸和氯化铜的混合溶液100克,他们向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。他们展开讨论正确的是( )
A、x的值为9 B、该反应中氧气与水的质量变化之比为6:5 C、W由碳、氢两种元素组成 D、W中碳、氢元素质量比为3:17. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、8. 由Na2SO4和CaSO4组成的混合物中,测知氧元素的质量分数为46%.若再计算混合物中的下列各项:①硫元素的质量分数 ②钠元素的质量分数 ③CaSO4的质量分数 ④Na2SO4和CaSO4的质量比 ⑤CaSO4的质量,以下判断正确的是( )A、都能确定 B、都不能确定 C、只有①能确定 D、只有⑤不能确定9. 目前农村正在推广“测土配方施肥”技术,农技员对某土地检测后给出了施肥配方,该土壤施加NH4NO3 , K2CO3;若测定该混合化肥中氮元素的质量分数为28%,则固体混合物中K2CO3的质量分数为( )A、85% B、20% C、25% D、80%10. 小智和小临在校实验室发现一锥形瓶内盛有盐酸和氯化铜的混合溶液100克,他们向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。他们展开讨论正确的是( )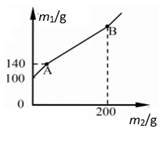 A、反应至A点时,所加NaOH溶液的质量为60克 B、反应至B点时,锥形瓶内溶液中NaCl的质量为29.25克 C、反应至B点时,锥形瓶内溶液的质量为300克 D、反应至A点时,锥形瓶内溶液中NaCl的质量为11.7克11. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算12. 模型可以帮助人们认识一些不能直接观察到的事物。如图是某化学反应的过程示意图。分析该图,下列判断正确的是( )
A、反应至A点时,所加NaOH溶液的质量为60克 B、反应至B点时,锥形瓶内溶液中NaCl的质量为29.25克 C、反应至B点时,锥形瓶内溶液的质量为300克 D、反应至A点时,锥形瓶内溶液中NaCl的质量为11.7克11. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算12. 模型可以帮助人们认识一些不能直接观察到的事物。如图是某化学反应的过程示意图。分析该图,下列判断正确的是( )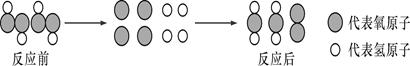 A、该反应是分解反应 B、该反应没有单质生成 C、反应前后元素化合价没有发生变化 D、该化学反应为2H2O2=H2O+O213. 某添加剂X可由尿素CO(NH2)2在高温、高压下分解制得.已知6g尿素在高温、高压下分解只生成1.7gNH3、2.2gCO2和X。对x组成判断正确的是( )A、x 组成元素与尿素完全相同 B、X 组成元素无法判断 C、X 由碳、氢、氧三种元素组成 D、X 由碳、氢、氮三种元素组成14. 下列说法中正确的是( )A、有足量的 Fe、S、C、H2 四种物质,分别在氧气中完全燃烧,若消耗等质量的氧气, 则消耗质量最少的是 Fe B、在 CO、CO2、N2 中碳元素的质量分数是 24%,则 N2 的质量分数可能是 11% C、在某种氮的氧化物中,若氮元素与氧元素的质量比为 7:4,该氧化物的化学式为NO D、一氧化碳和二氧化碳组成的混合气体中,碳、氧原子的个数比可能是 2:315. 某同学学了元素和物质的知识后,进行梳理,其中不正确的是( )A、铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS B、钙的化合物相对分子质量由大到小:CaCO3>CaCl2>Ca(OH)2 C、地壳中元素的含量由高到低:O> Si> Al D、锰元素的化合价由高到低:KMnO4>K2MnO4 >MnO216. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )A、1-1.75a% B、1.75a% C、1.25a% D、无法计算
A、该反应是分解反应 B、该反应没有单质生成 C、反应前后元素化合价没有发生变化 D、该化学反应为2H2O2=H2O+O213. 某添加剂X可由尿素CO(NH2)2在高温、高压下分解制得.已知6g尿素在高温、高压下分解只生成1.7gNH3、2.2gCO2和X。对x组成判断正确的是( )A、x 组成元素与尿素完全相同 B、X 组成元素无法判断 C、X 由碳、氢、氧三种元素组成 D、X 由碳、氢、氮三种元素组成14. 下列说法中正确的是( )A、有足量的 Fe、S、C、H2 四种物质,分别在氧气中完全燃烧,若消耗等质量的氧气, 则消耗质量最少的是 Fe B、在 CO、CO2、N2 中碳元素的质量分数是 24%,则 N2 的质量分数可能是 11% C、在某种氮的氧化物中,若氮元素与氧元素的质量比为 7:4,该氧化物的化学式为NO D、一氧化碳和二氧化碳组成的混合气体中,碳、氧原子的个数比可能是 2:315. 某同学学了元素和物质的知识后,进行梳理,其中不正确的是( )A、铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS B、钙的化合物相对分子质量由大到小:CaCO3>CaCl2>Ca(OH)2 C、地壳中元素的含量由高到低:O> Si> Al D、锰元素的化合价由高到低:KMnO4>K2MnO4 >MnO216. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )A、1-1.75a% B、1.75a% C、1.25a% D、无法计算二、填空题
-
17. 某化合物的化学式为HnRO2n+1 , 其相对分子质量为A,则R的相对原子质量为。R元素的化合价为 , 原子团RO2n+1的化合价为。当R的化合价不变时,其与氧元素组成的化合物的化学式为 ,相对分子质量是。18. 能源与环境已成为人们日益关注的问题。(1)、目前人们利用最多的能源是煤、和天然气等化石燃料。(2)、分别充分燃烧1 000 g天然气和煤所产生的CO2和SO2气体的质量如图所示,根据图示分析,下列说法中正确的是 (填字母)。
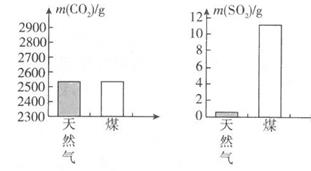 A、煤燃烧产生的气体更易导致酸雨 B、该天然气中不含硫元素 C、煤燃烧对环境影响较小 D、煤和天然气的燃烧都有温室气体产生(3)、A物质常被用作奥运火炬燃料,纯净物A在B物质中充分燃烧,发生反应:A+5B 3C+4D(部分微观示意图如表所示)。
A、煤燃烧产生的气体更易导致酸雨 B、该天然气中不含硫元素 C、煤燃烧对环境影响较小 D、煤和天然气的燃烧都有温室气体产生(3)、A物质常被用作奥运火炬燃料,纯净物A在B物质中充分燃烧,发生反应:A+5B 3C+4D(部分微观示意图如表所示)。物质
A
B
C
D
分子示意图
?


A物质中碳、氢元素的质量比为。
19.(1)、某三价金属与氧元素形成的化合物中氧元素的质量分数为30%,则该金属的相对原子质量为。(2)、A、B两元素相对原子质量之比为2:1,仅由这两种元素组成的化合物中,A、B两元素质量比为2:3,则该化合物的化学式为;若其中B的化合价为-n,则此化合物中A元素的化合价为。(3)、元素R可与氧形成多种化合物,其中RO中含氧53.33%。那么相对分子质量为76,含氧量为63.16%的R与氧元素形成的化合物的化学式是。20. 易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应),为了测定易拉罐铝镁合金中两种元素的质量比,小科开展了如图甲的实验,实验中生成沉淀的质量与滴入氢氧化钠溶液的质量的关系如图乙所示。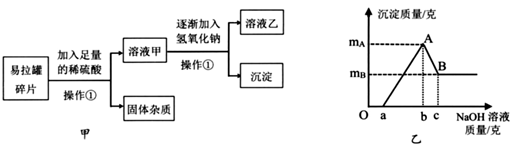
资料:氢氧化铝是一种白色沉淀,可与氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化镁不与氢氧化钠反应。
(1)、从图可知,当滴入氢氧化钠溶液克时,溶液乙中有且只有一种溶质(填化学式)。(2)、根据实验数据,该易拉罐中铝元素和镁元素的质量比为(用mA和mB表示)21. 易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应),为了测定易拉罐铝镁合金中两种元素的质量比,小科开展了如图甲的实验,实验中生成沉淀的质量与滴入氢氧化钠溶液的质量的关系如图乙所示。资料:氢氧化铝是一种白色沉淀,可与氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化镁不与氢氧化钠反应。
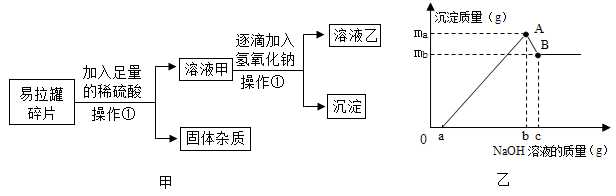 (1)、操作①表示的物质分离方法是。(2)、当滴入氢氧化钠溶液为cg时,充分反应后,溶液乙中的溶质为(填化学式)。(3)、根据实验数据,该易拉罐中铝元素和镁元素的质量比为(用mA和mB表示)。22. 下列分别盛有不同物质的容器中,所盛物质属于单质的是 , 属于混合物的是 , 属于化合物的是(均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 , CO2和CO的质量比为。D瓶中保持冰化学性质的最小粒子是(填化学式)。
(1)、操作①表示的物质分离方法是。(2)、当滴入氢氧化钠溶液为cg时,充分反应后,溶液乙中的溶质为(填化学式)。(3)、根据实验数据,该易拉罐中铝元素和镁元素的质量比为(用mA和mB表示)。22. 下列分别盛有不同物质的容器中,所盛物质属于单质的是 , 属于混合物的是 , 属于化合物的是(均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 , CO2和CO的质量比为。D瓶中保持冰化学性质的最小粒子是(填化学式)。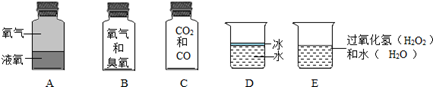 23. 回答下列问题。(1)、下表是元素周期表的一部分,请回答有关问题:
23. 回答下列问题。(1)、下表是元素周期表的一部分,请回答有关问题: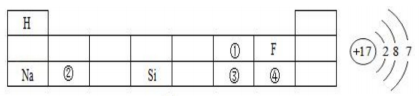
右图表示左表中(填表中序号)的原子结构示意图;得电子后形成的离子符号为;①处元素和②处元素形成常见化合物的化学式为;
(2)、X、Y两种元素的相对原子质量之比为7∶2,X与Y形成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为。若X、Y两种元素的相对原子质量之比为2∶1,由这两种元素形成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a。则在该化合物中Y的化合价为。24.(1)、X、Y两种元素组成的化合物甲和乙,甲的化学式为X2Y3 , 其中Y元素的质量分数为50%,乙中X元素的质量分数为60%,则乙的化学式为;(2)、元素X的原子失去1个电子,元素Y的原子得到2个电子后,所形成的离子所带电子数均与氖原子相同,由X、Y两元素的离子形成的化合物的相对分子质量为;(3)、相同质量的H2O2和D2O(D即2H)中氢元素的质量比为。(4)、某样品可能由铁、氧化亚铁、氧化铁和四氧化三铁中的一种或几种组成,现测得该样品中铁元素与氧元素的质量比是21:8;若该样品由两种物质混合而成,则一定不含;若该样品由三种物质混合而成,则一定含有。25. 赤铁矿的主要成分为Fe2O3 , 可用于冶炼铁.某赤铁矿,其中Fe2O3的质量分数为64%,该赤铁矿中铁元素的质量分数是(保留到小数点后面一位)。若以杂质含量为42%的磁铁矿(主要成分四氧化三铁,杂质不含铁元素)为原料代替该赤铁矿炼铁,若要得到相同质量的铁,则磁铁矿与赤铁矿的质量比为。参考答案:44.8%;16:15
26. 已知:2 .3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2 .7g水,则根据质量守恒定律,参加反应的氧气的质量为 , 该物质中一定含有元素(填元素符号),C、H元素的质量比为 。三、实验探究题
-
27. 某气体可能含有H2、CO中的一种或两种。小明为检验该气体的组成并用该气体测量某氧化铜样品(含少量铜)中CuO的质量分数,进行了如图所示实验(夹持装置已略去)。
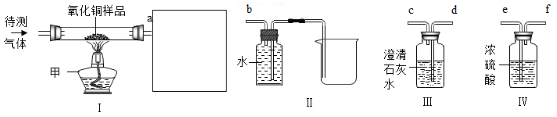 (1)、实验时先通气后加热原因是。(2)、虚框内有下列装置,导管的正确连接顺序是a (填序号)。
(1)、实验时先通气后加热原因是。(2)、虚框内有下列装置,导管的正确连接顺序是a (填序号)。实验前,先依次称量氧化铜样品和装置Ⅳ的质量,分别记为m1和m2。待CuO样品完全反应后,冷却,再依次称量硬质玻璃管中剩余固体和装置Ⅳ的质量,分别记为m3和m4。
(3)、能判断原气体中只含有CO的依据是。(4)、样品中氧化铜的质量分数为。28. 2020年1月25日总建筑面积为3.39万平方米的火神山医院正式开工,火神山医院在建造过程中用到了HDPE膜。老师告诉同学们HDPE膜具有极好的抗冲击性和防潮性,听完老师的描述后,同学们对HDPE膜的组成元素产生了浓厚的兴趣,进行了如下探究:【提出问题】HDPE膜由什么元素组成?
【査阅资料】①HDPE膜能够燃烧,燃烧生成水和碳的氧化物:
②碱石灰主要成分是氢氧化钠固体和氧化钙固体
【实验探究】如图所示,先通入干燥氮气,再将4.2g的HDPE膜样品在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D(装置中每步反应均进行完全)。
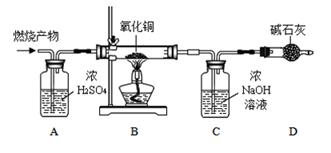
装置质量
A装置总质量
装置总质量
实验前
100.0g
100.0g
实验后
105.4g
113.2g
【实验现象及分析】
(1)、装置D中碱石灰的作用是。(2)、实验现象:观察到装置B中黑色粉末变成红色,证明燃烧产物中有。(3)、【数据处理】见上图【实验结论】HDPE膜仅有C和H两者中元素组成,理由是(用数据分析):。
(4)、【反思拓展】实验中的4.2 g HDPE膜样品燃烧消耗的氧气质量为m,则m的取值范围为。29. 下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧气氧化硬质玻璃管内样品,根据氧化产物的质量确定有机物的组成(在装置中C里的氧化铜是确保有机物中的碳元素完全转化为二氧化碳).请回答有关问题: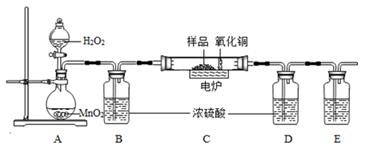 (1)、写出A装置中发生反应的化学方程式 .(2)、若去掉B装置会对元素的测定结果有影响。(3)、若准确称取1.12克样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44克,E装置增重3.52克,则该有机物样品中所含的元素为 .30. 只含铜和氧两种元素的固体样品18g,测得铜元素的质量为16g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:(1)、该样品的组成情况有。(写出所有可能的组成);(2)、若固体样品由两种物质组成,则质量偏少的那种物质在样品中的质量分数为。(用分数表示)31. 小金利用如图所示装置进行碳及其氧化物的性质实验,并测定赤铁矿(主要成分为Fe2O3 , 杂质不参与反应)中Fe2O3的含量,其中丁装置需要补全。回答问题:
(1)、写出A装置中发生反应的化学方程式 .(2)、若去掉B装置会对元素的测定结果有影响。(3)、若准确称取1.12克样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44克,E装置增重3.52克,则该有机物样品中所含的元素为 .30. 只含铜和氧两种元素的固体样品18g,测得铜元素的质量为16g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:(1)、该样品的组成情况有。(写出所有可能的组成);(2)、若固体样品由两种物质组成,则质量偏少的那种物质在样品中的质量分数为。(用分数表示)31. 小金利用如图所示装置进行碳及其氧化物的性质实验,并测定赤铁矿(主要成分为Fe2O3 , 杂质不参与反应)中Fe2O3的含量,其中丁装置需要补全。回答问题:
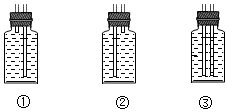
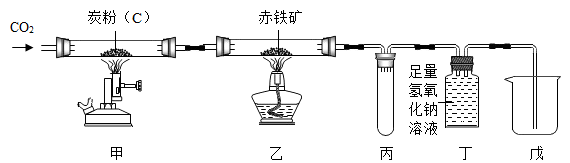 (1)、该实验可通过丁装置吸收二氧化碳,并将未参与反应的CO气体收集起来以避免污染环境,若要达到此目的,应将丁装置的导管补全为(选填序号)。
(1)、该实验可通过丁装置吸收二氧化碳,并将未参与反应的CO气体收集起来以避免污染环境,若要达到此目的,应将丁装置的导管补全为(选填序号)。
 (2)、在实验中,应先点燃(选填“甲”或“乙”)处的酒精喷灯或酒精灯。(3)、已知所取赤铁矿样品质量为m1 , 反应前后乙装置的质量差为m2 , 反应前后丁和戊装置的总质量差为m3 , 则赤铁矿中Fe2O3的质量分数为。
(2)、在实验中,应先点燃(选填“甲”或“乙”)处的酒精喷灯或酒精灯。(3)、已知所取赤铁矿样品质量为m1 , 反应前后乙装置的质量差为m2 , 反应前后丁和戊装置的总质量差为m3 , 则赤铁矿中Fe2O3的质量分数为。四、解答题
-
32. 人体中钙元素主要以羟基磷酸钙晶体 形式存在于骨略和牙齿中,而牛奶是含钙丰富又易吸收的理想食品,下图为某乳业公可纯奶包装标签:
配料:鲜牛奶
净含量: /盒
营养成分(每 )
蛋白质
钙
保质期:8个月
(1)、羟基磷酸钙由种元素组成;(2)、羟基磷酸钙中钙、氧元素的质量比为多少(写出计算过程)(3)、若人体每天至少需要 钙,每天已从食物中摄入所需钙的一半,则每天至少要喝这种牛奶盒。(4)、除了喝牛奶以外,青少年还可以通过服用含碳酸钙 的钙片来补钙。求 碳酸钙 和多少质量的氢氧化钙 所含的钙元素质量相等?(写出计算过程)33. 某学校探究小组为了测定市面销售的某品牌纯碱(杂质为NaCl)中碳酸钠的质量分数。进行了如下实验: ①在三个烧杯中都加入了11克样品及足量的水配成溶液;②向三个烧杯加入质量不同的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到W克的白色固体。实验数据如下:烧杯I
烧杯Ⅱ
烧杯Ⅲ
加入CaCl2的质量/克
5.55
12
15
W/克
5
10
10
(1)、碳酸钠中钠、碳、氧三种元素的质量比(最简比)为。(2)、将烧杯Ⅱ的滤液蒸干,得到的固体成分是(只填化学式)。(3)、样品中碳酸钠的质量是多少?34. 建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。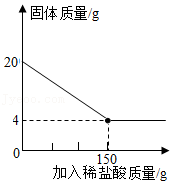 (1)、20g赤铁矿石样品中氧化铁的质量为g;(2)、该样品中铁元素的质量分数为 , 由此判断出该赤铁矿石(填“属于”或“不属于”)富铁矿石。(3)、若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?35. 已知在C2H4、C2H4O和C2H4O6组成的混合物中,经分析发现含氧元素的质量分数为M%,则混合物中氢元素的质量分数是多少?面对这类的题目,我们可以对抽象的问题进行理想化处理。我们把此混合物放入一容器,那么在此容器中便存在大量构成这三种物质的分子:a个C2H4分子,b个C2H4O分子,c个C2H4O6分子。现在我们需取出三个分子,随机的结果有:
(1)、20g赤铁矿石样品中氧化铁的质量为g;(2)、该样品中铁元素的质量分数为 , 由此判断出该赤铁矿石(填“属于”或“不属于”)富铁矿石。(3)、若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?35. 已知在C2H4、C2H4O和C2H4O6组成的混合物中,经分析发现含氧元素的质量分数为M%,则混合物中氢元素的质量分数是多少?面对这类的题目,我们可以对抽象的问题进行理想化处理。我们把此混合物放入一容器,那么在此容器中便存在大量构成这三种物质的分子:a个C2H4分子,b个C2H4O分子,c个C2H4O6分子。现在我们需取出三个分子,随机的结果有:①一个C2H4分子,一个C2H4O分子,一个C2H4O6分子;
②一个C2H4分子,二个C2H4O分子;
③一个C2H4O分子,二个C2H4O6分子……
(1)、我们来看这三种情况,我们发现,无论怎么组合(填两种元素名 称)的原子个数比为一定值,且这两种元素所占总物质的质量分数可表示为 , 且碳元素的质量分数可表示为。(2)、拓展:已知在NaHS、MgSO4和NaHSO3组成的混合物中,含硫40%,则氧元素的质量分数为。