2022年浙教版科学八下复习阶梯训练:微粒的模型与符号 (提高训练)
试卷更新日期:2022-04-09 类型:复习试卷
一、单选题
-
1. 某同学测得海水中含有Cl-的质量分数为2.19%,如果其中的Cl-全部以NaCl计算,则海水中所含NaCl的质量分数是( )A、2.18% B、5.85% C、3.61% D、4.19%2. 行星模型的提出标志着原子结构的现代模型问世。如图是某原子结构的行星模型,根据该模型能得出的结论是( )
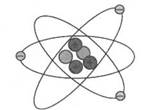 A、该原子是氦原子 B、原子之间存在着空隙 C、原子始终在做无规则运动 D、整个原子不显电性3. 在FeO、Fe2O3、Fe3O4三种化合物中,与等质量铁元素相结合的氧元素的质量比为( )A、6:9:8 B、12:8:9 C、2:3:6 D、1:3:44. 借助“模型”可以帮助我们认识物质的奥秘。下列对如图所示模型的分析不正确的是( )
A、该原子是氦原子 B、原子之间存在着空隙 C、原子始终在做无规则运动 D、整个原子不显电性3. 在FeO、Fe2O3、Fe3O4三种化合物中,与等质量铁元素相结合的氧元素的质量比为( )A、6:9:8 B、12:8:9 C、2:3:6 D、1:3:44. 借助“模型”可以帮助我们认识物质的奥秘。下列对如图所示模型的分析不正确的是( )
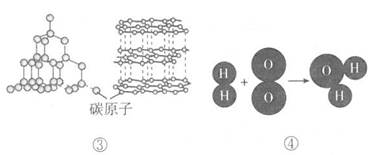 A、①表示的粒子不显电性 B、②表示的物质是化合物 C、③表示的两种物质化学性质相同 D、④表示化学反应的本质是生成新物质5. 如图甲是卢瑟福用a粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了如图乙所示的原子核式结构。下列说法中错误的是( )
A、①表示的粒子不显电性 B、②表示的物质是化合物 C、③表示的两种物质化学性质相同 D、④表示化学反应的本质是生成新物质5. 如图甲是卢瑟福用a粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了如图乙所示的原子核式结构。下列说法中错误的是( )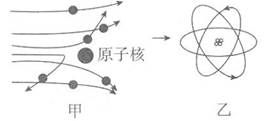 A、通过该实验可知原子内部绝大部分是空的 B、a粒子可能是某种原子的原子核 C、图乙所示原子核式结构是一种模型 D、卢瑟福在研究过程中采用了控制变量法6. 下列含氮化合物中,氮元素化合价由高到低排列的一组是( )A、NH3、NO、HNO3 B、N2O5、N2O4、NO2 C、HNO3、NO2、NH3 D、NO、NO2、N2O37. 对下列化学符号中数字“2”所表示的意义的描述中,不正确的是( )A、2K+中“2”表示钾离子的个数是2 B、H2SO4中“2”表示每个硫酸分 子中含有2个氢原子 C、Ca(OH)2 中“2”表示一个氢氧化钙粒子中有2个氢氧根离子 D、Cu2+中“2”表示铜元素的化合价为+28. 用“∞”和“
A、通过该实验可知原子内部绝大部分是空的 B、a粒子可能是某种原子的原子核 C、图乙所示原子核式结构是一种模型 D、卢瑟福在研究过程中采用了控制变量法6. 下列含氮化合物中,氮元素化合价由高到低排列的一组是( )A、NH3、NO、HNO3 B、N2O5、N2O4、NO2 C、HNO3、NO2、NH3 D、NO、NO2、N2O37. 对下列化学符号中数字“2”所表示的意义的描述中,不正确的是( )A、2K+中“2”表示钾离子的个数是2 B、H2SO4中“2”表示每个硫酸分 子中含有2个氢原子 C、Ca(OH)2 中“2”表示一个氢氧化钙粒子中有2个氢氧根离子 D、Cu2+中“2”表示铜元素的化合价为+28. 用“∞”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( ) 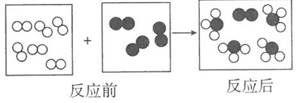 A、该反应前后原子种类和数目没有改变,所以属于化学变化 B、该反应生成了两种物质 C、参加反应的物质在反应前后元素的化合价都发生了改变 D、参加反应的“∞”和“
A、该反应前后原子种类和数目没有改变,所以属于化学变化 B、该反应生成了两种物质 C、参加反应的物质在反应前后元素的化合价都发生了改变 D、参加反应的“∞”和“ ”分子的个数比是2:1
9. 如图是元素周期表的一部分。下列说法中正确的是( )
”分子的个数比是2:1
9. 如图是元素周期表的一部分。下列说法中正确的是( )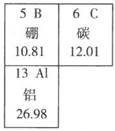 A、硼为金属元素 B、碳的原子序数是12.01 C、铝是地壳中含量最高的元素 D、三种原子中质量最大的是铝10. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法中正确的是( )
A、硼为金属元素 B、碳的原子序数是12.01 C、铝是地壳中含量最高的元素 D、三种原子中质量最大的是铝10. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法中正确的是( ) A、原子序数:C<B B、核内质子数:A= E C、A,B,C同周期 D、D,E同族11. 铷元素的部分信息如图所示,下列有关铷的说法中不正确的是( )
A、原子序数:C<B B、核内质子数:A= E C、A,B,C同周期 D、D,E同族11. 铷元素的部分信息如图所示,下列有关铷的说法中不正确的是( ) A、属于金属元素 B、铷原子核外有37个电子 C、该原子的中子数为85 D、元素符号为Rb12. 二氧化碳和二氧化硫都是由AB2型分子构成的物质,但分子中A原子和B原子的空间位置不同,其模型如图所示。根据此模型,下列叙述中错误的是( )
A、属于金属元素 B、铷原子核外有37个电子 C、该原子的中子数为85 D、元素符号为Rb12. 二氧化碳和二氧化硫都是由AB2型分子构成的物质,但分子中A原子和B原子的空间位置不同,其模型如图所示。根据此模型,下列叙述中错误的是( ) A、两种物质都由两种元素组成 B、两种物质中碳元素和硫元素化合价相同 C、两种物质的化学性质相同 D、分子中原子空间位置不同是因为A原子种类不同13. 质量相等的SO2和SO3中,氧元素的质量比是( )A、2:3 B、1 :1 C、5:6 D、7:1214. 大蒜中含有一种有效成分“硫化丙烯”(C3H6S),具有一定的杀菌食疗作用。下列有关硫化丙烯的说法正确的是( )A、硫化丙烯的相对分子质量为74 B、硫化丙烯中硫元素的质量分数最大 C、硫化丙烯中碳、氢、 硫元素的质量比为3: 6: 1 D、硫化丙烯由3个碳原子、6个氢原子和1个硫原子构成15. 某元素R的化合价是奇数(不变化合价),已知其与氧结合形成的化合物的相对分子质量为m,其与氯结合形成的化合物的相对分子质量为n,则R的化合价为( )A、2(m-n)/55 B、2(n- m)/55 C、(2m-n)/55 D、(2n- m)/55
A、两种物质都由两种元素组成 B、两种物质中碳元素和硫元素化合价相同 C、两种物质的化学性质相同 D、分子中原子空间位置不同是因为A原子种类不同13. 质量相等的SO2和SO3中,氧元素的质量比是( )A、2:3 B、1 :1 C、5:6 D、7:1214. 大蒜中含有一种有效成分“硫化丙烯”(C3H6S),具有一定的杀菌食疗作用。下列有关硫化丙烯的说法正确的是( )A、硫化丙烯的相对分子质量为74 B、硫化丙烯中硫元素的质量分数最大 C、硫化丙烯中碳、氢、 硫元素的质量比为3: 6: 1 D、硫化丙烯由3个碳原子、6个氢原子和1个硫原子构成15. 某元素R的化合价是奇数(不变化合价),已知其与氧结合形成的化合物的相对分子质量为m,其与氯结合形成的化合物的相对分子质量为n,则R的化合价为( )A、2(m-n)/55 B、2(n- m)/55 C、(2m-n)/55 D、(2n- m)/55二、填空题
-
16. 19 世纪以前,人们一直认为原子是不可分的。1897年汤姆生发现了带负电的电子,并提出类似“葡萄干面包”的原子模型。为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。

【解释与结论】
(1)、卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是;(2)、当α粒子轰击金箔时,右图能正确表示运动轨迹的是;(3)、实验中能说明原子内部绝大部分是空的证据是17. N(NO2)3是科学家已发现的一种新型火箭燃料。计算:(1)、N(NO2)3中氮原子和氧原子的个数比为(填最简整数比)。(2)、N(NO2)3的相对分子质量是。(3)、下列化合物中,氮元素质量分数最小的是 (填字母)。A、N(NO2)3 B、N2O3 C、N2O518. 甲、乙、丙、丁四种元素,甲的单质是空气中含量最多的气体,乙是地壳中含量最多的金属元素,丙是人体中含量最多的元素,丁元素原子核外只有一个电子。则乙和丙形成的化合物是;丁的离子符号为 。19. 1869 年,门捷列夫发现了元素周期律,使得科学学习和研究变得有规律可循。如图列出的是1~18号元素的部分最高正化合价和最低负化合价。请回答下列问题。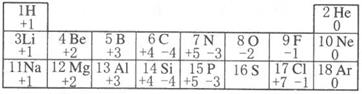 (1)、12号元素属于(填“金属”或“非金属”)元素,它在化学反应中形成的离子是(填离子符号)。(2)、16号元素的原子核外电子数为 , 推测该元素最高正化合价为 , 其最低负化合价的粒子与氢形成的化合物的化学式为。(3)、从图中我们可以发现一些规律:(写一条即可)。20. 如图表示治理汽车尾气所涉及反应的微观过程,请根据示意图回答下列问题。
(1)、12号元素属于(填“金属”或“非金属”)元素,它在化学反应中形成的离子是(填离子符号)。(2)、16号元素的原子核外电子数为 , 推测该元素最高正化合价为 , 其最低负化合价的粒子与氢形成的化合物的化学式为。(3)、从图中我们可以发现一些规律:(写一条即可)。20. 如图表示治理汽车尾气所涉及反应的微观过程,请根据示意图回答下列问题。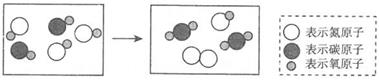 (1)、其中
(1)、其中 表示的物质是(用化学式表示)。 (2)、尾气处理后生成的单质和化合物的质量比为。(3)、该模型体现了化学反应的微观本质是。21. “中国铜都”江西德兴金矿、铜矿资源丰富。请用恰当的化学用语表示下列带点部分:(1)、黄金中含有金元素:。(2)、辉铜矿的主要成分是硫化亚铜(Cu2S),硫化亚铜中阴离子的符号: 。(3)、从黄铜矿(主要成分CuFeS2)中提取铜,标出其中一种生成物氧化亚铁中铁元素的化合价:。22. 可燃冰分布于深海沉积物或陆域的永久冻土中,主要是由甲烷(CH4)与水在高压低温条件下形成的类冰状结晶物质,可燃烧,所以被称为“可燃冰”。(1)、CH4中C、H元素的质量比为(2)、已知在相同条件下,1米任何气体所含的分子数目均相同,已知CO完全燃烧与氧气的体积比为2:1,CH4完全燃烧与氧气的体积比为1 : 2。据此分析,在相同条件下,分别燃烧1米3CO和CH4 , 消耗氧气的体积比是。23. 氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。
表示的物质是(用化学式表示)。 (2)、尾气处理后生成的单质和化合物的质量比为。(3)、该模型体现了化学反应的微观本质是。21. “中国铜都”江西德兴金矿、铜矿资源丰富。请用恰当的化学用语表示下列带点部分:(1)、黄金中含有金元素:。(2)、辉铜矿的主要成分是硫化亚铜(Cu2S),硫化亚铜中阴离子的符号: 。(3)、从黄铜矿(主要成分CuFeS2)中提取铜,标出其中一种生成物氧化亚铁中铁元素的化合价:。22. 可燃冰分布于深海沉积物或陆域的永久冻土中,主要是由甲烷(CH4)与水在高压低温条件下形成的类冰状结晶物质,可燃烧,所以被称为“可燃冰”。(1)、CH4中C、H元素的质量比为(2)、已知在相同条件下,1米任何气体所含的分子数目均相同,已知CO完全燃烧与氧气的体积比为2:1,CH4完全燃烧与氧气的体积比为1 : 2。据此分析,在相同条件下,分别燃烧1米3CO和CH4 , 消耗氧气的体积比是。23. 氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。
名称
符号
相对原子质量
氕
H
1
氘
D
2
氚
T
3
试回答:
(1)、超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O。T2O中T的化合价为 。(2)、重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100 t海水中所含氘的质量是kg。(3)、原子结构模型中的“⊕”表示的粒子是。24. MgBr2和MgO组成的某混合物,经分析测得Mg元素的质量分数为38.4%,则混合物中溴(Br)元素的质量分数为。25. 如图是电解水的过程中水分子分解的示意图。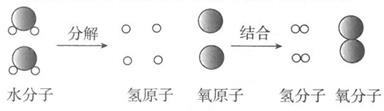 (1)、从微观粒子角度,水通电时,水分子分裂成和 , 分裂出来的又重新组合成 ,它们不再有水的化学性质。可见,是保持水的化学性质的最小微粒。(2)、由该实验可知,分子由构成,是化学变化中的最小粒子。分子和原子的本质区
(1)、从微观粒子角度,水通电时,水分子分裂成和 , 分裂出来的又重新组合成 ,它们不再有水的化学性质。可见,是保持水的化学性质的最小微粒。(2)、由该实验可知,分子由构成,是化学变化中的最小粒子。分子和原子的本质区别是 。
三、实验探究题
-
26. 碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:
①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色;②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。(提示:碘分子能使馒头中的淀粉变蓝色)
(1)、取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头(填“会”或“不会”)变蓝色。(2)、把碘溶解在酒精中,可以得到消毒用的碘酒,用馒头去蘸取少量的碘酒,馒头(填“会或“不会”)变蓝色。(3)、请用分子的观点来解释实验中的现象:。27. 核事故中往往泄漏出污染物131I(具有放射性的碘原子)。为避免核辐射,需一次性口服100 mg 127I(不具放射性的碘原子),使人体甲状腺中的碘达到饱和而不再吸收外界的碘,从而起到保护作用。请回答下列问题:
(1)、131I是一种质子数为53、中子数为78的碘原子。该原子核外电子数为。(2)、131I与127I的关系是 (填字母)。A、同种元素 B、同种物质 C、同种分子 D、同种原子(3)、假设所处的环境已受污染,通过服用加碘食盐(注:加碘食盐中的碘为碘元素)的方法能否有效起到避免核辐射的目的呢?[查阅资料]成人每天食用食盐的质量通常为6 g,
某种加碘食盐的标签如图所示。

[问题分析]500 g该品牌食盐中,含碘的最大质量是;若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐。
[结论]日常服用加碘食盐(填“能”或“不能”)起到避免核辐射的目的,原因是。
(4)、专家指出,服用碘片(有效成分为KI)可以治疗”131I造成的辐射,但服用碘酒(有效成分为I2)却会引起碘中毒。KI和I2性质不同的原因是。28. 探究原子结构的奥秘。[情境提供]19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验]1911年英国科学家卢瑟福进行了著名的a粒子轰击金属箔的实验。如图所示:
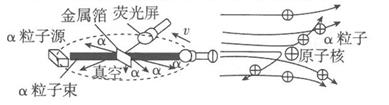
①放射源——放射性物质放出 a粒子(带正电荷),质量是电子质量的7 000倍;
②金属箔——作为靶子,厚度 1 μm,重叠了3 000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
[收集证据]绝大多数α粒子穿过金属箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大角度的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达180°,像是被金属箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构。上,否则大角度的散射是不可能的。
[解释与结论]
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。(2)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为 (填字母)。A、 道尔顿模型特点:不可再分的实心球体
B、
道尔顿模型特点:不可再分的实心球体
B、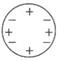 汤姆生模型特点:正负电荷均匀分布
C、
汤姆生模型特点:正负电荷均匀分布
C、 卢瑟福模型特点:核位于原子中心,质量集中在核上
29. 为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。
卢瑟福模型特点:核位于原子中心,质量集中在核上
29. 为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。【收集证据】①绝大多数α粒子穿过金箔后仍沿原来的方向前进;②只有少数α粒子发生了的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°。
【解释与结论】
(1)、要发生大角度的散射,说明原子的大部分质量集中到了一个很小的结构且该结构带有与α粒子电性相同的电荷,这个很小的结构指的是;(2)、能说明原子内部绝大部分是空的证据是;(选填序号)(3)、根据卢瑟福的实验所产生的现象,能够获得的结论是 ;A、原子核体积很小 B、原子核质量较大 C、原子核带正电 D、核外电子带负电30. 到19世纪末,经几代科学家对光合作用的不断探索,得到结论:光合作用的反应物是H2O和CO2 , 产物是O2和有机物。为了探究产物O2中的O元素的来源,科学兴趣小组从元素守恒的角度进行了如下猜想。猜想一:O2中的O元素全部来源于CO2;
猜想二:O2中的O元素全部来自于H2O;
猜想三:O2中的O元素来源于CO2和H2O。
为了求证,他们查阅了以下资料:
资料一:范尼尔通过实验得出紫硫细菌合成有机物的反应式,与高等植物光合作用的
反应式进行比较研究后,建立了猜想。
紫硫细菌:CO2+2H2S (CH2O)(糖类)+2S+H2O
高等植物:CO2+2H2O (CH2O)(糖类)+O2+H2O
资料二:美国科学家鲁宾、卡门给三组小球藻提供含有一定比例180的水和碳酸氢盐(碳酸氢盐给小球藻的光合作用提供全部的CO2 , 而且不产生水,其他条件均相同),光照相同时间后,分别检测小球藻释放氧气中18O的比例,实验结果如表所示。(18O可作为示踪原子)
组别
水中18O的比例(%)
碳酸氢盐中18O的比例(%)
释放的氧气中18O的比例(%)|
1
0.85
0.41
0.84
2
0.85
0.55
0.85
3
0.85
0.61
0.85
资料三:
Ⅰ.16O表示中子数为 8的氧原子,18O是表示中子数为10的氧原子, 所以1个18O的质量是一个16O的质量9/8倍;自然界的氧气在标准状况下的密度为1.43千克/米3 , 其中16O占99.76% (可视为100%) ;
Ⅱ.在相同的温度和压强下,相同体积的气体具有相同的分子数。
Ⅲ.鲁宾和卡门通过测生成氧气的密度来确定氧气中18O含量。
(1)、资料一的实验结论支持猜想(选填 “一”、“二”或“三”)的观点:(2)、根据资料二鲁宾、卡门的实验结果,可得出的结论及相应的依据分别是。(3)、若有一瓶氧气,里面的氧原子全部由18O。结合资料,计算在标准状况下该瓶氧气的密度为千克/米3。四、解答题
-
31. 在抗击新冠肺炎疫情中,一种名为瑞德西韦(分子式为C27H35N6O8P)的新药曾被寄予厚望。请回答:(1)、瑞德西韦由 种元素组成,其中碳、氧元素的质量比为(最简整数比)。(2)、该药品中氧元素的质量分数是(精确到0.1%)。301 mg瑞德西韦中含有氢元素的质量为mg。32. 蛋白质是机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应,生成氨基酸。蛋氨酸(化学式为C5H11O2NS)就是其中的一种。请分析计算下列问题:(以下数据可以帮助你呦,C--12,H--1,O--16,N--14,S--32)(1)、蛋氨酸的相对分子质量是;(2)、蛋氨酸中碳氧元素的质量比C∶O =;(3)、蛋氨酸中氮元素的质量分数?(精确到0.1%)(要求写出计算过程)(4)、合格奶粉每100克含蛋白质约18克,蛋白质中氮元素的平均质量分数为16%,则每100克合格奶粉中氮元素的质量为多少克?现测定某奶粉每100克中含有氮元素1.5克,通过计算判断这种奶粉是否合格.33. 为了验证骨头汤能否有效补钙,某科研小组将猪排骨500 g、蒸馏水1 500 mL、食用醋70 mL,加热煮沸后维持70分钟,得到骨头汤1 243 mL,用仪器检测结果:每100 mL骨头汤含有2 mg钙(而每100 mL牛奶约含有105 mg钙)。
查阅资料:人体骨骼中的钙存在形式是羟基磷酸钙[Ca10(PO4)6(OH)2],该物质难溶于水。人体平均每天需要补钙800 mg。
(1)、“骨头汤能补钙”中的钙是指 (填字母)。A、钙离子 B、钙元素 C、单质钙 D、羟基磷酸钙(2)、羟基磷酸钙中磷元素的化合价是。(3)、假设某人只能从骨头汤中获取钙,则此人每天需要喝L骨头汤。(4)、下列物质中不能作为人体补钙剂的是 (填字母)。A、牛奶 B、某品牌钙片 C、氧化钙(即生石灰) D、葡萄糖酸钙(5)、某品牌钙片每片的规格是维生素D3100IU(相当于2.5μg),碳酸钙1000 mg,若某人只从钙片中获取钙,则每天需要服用此品牌钙片多少片?34. 硝酸铵是农业生产中广泛使用的氮肥,根据硝酸铵的化学式(NH4NO3)进行计算:(1)、硝酸铵的相对分子质量是。(2)、硝酸铵中氮、氢、氧三种元素的质量比是。(3)、500g硝酸铵中含氮元素g;g硝酸铵中含氮元素14 g。(4)、多少克硝酸铵中所含氮元素的质量和120 g尿素[CO(NH2)2]中所含氮元素的质量相等?35. 碰碰香是一种常见的室内盆栽植物,因触碰后可散发出令人舒适的香气而得名,其香气具有提神醒脑、驱避蚊虫的作用。碰碰香的香味物质中含量最多的是柠檬烯,其化学式为C10H16。计算:(1)、柠檬烯中碳元素、氢元素的质量比为。(2)、柠檬烯中碳元素的质量分数是多少? (计算结果精确到0.1%)