高中化学高二年级2020—2021学年人教版(2019)选择性必修一 2.4 化学反应的调控
试卷更新日期:2022-04-06 类型:同步测试
一、选择题
-
1. 工业合成氨: , 一般采用770K左右的温度,其原因是( )
①提高的转化率 ②适当提高氨的合成速率
③提高氨的产率 ④催化剂在700K左右时活性最大
A、只有① B、②④ C、②③④ D、①②2. 工业生产氨气的适宜条件中不包括( )A、用浓硫酸吸收产物 B、用铁触媒作催化剂 C、温度为400~500 ℃ D、压强为10~30 MPa3. 关于反应速率、反应限度的下列说法中正确的是( )A、其他条件不变时,升高温度,只有吸热反应,反应速率加快 B、化学反应的限度是不可改变的 C、化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 D、化学反应达到反应限度时,同一物质的正反应速率与逆反应速率相等4. 下列图示与对应的叙述相符的是( ) A、图甲表示1L pH=2的溶液加水稀释至V L,pH随lg V的变化 B、图乙表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度 C、图丙表示一定条件下的合成氨反应中,NH3平衡体积分数随H2始体积分数(N2起始量恒定)的变化,图中a点N2转化率小于b点 D、图丁表示同一温度下,在不同容积的容器中进行反应
A、图甲表示1L pH=2的溶液加水稀释至V L,pH随lg V的变化 B、图乙表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度 C、图丙表示一定条件下的合成氨反应中,NH3平衡体积分数随H2始体积分数(N2起始量恒定)的变化,图中a点N2转化率小于b点 D、图丁表示同一温度下,在不同容积的容器中进行反应 , O2的平衡浓度与容器容积的关系
5. 下图所示为工业合成氨的流程图。有关说法不正确的是( )
, O2的平衡浓度与容器容积的关系
5. 下图所示为工业合成氨的流程图。有关说法不正确的是( ) A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 C、步骤③、④、⑤均有利于提高原料的转化率 D、产品液氨除可生产化肥外,还可用作制冷剂6. 下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )A、使用铁触媒,使和混合气体有利于合成氨 B、高压比常压更有利于合成氨的反应 C、500℃左右比室温更有利于合成氨的反应 D、合成氨时采用循环操作,可提高原料的利用率7. 已知反应A2(g)+2B2(g) 2AB2(g)的ΔH<0,下列说法正确的是( )A、升高温度,正向反应速率增加,逆向反应速率减小 B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动8. 下列对于合成氨的叙述中不正确的是( )A、由于合成氨反应属于放热反应,所以反应无需加热 B、合成氨工艺是哈伯发明的 C、合成氨工业需要提供高温、高压、催化剂等条件 D、合成氨可以提供氮肥9. 已知和都可做分解制的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( )A、
A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 C、步骤③、④、⑤均有利于提高原料的转化率 D、产品液氨除可生产化肥外,还可用作制冷剂6. 下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )A、使用铁触媒,使和混合气体有利于合成氨 B、高压比常压更有利于合成氨的反应 C、500℃左右比室温更有利于合成氨的反应 D、合成氨时采用循环操作,可提高原料的利用率7. 已知反应A2(g)+2B2(g) 2AB2(g)的ΔH<0,下列说法正确的是( )A、升高温度,正向反应速率增加,逆向反应速率减小 B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动8. 下列对于合成氨的叙述中不正确的是( )A、由于合成氨反应属于放热反应,所以反应无需加热 B、合成氨工艺是哈伯发明的 C、合成氨工业需要提供高温、高压、催化剂等条件 D、合成氨可以提供氮肥9. 已知和都可做分解制的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( )A、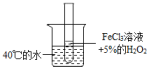 B、
B、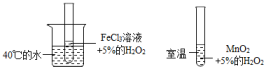 C、
C、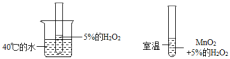 D、
D、 10. 对于合成氨反应,达到平衡后,以下分析正确的是( )A、升高温度,对正反应的反应速率影响更大 B、增大压强,对正反应的反应速率影响更大 C、减小反应物浓度,对逆反应的反应速率影响更大 D、加入催化剂,对逆反应的反应速率影响更大11. 下图为工业合成氨的流程图。图中为提高原料转化率而采取的措施是( )
10. 对于合成氨反应,达到平衡后,以下分析正确的是( )A、升高温度,对正反应的反应速率影响更大 B、增大压强,对正反应的反应速率影响更大 C、减小反应物浓度,对逆反应的反应速率影响更大 D、加入催化剂,对逆反应的反应速率影响更大11. 下图为工业合成氨的流程图。图中为提高原料转化率而采取的措施是( ) A、①②③ B、①③⑤ C、②④⑤ D、②③④12. 固体表面的化学过程研究对于化学工业非常重要。在Fe作催化剂、一定压强 和温度下合成氨的反应机理如下图所示:下列说法不正确的是( )
A、①②③ B、①③⑤ C、②④⑤ D、②③④12. 固体表面的化学过程研究对于化学工业非常重要。在Fe作催化剂、一定压强 和温度下合成氨的反应机理如下图所示:下列说法不正确的是( ) A、N2和H2分子被吸附在铁表面发生反应 B、吸附在铁表面的N2断裂了
A、N2和H2分子被吸附在铁表面发生反应 B、吸附在铁表面的N2断裂了 键
C、NH3分子中的N—H键不是同时形成的
D、Fe催化剂可以有效提高反应物的平衡转化率
13. 合成氨工业中,下列措施有利于提高平衡转化率的是( )A、提高反应温度 B、从反应体系中分离出氨 C、使用催化剂 D、恒温恒压下,充入稀有气体14. 1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H22NH3 , 有关说法正确的是( )A、不同的催化剂对化学反应速率影响均相同 B、新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 C、新法合成能在常温下进行是因为不需要断裂化学键 D、哈伯法合成氨是吸热反应,新法合成氨是放热反应15. 在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是( )A、混合气体的压强 B、混合气体的密度 C、C、D的物质的量的比值 D、气体的总物质的量16. 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g)
键
C、NH3分子中的N—H键不是同时形成的
D、Fe催化剂可以有效提高反应物的平衡转化率
13. 合成氨工业中,下列措施有利于提高平衡转化率的是( )A、提高反应温度 B、从反应体系中分离出氨 C、使用催化剂 D、恒温恒压下,充入稀有气体14. 1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H22NH3 , 有关说法正确的是( )A、不同的催化剂对化学反应速率影响均相同 B、新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 C、新法合成能在常温下进行是因为不需要断裂化学键 D、哈伯法合成氨是吸热反应,新法合成氨是放热反应15. 在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是( )A、混合气体的压强 B、混合气体的密度 C、C、D的物质的量的比值 D、气体的总物质的量16. 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g) 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如图所示。下列说法正确的是( )
2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如图所示。下列说法正确的是( ) A、c点处反应达到平衡 B、d点(t1时刻)和e点(t2时刻)处n(N2)不同 C、其他条件不变,773K下反应至t1时刻,n(H2)比图中的d点的值要大 D、a点的正反应速率比b点的小17. 500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系,下列说法正确的是( )
A、c点处反应达到平衡 B、d点(t1时刻)和e点(t2时刻)处n(N2)不同 C、其他条件不变,773K下反应至t1时刻,n(H2)比图中的d点的值要大 D、a点的正反应速率比b点的小17. 500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系,下列说法正确的是( ) A、反应到达平衡状态时升高温度,混合气体的平均相对分子质量增大 B、原料气中H2的比例越大,平衡混合气体中NH3的体积分数就越高 C、图中a点H2的平衡体积分数为43.5% D、平衡状态时移走部分氨气,保持条件不变,△H减小18. 工业上利用可逆反应N2(g)+3H2(g) 2NH3(g)合成氨,下列叙述正确的是( )A、合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率 B、恒容通入氩气,使反应体系的压强增大,反应速率一定增大 C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 D、在时刻, 的浓度分别是则时间间隔内, 生成的平均速率为19. 一定条件下反应N2+3H22NH3 △H<0达平衡时,当单独改变下述条件后有关叙述一定错误的是( )A、加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 B、加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 C、降温,v(正)和v(逆)都减少,且v(正)减少倍数大于v(逆)减少倍数 D、增加c(N2),瞬间后v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数20. 一定温度下,可逆反应在体积固定的密闭容器中反应,达到平衡状态的标志是( )
A、反应到达平衡状态时升高温度,混合气体的平均相对分子质量增大 B、原料气中H2的比例越大,平衡混合气体中NH3的体积分数就越高 C、图中a点H2的平衡体积分数为43.5% D、平衡状态时移走部分氨气,保持条件不变,△H减小18. 工业上利用可逆反应N2(g)+3H2(g) 2NH3(g)合成氨,下列叙述正确的是( )A、合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率 B、恒容通入氩气,使反应体系的压强增大,反应速率一定增大 C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 D、在时刻, 的浓度分别是则时间间隔内, 生成的平均速率为19. 一定条件下反应N2+3H22NH3 △H<0达平衡时,当单独改变下述条件后有关叙述一定错误的是( )A、加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 B、加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 C、降温,v(正)和v(逆)都减少,且v(正)减少倍数大于v(逆)减少倍数 D、增加c(N2),瞬间后v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数20. 一定温度下,可逆反应在体积固定的密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成 的同时生成2
②单位时间内生成 的同时,生成2
③用、、的物质的量浓度变化表示的反应速率之比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A、①④⑤⑥ B、①②③⑤ C、②③④⑥ D、以上全部二、非选择题
-
21. 水煤气变换[]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:(1)、Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。
(2)、721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为( )A、<0.25 B、0.25 C、0.25~0.50 D、0.50 E、>0.50(3)、我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。
(4)、Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的和相等、和相等。
计算曲线a的反应在30~90 min内的平均速率=。467 ℃时和随时间变化关系的曲线分别是、。489℃时和随时间变化关系的曲线分别是、。
22. 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。(1)、一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
在OA段,氢溶解于M中形成固溶体MHx , 随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy , 氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g-1•min。反应的焓变△HⅠ0(填“>”“<”或“=”)。
(2)、η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气。(3)、贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•molCO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
23. 基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获,其原理如图所示: (1)、已知在燃料反应器中发生如下反应:
(1)、已知在燃料反应器中发生如下反应:i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=a kJ·mol-1
ii.CaSO4(s)+CH4(g)=CaS(s)+2H2O(g)+CO2(g) ΔH2=b kJ·mol-1
iii.CaS(s)+3CaSO4(s)=4CaO(s)+4SO2(g) ΔH3=c kJ·mol-1
①燃料反应器中主反应为(填"i""ii"或"iii")。
②反应i和ii的平衡常数Kp与温度的关系如图甲,则a(填">""="或"<")0;720 ℃时反应iii的平衡常数Kp=。
③下列措施可提高反应ii中甲烷平衡转化率的是。
A.增加CaSO4固体的投入量
B.将水蒸气冷凝
C.降温
D.增大甲烷流量
 (2)、如图乙所示,该燃料反应器最佳温度范围为850~900℃之间,从化学反应原理的角度说明原因:。(3)、空气反应器中发生的反应为CaS(s)+2O2(g)=CaSO4(s) ΔH4=d kJ·mol-1
(2)、如图乙所示,该燃料反应器最佳温度范围为850~900℃之间,从化学反应原理的角度说明原因:。(3)、空气反应器中发生的反应为CaS(s)+2O2(g)=CaSO4(s) ΔH4=d kJ·mol-1①根据热化学原理推测该反应为反应。
②在天然气燃烧过程中,可循环利用的物质为。
(4)、该原理总反应的热化学方程式为。24. 氨是重要的工业原料,在农业、医药和化工等领域有重要应用。(1)、I.工业上用和在一定条件下合成氨,下列措施能使正反应速率增大,且平衡混合物中的体积分数—定增大的是( )。A、降低反应温度 B、压缩反应混合物 C、充入 D、液化分离(2)、常温下,向100mL0.2mol/L,的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中和物质的量分数与加入盐酸的体积的关系如图所示,根据图像回答下列问题。
①表示浓度变化的曲线是(填“A”或“B”)。
②的电离常数为(已知lg1.8=0.26)。
③当加入盐酸体积为50mL,溶液中=mol/L(用数字表示)。
(3)、II.若液氨中也存在类似水的电离(),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。写出液氨的电离方程式:。
(4)、写出碳酸钠溶于液氨后一级氨解的离子方程式:。(5)、写出碳酸钠的液氨溶液中各离子浓度的大小关系:。