高中化学(人教版2019)2021-2022学年选择性必修1第四章化学反应与电能 实验活动4:简单的电镀实验课后练习
试卷更新日期:2022-04-06 类型:同步测试
一、单选题(共16题)
-
1. 下列描述中,不符合生产实际的是( )A、电解熔融的氧化铝制取金属铝 B、在镀件上电镀锌,用锌作阳极 C、电解法精炼粗铜,用纯铜作阳极 D、电解饱和食盐水制烧碱,阳极室产生氯气2. 下列关于铜电极的叙述中不正确的是( )A、锌铜原电池铜是正极 B、在镀件上镀铜时可用金属铜做阳极 C、用电解法精炼粗铜时粗铜做阴极 D、用电解法精炼粗铜时,Cu2+移向纯铜电极3. 下列过程需要通电后才可以发生或进行的是 ( )
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀
A、①② B、②③④ C、②③④⑤ D、全部4. 下列说法不正确的是( )A、电解精炼铜时溶液中的铜离子浓度会减少 B、电镀时,应把镀件置于电解池的阴极 C、为防止水闸铁门被腐蚀,可让其与直流电源的负极相连 D、电化学防护中牺牲阳极的阴极保护法是利用了电解池原理5. 关于下列各装置图的叙述中,不正确的是( ) A、装置①中电镀铜,a极为纯铜,b极为锌,电解质溶液为CuSO4溶液 B、装置②为原电池,总反应是:Fe+2Fe3+=3Fe2+ C、图③所示柱状图,纵坐标表示第二周期元素最高正价随原子序数的变化 D、图④所示曲线,表示该反应是放热反应6. 下列叙述不正确的是( )A、在铁件上镀铜时,金属铜作阳极 B、电解精炼粗铜时,电解质CuSO4溶液加少量硫酸是抑制 CuSO4水解 C、纯锌与稀硫酸反应时,加入少量CuSO4 , 可使反应速率加快 D、甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH﹣+6e﹣═CO2+5H2O7. 下列叙述不正确的是( )A、铁表面镀锌,铁作阳极 B、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e–=4OH– C、船底镶嵌锌块,锌作负极,以防船体被腐蚀 D、工业上电解饱和和食盐水的阴极反应:2H+ +2e –= H2↑8. 利用如图所示装置模拟电解原理在工业生产中的应用,下列说法正确的是( )
A、装置①中电镀铜,a极为纯铜,b极为锌,电解质溶液为CuSO4溶液 B、装置②为原电池,总反应是:Fe+2Fe3+=3Fe2+ C、图③所示柱状图,纵坐标表示第二周期元素最高正价随原子序数的变化 D、图④所示曲线,表示该反应是放热反应6. 下列叙述不正确的是( )A、在铁件上镀铜时,金属铜作阳极 B、电解精炼粗铜时,电解质CuSO4溶液加少量硫酸是抑制 CuSO4水解 C、纯锌与稀硫酸反应时,加入少量CuSO4 , 可使反应速率加快 D、甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH﹣+6e﹣═CO2+5H2O7. 下列叙述不正确的是( )A、铁表面镀锌,铁作阳极 B、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e–=4OH– C、船底镶嵌锌块,锌作负极,以防船体被腐蚀 D、工业上电解饱和和食盐水的阴极反应:2H+ +2e –= H2↑8. 利用如图所示装置模拟电解原理在工业生产中的应用,下列说法正确的是( )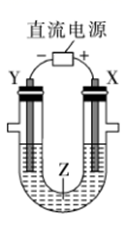 A、氯碱工业中,X电极上的反应式是4OH--4e-=2H2O+O2↑ B、电解精炼铜时,Z溶液中的Cu2+浓度不变 C、在铁片上镀铜时,每转移2mol电子,Y极增重64g D、制取金属铝时,Z是熔融的氯化铝9. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连10. 我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作( )A、负极 B、阳极 C、正极 D、阴极11. 下列叙述不正确的是( )A、NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成、 B、电解、电离、电镀均需要通电才可进行 C、CO2、N2O5、SO2均为酸性氧化物 D、水玻璃、淀粉溶液、胶体均为混合物12. 下列描述中不符合生产实际的是( )A、电解水制氢气时,用铜作阳极 B、电解法精炼粗铜,用纯铜作阴极 C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D、在镀件上电镀锌,用锌作阳极13. 下列叙述正确的是( )
A、氯碱工业中,X电极上的反应式是4OH--4e-=2H2O+O2↑ B、电解精炼铜时,Z溶液中的Cu2+浓度不变 C、在铁片上镀铜时,每转移2mol电子,Y极增重64g D、制取金属铝时,Z是熔融的氯化铝9. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连10. 我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作( )A、负极 B、阳极 C、正极 D、阴极11. 下列叙述不正确的是( )A、NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成、 B、电解、电离、电镀均需要通电才可进行 C、CO2、N2O5、SO2均为酸性氧化物 D、水玻璃、淀粉溶液、胶体均为混合物12. 下列描述中不符合生产实际的是( )A、电解水制氢气时,用铜作阳极 B、电解法精炼粗铜,用纯铜作阴极 C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D、在镀件上电镀锌,用锌作阳极13. 下列叙述正确的是( )
①锌跟稀硫酸反应制H2加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁比马口铁更耐腐蚀;③电镀时,应把镀件置于电解槽的阳极;④冶炼铝时,将AlCl3加热成为熔融体后电解;⑤钢铁制品长期露置于潮湿空气中表面常易发生电化腐蚀生成Fe2O3·nH2O;⑥电解精炼铜时,将粗铜置于电解槽的阴极A、全部 B、①②⑤ C、①③⑤ D、①③④14. 如下图所示的装置,C、D、F、X、Y都是惰性电极,E为铁棒。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是( ) A、电源B极是负极 B、欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液 C、甲、乙装置的C,D,E,F电极均有单质生成,其物质的量之比为1:2:2:2 D、装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷15. 某二次电池装置如图所示,锂、充有催化剂的碳纳米管为电极,电解质能传导Li+。放电时生成的Li2CO3和C附着在电极上,充电时可使Li2CO3转化为Li、CO2和O2。下列说法不正确的是( )
A、电源B极是负极 B、欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液 C、甲、乙装置的C,D,E,F电极均有单质生成,其物质的量之比为1:2:2:2 D、装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷15. 某二次电池装置如图所示,锂、充有催化剂的碳纳米管为电极,电解质能传导Li+。放电时生成的Li2CO3和C附着在电极上,充电时可使Li2CO3转化为Li、CO2和O2。下列说法不正确的是( ) A、放电时,电流从电极Y经外电路流向电极X B、充电时,电极X接外电源的正极发生氧化反应 C、充电时,电极Y的电极反应式为2Li2CO3-4e-=2CO2↑+O2↑+4Li+ D、应用该电池电镀铜,若析出64gCu,理论上消耗标况下33.6LCO216. 如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( )
A、放电时,电流从电极Y经外电路流向电极X B、充电时,电极X接外电源的正极发生氧化反应 C、充电时,电极Y的电极反应式为2Li2CO3-4e-=2CO2↑+O2↑+4Li+ D、应用该电池电镀铜,若析出64gCu,理论上消耗标况下33.6LCO216. 如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( ) A、M电极反应式:(C6H10O5)n+7nH2O﹣24ne﹣=6nCO2↑+24nH+ B、铜电极应与X相连接 C、质子透过离子交换膜由右向左移动 D、当N电极消耗0.2 mol气体时,则铁电极增重16g
A、M电极反应式:(C6H10O5)n+7nH2O﹣24ne﹣=6nCO2↑+24nH+ B、铜电极应与X相连接 C、质子透过离子交换膜由右向左移动 D、当N电极消耗0.2 mol气体时,则铁电极增重16g二、综合题(共3题)
-
17. 次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
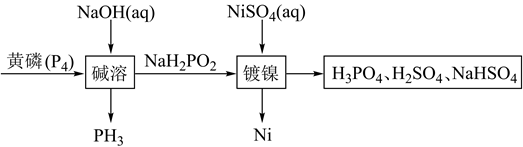
据此回答下列问题:
(1)、红磷与黄磷之间的关系为。(2)、次磷酸钠中磷元素的化合价为。(3)、写出碱溶过程的化学反应方程式 , 该反应中氧化剂与还原剂物质的量之比为。(4)、已知次磷酸钠中的 为四面体结构,请写出 的结构式 , 次磷酸钠NaH2PO2为 填“酸式盐”、“碱式盐”、“正盐”
填“酸式盐”、“碱式盐”、“正盐”  。 (5)、请简述化学镀镍的反应原理。18. 观察下列几个装置示意图,有关叙述正确的是
。 (5)、请简述化学镀镍的反应原理。18. 观察下列几个装置示意图,有关叙述正确的是 (1)、在①图中,发生反应的化学方程式为:。(2)、在②图中,待镀铁制品应与电源极相连,电极反应式为:。(3)、在③图中,外电路电子由极流向极,若电解液为KOH溶液,则b极的反应式为。19. 如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
(1)、在①图中,发生反应的化学方程式为:。(2)、在②图中,待镀铁制品应与电源极相连,电极反应式为:。(3)、在③图中,外电路电子由极流向极,若电解液为KOH溶液,则b极的反应式为。19. 如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答: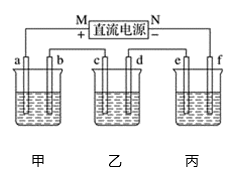 (1)、b极上的电极反应式为 , 甲电池的总反应化学方程式是。(2)、在粗铜的电解过程中,图中c电极的材料是(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是 , 电解一段时间后,电解液中的金属离子有。(3)、如果要在铁制品上镀镍(二价金属),则e电极的材料是(填“铁制品”或“镍块”,下同),f电极的材料是。(4)、若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为。
(1)、b极上的电极反应式为 , 甲电池的总反应化学方程式是。(2)、在粗铜的电解过程中,图中c电极的材料是(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是 , 电解一段时间后,电解液中的金属离子有。(3)、如果要在铁制品上镀镍(二价金属),则e电极的材料是(填“铁制品”或“镍块”,下同),f电极的材料是。(4)、若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为。