新疆维吾尔自治区喀什第二高级中学2021-2022学年高三下学期2月开学考试化学试题
试卷更新日期:2022-04-02 类型:开学考试
一、单项选择题:本题共12小题,每小题3分,共36分.在每小题给出的四个选项中,只有一个选项是符合题目要求的.
-
1. 关于煤、石油、天然气等资源的说法正确的是 ( )A、石油裂解得到的汽油是纯净物 B、石油、煤、可燃冰、植物油都属于化石燃料 C、天然气是一种清洁的化工原料 D、水煤气是通过煤的液化得到的气体燃料2. 只用一种试剂即可鉴别Na2SO4、NaCl、(NH4)2SO4、AlCl3四种溶液,这种试剂是( )A、氨水 B、Ba(OH)2溶液 C、NaOH溶液 D、AgNO3溶液3. 如下图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子最外层电子数与其内层电子数之比为 , 则下列说法不正确的是( )
X
Y
Z
W
A、氢气在W单质中燃烧发出苍白色火焰 B、Y元素的两种同素异形体常温下都是气体 C、最高价氧化物对应水化物的酸性: D、简单阴离子半径从大到小排列顺序为:4. 下列化学用语的表述正确的是( )A、原子的价电子构型: B、二氧化碳分子的比例模型: C、溶液导电:NaCl
Na++Cl-
D、的电子式:
5. 下列关于胶体和溶液的说法中正确的是( )A、胶体不均一、不稳定、静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 B、胶体与悬浊液的本质区别是胶体是均一透明的,而悬浊液是浑浊的 C、光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应 D、实验室可用FeCl3饱和溶液和NaOH溶液混合制备Fe(OH)3胶体6. 少量铁粉与100 mL 0.1 mol/L的稀盐酸反应,若想减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )
C、溶液导电:NaCl
Na++Cl-
D、的电子式:
5. 下列关于胶体和溶液的说法中正确的是( )A、胶体不均一、不稳定、静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 B、胶体与悬浊液的本质区别是胶体是均一透明的,而悬浊液是浑浊的 C、光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应 D、实验室可用FeCl3饱和溶液和NaOH溶液混合制备Fe(OH)3胶体6. 少量铁粉与100 mL 0.1 mol/L的稀盐酸反应,若想减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O ②降温 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦加KNO3溶液
A、①④⑤⑦ B、②③⑥ C、①②⑤⑦ D、①②④⑤7. 下列有关物质的性质与用途具有对应关系的是( )A、NH3极易溶于水,可用作制冷剂 B、浓硫酸具有吸水性,可用于干燥Cl2 C、Al2O3能与碱反应,可用于电解冶炼铝 D、NaHCO3受热易分解,可用于制胃酸中和剂8. 下列离子方程式不正确的是( )A、氨气通入盐酸中: B、氨水吸收少量气体: C、向溶液中滴加过量氨水: D、氨气通入滴有酚酞的水中,溶液变红:9. 根据以上数据,磷原子的半径可能是( )原子
N
S
O
Si
半径/nm
0.075
0.102
0.074
0.117
A、0.080 nm B、0.110 nm C、0.120 nm D、0.070 nm10. 下列热化学方程式正确的是( )A、甲烷的燃烧热 , 则甲烷燃烧的热化学方程式可表示为: B、500℃、30MPa下,将0.5mol(g)和1.5mol(g)置于密闭容器中充分反应生成(g),放热19.3kJ,其热化学方程式为 C、增大反应物浓度,活化分子百分数增加大,单位时间内有效碰撞次数增多 D、已知 , , 则a<b11. 下列变化或反应中,与氧化还原反应无关的是( )A、绿色植物的光合作用 B、谷物酿造酒和醋 C、切开的土豆、苹果,在空气中放置一段时间后变色 D、二氧化硫漂白纸张12. 用CO还原N2O的方程式为。在体积均为1L的密闭容器 , 恒温、起始 , 绝热中分别加入0.1molN2O、0.4molCO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图所示。下列说法错误的是( ) A、A容器中的转化率随时间的变化关系是图中的a曲线 B、要缩短b曲线对应容器达到平衡的时间,但不改变N2O平衡转化率,在催化剂一定的情况下可采取缩小容器体积的措施 C、该反应的化学平衡常数K= D、该反应是放热反应
A、A容器中的转化率随时间的变化关系是图中的a曲线 B、要缩短b曲线对应容器达到平衡的时间,但不改变N2O平衡转化率,在催化剂一定的情况下可采取缩小容器体积的措施 C、该反应的化学平衡常数K= D、该反应是放热反应二、综合题:本题共4小题,共64分.
-
13. 过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)、Cr是第周期第族元素。(2)、基态Cr原子的核外电子有种空间运动状态,有个未成对电子。(3)、Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为。(4)、[Cr(NH3)3(H2O)2Cl]2+的配体分子NH3中N的杂化轨道类型是 , H2O 的键角小于 NH3 , 原因是。(5)、在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是原子。若 NA 表示阿伏加德罗常数的值,则该晶体的密度为g∙cm−3(用含a、c和NA的代数式表示)。晶胞中长、宽为a nm,高为c nm。
 14. 甲、乙、丙、丁四种易溶于水的物质分别由NH、Ba2+、Mg2+、H+、OH-、Cl-、HCO、SO中的不同阳离子和阴离子各一种组成。
14. 甲、乙、丙、丁四种易溶于水的物质分别由NH、Ba2+、Mg2+、H+、OH-、Cl-、HCO、SO中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)、由②可知乙溶液中含有的阴离子是。(2)、写出下列物质化学式:甲;丁。(3)、写出甲与乙反应的离子方程式:。(4)、写出足量的甲与丁反应的离子方程式:。15. 为测定CuSO4溶液的浓度,设计方案如下。回答下列问题:实验原理:
实验步骤:
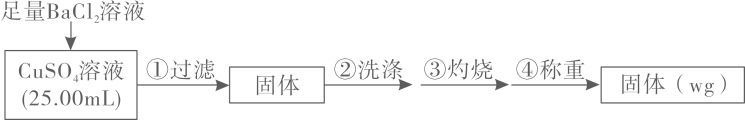 (1)、中S原子杂化轨道类型;的立体构型是;基态铜原子的核外电子排布式为:。(2)、判断沉淀完全的操作为;步骤②判断沉淀是否洗净所选用的试剂为。(3)、步骤③灼烧时盛装样品的仪器名称为。(4)、固体质量为wg,则c(CuSO4)=mol·L−1。(5)、若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。16. 完成关于锰元素的问题。(1)、已知:①(绿色,溶液)
(1)、中S原子杂化轨道类型;的立体构型是;基态铜原子的核外电子排布式为:。(2)、判断沉淀完全的操作为;步骤②判断沉淀是否洗净所选用的试剂为。(3)、步骤③灼烧时盛装样品的仪器名称为。(4)、固体质量为wg,则c(CuSO4)=mol·L−1。(5)、若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。16. 完成关于锰元素的问题。(1)、已知:①(绿色,溶液)②(无色,溶液)
锰有多种化合价,如+7、+6、+4、+2价等,在中性溶液里高锰酸钾的还原产物一般为(填化学式)。
(2)、查阅资料:(未配平,Xe是稀有气体)。已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为。在盛有溶液的试管中加入适量 , 振荡试管,可能观察到的现象是:。(3)、草酸(H2C2O4 , 二元弱酸)晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。离子反应方程式为:。(4)、以铅蓄电池为电源电解酸化的溶液,可制备。铅蓄电池的总反应方程式为:;当蓄电池中有被消耗时,阳极上的理论产量为g.(5)、催化分解: , 其反应机理如下: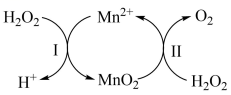
①已知反应Ⅱ为: , 写出反应Ⅰ的热化学方程式(焓变用和表示):。
②某温度时,向10mL0.4mol/LH2O2液中滴入1滴发生上述分解反应,测得不同时刻生成的体积(已折算为标准状况下体积)如下表:
t/min
0
2
4
6
V(O2)/mL
0
9.9
17.2
22.4
时反应速率比时的慢,其原因是:。的平均反应速率v(H2O2)= (忽略溶液体积变化)。