浙教版2021-2022科学八年级下册第二章微粒的模型与符号单元检测卷
试卷更新日期:2022-04-02 类型:单元试卷
一、单选题
-
1. 下列是公交车上常见的警示图,属于提醒乘客防止因惯性造成后果的是( )A、
 B、
B、 C、
C、 D、
D、 2. 氚是氢的一种同位素,氚原子中含有1个质子和2个中子,下列示意图能正确表示氚原子结构的是( )
2. 氚是氢的一种同位素,氚原子中含有1个质子和2个中子,下列示意图能正确表示氚原子结构的是( )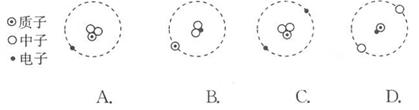 A、A B、B C、C D、D3. 俄罗斯科学家利用第72号元素铪和第74号元素钨精确测定出月球至少比地球早700万年形成。铪和钨两种元素的原子不同的本质是( )A、质子数 B、电子数 C、中子数 D、最外层电子数4. 下列说法正确的是( )
A、A B、B C、C D、D3. 俄罗斯科学家利用第72号元素铪和第74号元素钨精确测定出月球至少比地球早700万年形成。铪和钨两种元素的原子不同的本质是( )A、质子数 B、电子数 C、中子数 D、最外层电子数4. 下列说法正确的是( )①地壳中含量最多的金属元素是铝,也就是金属铝
②人体中只含有非金属元素,没有金属元素
③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关
④地壳中非金属元素的总含量大于金属元素,种类少于金属元素
A、①③④ B、②③④ C、③④ D、①②5. 元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元素符号表示的意义解释正确的是( )选项
元素符号
元素符号所表示的意义
A
H
只表示氢元素
B
Fe
表示铁元素,表示一个铁原子,表示铁这种物质
C
N
只表示一个氮原子
D
O
表示氧元素,表示一个氧原子,表示氧气这种物质
A、A B、B C、C D、D6. 下列物质的化学式书写正确的是( )A、硫酸钠Na2SO4 B、氯化钙CaCl C、氦气He2 D、氧化铁FeO7. 山林里空气中的自由电子附着在氧分子,上形成负氧离子( ),被称为“空气维生素”,那么 的相对分子质量是( )A、16 B、32 C、32克 D、338. 关于下列四种分子的分析不正确的是( ) A、一个水分子和一个二氧化碳分子都由三个原子构成 B、比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成 C、原子都比分子体积小 D、比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成9. 借助“模型”可以帮助我们认识物质的奥秘。下列对如图所示模型的分析不正确的是( )
A、一个水分子和一个二氧化碳分子都由三个原子构成 B、比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成 C、原子都比分子体积小 D、比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成9. 借助“模型”可以帮助我们认识物质的奥秘。下列对如图所示模型的分析不正确的是( )
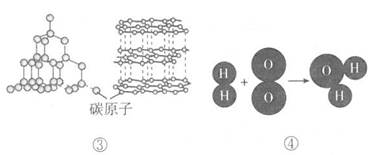 A、①表示的粒子不显电性 B、②表示的物质是化合物 C、③表示的两种物质化学性质相同 D、④表示化学反应的本质是生成新物质10. 某矿石样本含有如图所示的四种元素,该矿石中可能含有的物质是( )
A、①表示的粒子不显电性 B、②表示的物质是化合物 C、③表示的两种物质化学性质相同 D、④表示化学反应的本质是生成新物质10. 某矿石样本含有如图所示的四种元素,该矿石中可能含有的物质是( )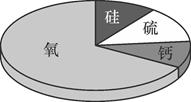 A、CaCl2 B、SiO2 C、H2O D、Fe2O311. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法中正确的是( )
A、CaCl2 B、SiO2 C、H2O D、Fe2O311. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法中正确的是( ) A、原子序数:C<B B、核内质子数:A= E C、A,B,C同周期 D、D,E同族12. 对下列化学符号中数字“2”所表示的意义的描述中,不正确的是( )A、2K+中“2”表示钾离子的个数是2 B、H2SO4中“2”表示每个硫酸分 子中含有2个氢原子 C、Ca(OH)2 中“2”表示一个氢氧化钙粒子中有2个氢氧根离子 D、Cu2+中“2”表示铜元素的化合价为+213. 某同学测得海水中含有Cl-的质量分数为2.19%,如果其中的Cl-全部以NaCl计算,则海水中所含NaCl的质量分数是( )A、2.18% B、5.85% C、3.61% D、4.19%14. 用“∞”和“
A、原子序数:C<B B、核内质子数:A= E C、A,B,C同周期 D、D,E同族12. 对下列化学符号中数字“2”所表示的意义的描述中,不正确的是( )A、2K+中“2”表示钾离子的个数是2 B、H2SO4中“2”表示每个硫酸分 子中含有2个氢原子 C、Ca(OH)2 中“2”表示一个氢氧化钙粒子中有2个氢氧根离子 D、Cu2+中“2”表示铜元素的化合价为+213. 某同学测得海水中含有Cl-的质量分数为2.19%,如果其中的Cl-全部以NaCl计算,则海水中所含NaCl的质量分数是( )A、2.18% B、5.85% C、3.61% D、4.19%14. 用“∞”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( ) 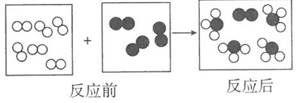 A、该反应前后原子种类和数目没有改变,所以属于化学变化 B、该反应生成了两种物质 C、参加反应的物质在反应前后元素的化合价都发生了改变 D、参加反应的“∞”和“
A、该反应前后原子种类和数目没有改变,所以属于化学变化 B、该反应生成了两种物质 C、参加反应的物质在反应前后元素的化合价都发生了改变 D、参加反应的“∞”和“ ”分子的个数比是2:1
15. 联合国将2019年定为“国际化学元素周期表年”。锶、镁元素在元素周期表中的部分信息及原子结构示意图如图,下面说法正确的是( )
”分子的个数比是2:1
15. 联合国将2019年定为“国际化学元素周期表年”。锶、镁元素在元素周期表中的部分信息及原子结构示意图如图,下面说法正确的是( )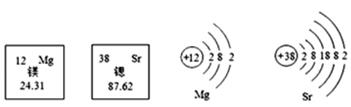 A、这两种元素的化学性质差异很大 B、锶原子的中子数为38 C、锶的氧化物化学式为SrO D、镁的相对原子质量为24.31g16. 某元素R的化合价是奇数(不变化合价),已知其与氧结合形成的化合物的相对分子质量为m,其与氯结合形成的化合物的相对分子质量为n,则R的化合价为( )A、2(m-n)/55 B、2(n- m)/55 C、(2m-n)/55 D、(2n- m)/5517. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S18. 将乙酸(CH3COOH)和葡萄糖(C6H12O6)溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为( )A、1-9a B、1-8a C、12a D、8a19. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、20. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )A、1-1.75a% B、1.75a% C、1.25a% D、无法计算
A、这两种元素的化学性质差异很大 B、锶原子的中子数为38 C、锶的氧化物化学式为SrO D、镁的相对原子质量为24.31g16. 某元素R的化合价是奇数(不变化合价),已知其与氧结合形成的化合物的相对分子质量为m,其与氯结合形成的化合物的相对分子质量为n,则R的化合价为( )A、2(m-n)/55 B、2(n- m)/55 C、(2m-n)/55 D、(2n- m)/5517. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S18. 将乙酸(CH3COOH)和葡萄糖(C6H12O6)溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为( )A、1-9a B、1-8a C、12a D、8a19. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、20. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )A、1-1.75a% B、1.75a% C、1.25a% D、无法计算二、填空题
-
21. 如图是锂原子的结构示意图,根据图示信息回答下列问题:
 (1)、锂元素的原子序数为。(2)、锂原子核内有个质子,核外有个电子。(3)、下列对原子构成的理解错误的是 (填字母)。A、原子整体不显电性 B、原子核比原子小得多 C、原子核是不可分割的实心球体 D、原子质量主要集中在原子核上22. 元素的中文名称造字有规律,一般可从它们的偏旁判断元素的分类。(1)、有“金”字旁的是金属元素,其中(填元素符号)例外,通常状况下它是液态,该金属蒸气有毒性,这属于它的(填“物理”或“化学”)性质。(2)、有“石”字旁的是固态非金属元素,S可表示:① , ② , ③ 。三个硫原子的符号为。23. 数字在化学式中的不同位置表示不同的意义:①表示微粒的数目;②表示元素的化合价;③表示离子的电荷数;④表示每个分子中所含原子的个数。请你判断下列化学式中的“2”分别表示的含义。(填序号)
(1)、锂元素的原子序数为。(2)、锂原子核内有个质子,核外有个电子。(3)、下列对原子构成的理解错误的是 (填字母)。A、原子整体不显电性 B、原子核比原子小得多 C、原子核是不可分割的实心球体 D、原子质量主要集中在原子核上22. 元素的中文名称造字有规律,一般可从它们的偏旁判断元素的分类。(1)、有“金”字旁的是金属元素,其中(填元素符号)例外,通常状况下它是液态,该金属蒸气有毒性,这属于它的(填“物理”或“化学”)性质。(2)、有“石”字旁的是固态非金属元素,S可表示:① , ② , ③ 。三个硫原子的符号为。23. 数字在化学式中的不同位置表示不同的意义:①表示微粒的数目;②表示元素的化合价;③表示离子的电荷数;④表示每个分子中所含原子的个数。请你判断下列化学式中的“2”分别表示的含义。(填序号)Ca2+:;2N:;SO2:; :。
24. 请你认真观察、分析对比下面示意图并回答问题。 (1)、水分解是变化,水汽化是变化。(2)、从微观角度分析,上述两种变化的根本区别是。(3)、由此分析,分子与原子的区别是。25. 元素的阳离子结构示意图为
(1)、水分解是变化,水汽化是变化。(2)、从微观角度分析,上述两种变化的根本区别是。(3)、由此分析,分子与原子的区别是。25. 元素的阳离子结构示意图为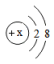 , 元素的阴离子比多8个电子,与形成的化合物为 , 与形成的化含物的化分式为 , 请回答: , 26. 1869 年,门捷列夫发现了元素周期律,使得科学学习和研究变得有规律可循。如图列出的是1~18号元素的部分最高正化合价和最低负化合价。请回答下列问题。
, 元素的阴离子比多8个电子,与形成的化合物为 , 与形成的化含物的化分式为 , 请回答: , 26. 1869 年,门捷列夫发现了元素周期律,使得科学学习和研究变得有规律可循。如图列出的是1~18号元素的部分最高正化合价和最低负化合价。请回答下列问题。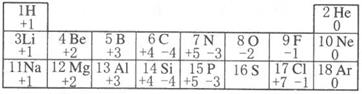 (1)、12号元素属于(填“金属”或“非金属”)元素,它在化学反应中形成的离子是(填离子符号)。(2)、16号元素的原子核外电子数为 , 推测该元素最高正化合价为 , 其最低负化合价的粒子与氢形成的化合物的化学式为。(3)、从图中我们可以发现一些规律:(写一条即可)。27. 某化合物的化学式为HnRO2n+1 , 其相对分子质量为A,则R的相对原子质量为。R元素的化合价为 , 原子团RO2n+1的化合价为。当R的化合价不变时,其与氧元素组成的化合物的化学式为 ,相对分子质量是。
(1)、12号元素属于(填“金属”或“非金属”)元素,它在化学反应中形成的离子是(填离子符号)。(2)、16号元素的原子核外电子数为 , 推测该元素最高正化合价为 , 其最低负化合价的粒子与氢形成的化合物的化学式为。(3)、从图中我们可以发现一些规律:(写一条即可)。27. 某化合物的化学式为HnRO2n+1 , 其相对分子质量为A,则R的相对原子质量为。R元素的化合价为 , 原子团RO2n+1的化合价为。当R的化合价不变时,其与氧元素组成的化合物的化学式为 ,相对分子质量是。三、实验探究题
-
28.
卢瑟福用a粒子(α粒子是带两个单位正电荷的氦原子核)轰击金箔的实验,推翻了汤姆生在1903年提出的原子结构模型,为建立现代原子理论打下了基础,但通过该实验的下述三种现象(如图),不能获得核外电子带有负电荷的结论。
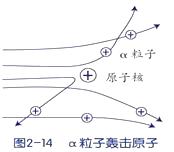
现象1:大多数α粒子能穿透金箔而不改变原来运动方向。
现象2:一小部分α粒子改变原来的运动方向。
现象3:极少数α粒子被弹了回来。
(1)、请你根据原子结构知识分析以上现象产生的原因。①现象1的原因:
②现象2的原因:
(2)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是 。
29. 核事故中往往泄漏出污染物131I(具有放射性的碘原子)。为避免核辐射,需一次性口服100 mg 127I(不具放射性的碘原子),使人体甲状腺中的碘达到饱和而不再吸收外界的碘,从而起到保护作用。请回答下列问题:
(1)、131I是一种质子数为53、中子数为78的碘原子。该原子核外电子数为。(2)、131I与127I的关系是 (填字母)。A、同种元素 B、同种物质 C、同种分子 D、同种原子(3)、假设所处的环境已受污染,通过服用加碘食盐(注:加碘食盐中的碘为碘元素)的方法能否有效起到避免核辐射的目的呢?[查阅资料]成人每天食用食盐的质量通常为6 g,
某种加碘食盐的标签如图所示。

[问题分析]500 g该品牌食盐中,含碘的最大质量是;若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐。
[结论]日常服用加碘食盐(填“能”或“不能”)起到避免核辐射的目的,原因是。
(4)、专家指出,服用碘片(有效成分为KI)可以治疗”131I造成的辐射,但服用碘酒(有效成分为I2)却会引起碘中毒。KI和I2性质不同的原因是。四、解答题
-
30. 硝酸铵是农业生产中广泛使用的氮肥,根据硝酸铵的化学式(NH4NO3)进行计算:(1)、硝酸铵的相对分子质量是。(2)、硝酸铵中氮、氢、氧三种元素的质量比是。(3)、500g硝酸铵中含氮元素g;g硝酸铵中含氮元素14 g。(4)、多少克硝酸铵中所含氮元素的质量和120 g尿素[CO(NH2)2]中所含氮元素的质量相等?31. 大多数厨师炒菜时,既加料酒又加醋,可使菜变得香美可口,原因是醋中的乙酸与料酒中的乙醇生成乙酸乙酯。下表中是几种常见的酯,请完成下列问题:
酯的名称
甲酸甲酯
甲酸乙酯
乙酸甲酯
乙酸乙酯
化学式
C2H4O2
C3H6O2
C3H6O2
X
(1)、甲酸甲酯(C2H4O2)中碳元素、氢元素、氧元素的质量比为。(2)、甲酸乙酯(C3H6O2)中碳元素的质量分数为(计算结果精确到0.1%)。(3)、含3.2g氧元素的乙酸甲酯的质量是多少?(写出计算过程)(4)、比较归纳是学习化学的重要方法,据表推测X的化学式为。