云南省2022届高三第一次统一检测(一模)理综化学试题
试卷更新日期:2022-03-29 类型:高考模拟
一、单选题
-
1. 2022年北京呈现给世界的冬奥盛宴尽显科技魅力。下列叙述不正确的是( )
A
B
C
D




奥运火炬使用氢燃料可实现“碳零排放”
当光束通过气溶胶时会出现丁达尔效应
“冰墩墩”的外套材料硅橡胶(聚合物)属于混合物
“冰丝带”幕墙由玻璃拼装而成,玻璃与光纤的成分相同
A、A B、B C、C D、D2. 下列叙述正确的( )A、环丙烷的一氯代物有3种 B、可用溴水鉴别苯、苯乙烯和乙酸 C、乙醇和丙三醇都含羟基,互为同系物 D、乙烯使高锰酸钾溶液褪色发生加成反应3. NA为阿伏加德罗常数的值。下列说法不正确的是( )A、标准状况下,2.24L CH4所含质子数为NA B、17.1g Ba(OH)2中所含的极性共价键数目为0.2NA C、1L 0.1mol·L-1 FeCl3溶液中,所含阳离子的数目为0.1NA D、SO2与O2反应,每转移1mol电子,生成SO3的分子数为0.5NA4. 利用下列选项中提供的仪器(夹持仪器、部分试剂省略),能完成对应实验的是( )选项
实验仪器
实验目的
A
酸碱通用滴定管、锥形瓶
用标准NaOH溶液测定待测盐酸的浓度
B
分液漏斗、烧杯
提取溴的CCl4溶液中的溴单质
C
酒精灯、玻璃棒
利用焰色反应检验溶液中含有K+
D
250mL容量瓶、玻璃棒
配制250mL0.1mol·L-1碳酸钠溶液
A、A B、B C、C D、D5. X、Y、Z、W是原子序数依次增大的短周期主族元素,X位于第VA族,Y是短周期中原子半径最大的主族元素,Z的一种氧化物具有漂白作用。下列说法正确的是( )A、简单离子半径:X<Y<Z<W B、最高价氧化物对应水化物的酸性:Z<W C、化合物YX3中只含共价键 D、Y2Z的水溶液中lg=06. 锌-空气二次电池在柔性能源方面应用较多,是各类新能源电池中备受关注的储能设备之一。一种强碱性锌-空气电池工作示意图如下。下列说法正确的是( ) A、电流从Zn电极流出 B、OH-向气体扩散电极移动 C、隔膜应选择化学性质活泼的氢氧根离子选择性膜 D、负极区的反应为:Zn-2e-+4OH-= , =ZnO+2OH-+H2O7. 已知:T℃,Ksp(CaF2)=5×10-10;pCa=-lgc(Ca2+)。T℃下,向10.0mL0.1mol·L-1CaCl2溶液中滴加0.1mol·L-1NaF溶液,溶液中pCa与NaF溶液体积的关系如图所示。下列说法不正确的是( )
A、电流从Zn电极流出 B、OH-向气体扩散电极移动 C、隔膜应选择化学性质活泼的氢氧根离子选择性膜 D、负极区的反应为:Zn-2e-+4OH-= , =ZnO+2OH-+H2O7. 已知:T℃,Ksp(CaF2)=5×10-10;pCa=-lgc(Ca2+)。T℃下,向10.0mL0.1mol·L-1CaCl2溶液中滴加0.1mol·L-1NaF溶液,溶液中pCa与NaF溶液体积的关系如图所示。下列说法不正确的是( ) A、m=4-lg5 B、a点和c点的Ksp相等 C、若改用0.05mol·L-1NaF溶液,则b点向右平移 D、c点溶液中存在c(Cl-)+c(F-)+c(OH-)=c(Na+)+c(H+)
A、m=4-lg5 B、a点和c点的Ksp相等 C、若改用0.05mol·L-1NaF溶液,则b点向右平移 D、c点溶液中存在c(Cl-)+c(F-)+c(OH-)=c(Na+)+c(H+)二、综合题
-
8. 乙酸酐在有机合成工业中有广泛的应用。实验室利用如下方法制备少量乙酸酐。实验原理(反应1、反应2已配平):
反应1:CH3COOH+SOCl2→CH3COCl+X↑+Y↑ ΔH<0
反应2:CH3COCl+CH3COOH→(CH3CO)2O+HCl↑ ΔH<0
已知:有关物质的部分信息如下。
物质
沸点/℃
相对分子质量
理化性质
乙酸(CH3COOH)
118
60
易溶于水和有机溶剂
二氯亚砜(SOCl2)
79
119
遇水水解,受热易分解
乙酰氯(CH3COCl)
51
78.5
遇水或乙醇剧烈分解
乙酸酐[(CH3CO)2O]
139.6
102
遇水形成乙酸,易溶于有机溶剂
实验步骤:
I.将21.0g冰醋酸加入到三颈烧瓶中,再分批缓慢加入21.0gSOCl2 , 控制反应温度35℃,搅拌回流2小时。
II.将三颈烧瓶中的混合物转移至另一烧瓶中,提纯,收集到较纯的乙酸酐12.0g(其中乙酸酐占90.0%)。
实验装置如图所示:
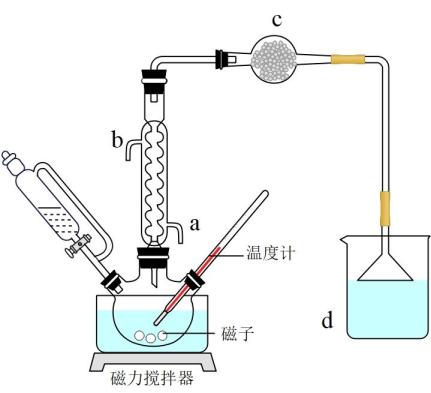
回答下列问题:
(1)、仪器c的名称是 , 冷凝管的进水口是(填字母)。(2)、反应1生成的X和Y均为酸性气体,其化学式为和。(3)、步骤I中,控制反应温度在35℃左右,不宜过高的原因是。(4)、c中盛放无水氯化钙,主要作用是 , d中盛放的试剂是。(5)、步骤II中,从混合物中提纯乙酸酐应采取的操作名称是。(6)、该方法制得乙酸酐的产率是%(保留1位小数)。9. 碳捕集、将CO2转化为C2H4、C2H5OH等高附加值化学品,是实现碳中和目标的重要方式。回答下列问题:(1)、早期,工业上用热钾碱(K2CO3)溶液吸收烟气中的CO2。该反应在加压下进行的目的是。(2)、1972年,Fox利用C2H6(g)+CO2(g)→C2H4(g)+H2O(g)+CO(g) ΔH,将CO2转化为C2H4。①上述反应的能量变化如图所示,则ΔH=kJ·mol-1。

②某温度下,等物质的量的C2H6和CO2在刚性容器内发生上述反应,tmin时达到平衡。已知起始总压为akPa,平衡时总压为bkPa,0~tmin的平均反应速率为v(CO2)=kPa·min-1 , 该反应的平衡常数Kp=(用含a、b的代数式表示),欲提高CO2的平衡转化率,可采取的措施有(填标号)。
A.通入惰性气体 B.增加C2H6浓度 C.增加CO2浓度 D.降低温度
③2000年,我国学者研究CeO2催化上述反应的过程为:
(i)2CeO2+C2H6=Ce2O3+C2H4+H2O
(ii)(写出化学方程式)。
(3)、2020年,我国学者利用电化学装置将CO2高效转化为C2H4和C2H5OH,其原理如图所示:
①阳极的电极反应式为。
②标准状况下,若消耗2.24LCO2 , 转移电子个数为。
10. 钼催化剂常用于合成氨工业,以废钼催化剂(主要含有MoS2和Al2O3)为原料制备钼酸钠晶体和硫酸钠晶体的一种工艺流程如下图所示。回答下列问题: (1)、为了提高“焙烧”效率,可采用的措施为(写一条即可),“焙烧”反应中氧化剂与还原剂物质的量之比为。(2)、“水溶”时,钼浸取率与浸取时间、浸取温度的关系如下图所示,综合考虑成本等因素,则最佳浸取时间和浸取温度为。
(1)、为了提高“焙烧”效率,可采用的措施为(写一条即可),“焙烧”反应中氧化剂与还原剂物质的量之比为。(2)、“水溶”时,钼浸取率与浸取时间、浸取温度的关系如下图所示,综合考虑成本等因素,则最佳浸取时间和浸取温度为。 (3)、“调pH”时,生成Al(OH)3的离子方程式为 , 调节pH不能过低的原因是。(4)、“操作I”的名称为;“溶液1”中含有大量Na2SO4和少量Na2MoO4 , 根据下图分析“结晶”过程的操作为(填标号)。
(3)、“调pH”时,生成Al(OH)3的离子方程式为 , 调节pH不能过低的原因是。(4)、“操作I”的名称为;“溶液1”中含有大量Na2SO4和少量Na2MoO4 , 根据下图分析“结晶”过程的操作为(填标号)。
A.蒸干溶剂
B.蒸发水分至有大量晶体析出时,趁热过滤
C.蒸发浓缩,冷却至10℃左右
(5)、碱性条件下,将废钼催化剂加入NaClO溶液中,也可制备钼酸钠,同时生成硫酸盐,该反应的离子方程式为。11. (CH3NH3)PbI3作为最典型的有机金属卤化物,一直是太阳能电池研究的宠儿。回答下列问题:(1)、基态Pb原子的价电子排布式为 , N能层电子数有个。(2)、中第一电离能最大的元素是(填元素符号),该离子中的化学键是由(填标号)原子轨道重叠形成的。a.sp2与sp2 b.sp3与sp c.sp3与sp3 d.sp3与s e.s与s
(3)、的VSEPR模型如下图,中心I原子的杂化方式是(填“sp3”、“sp”、“sp3d”或“sp3d2”)。的空间构型为。 (4)、PbF4的熔点显著高于PbCl4的原因是。(5)、(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示),Pb2+周围距离最近且相等的I-数目有个。若将A离子作为晶胞的体心另取晶胞Y,则I处于晶胞Y中的 , 晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=g▪cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(4)、PbF4的熔点显著高于PbCl4的原因是。(5)、(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示),Pb2+周围距离最近且相等的I-数目有个。若将A离子作为晶胞的体心另取晶胞Y,则I处于晶胞Y中的 , 晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=g▪cm-3(列出计算式,设NA为阿伏加德罗常数的值)。 12. 心脑血管药物中间体H的一种合成路线如下图所示:
12. 心脑血管药物中间体H的一种合成路线如下图所示:
已知Hantzsch合成:

回答下列问题:
(1)、A的化学名称为;F中所含官能团的名称为氨基、。(2)、A与CH3CN反应可以生成B和相对分子质量为32的一元醇,则由A生成B的化学方程式为。(3)、由B生成D的反应类型为 , D的结构简式为。(4)、与有机物B( )官能团完全相同的同分异构体有种(不考虑立体异构)。 (5)、H中的手性碳原子(与四个各不相同原子或基团相连的碳原子)有个。(6)、中间产物G的结构简式为。
)官能团完全相同的同分异构体有种(不考虑立体异构)。 (5)、H中的手性碳原子(与四个各不相同原子或基团相连的碳原子)有个。(6)、中间产物G的结构简式为。