四川省南充市2022届高三 适应性考试(二模)理综化学试题
试卷更新日期:2022-03-29 类型:高考模拟
一、单选题
-
1. 第24届冬奥会于2022年2月4日在北京开幕,“科技冬奥”理念,体现在方方面面。下列说法不正确的是( )A、冬奥会火炬“飞扬”以耐高温碳纤维为外壳,吉祥物,“冰墩墩”以聚乙烯为原材料,碳纤维和聚乙烯均为有机高分子材料 B、冬奥会采用氢燃料电池车,并开发了全新的车载光伏发电系统,体现了“绿色出行”的理念 C、冰场使用的二氧化碳跨临界制冰技术,比传统的氟利昂人工制冷技术更加节能、环保 D、冬奥会上采用紫外杀菌技术对手机和笔记本电脑进行消毒,这是利用紫外线使蛋白质变性的原理2. NA是阿伏加德罗常数的值,下列说法正确的是( )A、相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 B、1molLi3N与过量水反应收集的气态氨分子数目为NA C、Na2CO3溶液中Na+和个数比为2:1 D、标况下,1molN2和O2的混合气体总体积约为22.4L3. 莽草酸是合成治疗禽流感的药物—达菲(Tamiflu)的原料之一、其结构简式如图,下列才关葬草酸分子的说法正确的是( )
 A、属于芳香族化合物 B、该物质能发生加成反应、氧化反应、取代反应 C、该物质存在含苯环的同分异构体 D、1mol该有机物最多能与4molNaOH发生中和反应4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是内层电子总数的一半,W、Z同主族;X与Y在周期表中处于相邻位置,Y的简单氢化物的水溶液可用于刻蚀玻璃,下列说法正确的是( )A、Y是形成最高价含氧酸酸性最强的元素 B、W常用作手机电池的电极材料 C、简单离子半径Y<Z D、X、Z两种元素形成的化合物只含离子键5. 下列实验操作能达到实验目的是( )
A、属于芳香族化合物 B、该物质能发生加成反应、氧化反应、取代反应 C、该物质存在含苯环的同分异构体 D、1mol该有机物最多能与4molNaOH发生中和反应4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是内层电子总数的一半,W、Z同主族;X与Y在周期表中处于相邻位置,Y的简单氢化物的水溶液可用于刻蚀玻璃,下列说法正确的是( )A、Y是形成最高价含氧酸酸性最强的元素 B、W常用作手机电池的电极材料 C、简单离子半径Y<Z D、X、Z两种元素形成的化合物只含离子键5. 下列实验操作能达到实验目的是( ) A、用甲装置验证SO2的漂白性 B、用乙装置蒸发结晶NaCl溶液 C、用丙装置测定化学反应速率 D、用丁装置量取10.00mL的盐酸溶液6. 污水资源化利用既可以缓解水的供需矛盾,又可以减少水污染。化学工作者提出采用电解法除去工业污水中的NaCN,其原理如图所示,通电前先向污水中加入适量食盐并调整其pH维持碱性(CN-不参与电极反应)。下列说法正确的是( )
A、用甲装置验证SO2的漂白性 B、用乙装置蒸发结晶NaCl溶液 C、用丙装置测定化学反应速率 D、用丁装置量取10.00mL的盐酸溶液6. 污水资源化利用既可以缓解水的供需矛盾,又可以减少水污染。化学工作者提出采用电解法除去工业污水中的NaCN,其原理如图所示,通电前先向污水中加入适量食盐并调整其pH维持碱性(CN-不参与电极反应)。下列说法正确的是( ) A、b为电源的负极 B、隔膜I为阴离子交换膜 C、x为H2 , 电极反应为:2H2O+2e-=H2↑+2OH- D、当生成2.24LN2时,电路中通过1mol电子7. 常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中分别加入NaOH固体,lg随加入NaOH的物质的量的变化情况如图所示。下列叙述不正确的是( )
A、b为电源的负极 B、隔膜I为阴离子交换膜 C、x为H2 , 电极反应为:2H2O+2e-=H2↑+2OH- D、当生成2.24LN2时,电路中通过1mol电子7. 常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中分别加入NaOH固体,lg随加入NaOH的物质的量的变化情况如图所示。下列叙述不正确的是( ) A、a点由水电离出的=1×10-13mol/L B、HY溶液导电性先减弱后增强 C、当n(HY):n(NaY)=1:1混合配成溶液,pH=4 D、b点溶液中: =
A、a点由水电离出的=1×10-13mol/L B、HY溶液导电性先减弱后增强 C、当n(HY):n(NaY)=1:1混合配成溶液,pH=4 D、b点溶液中: =二、综合题
-
8. 硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域。某实验小组制备硫代硫酸钠并探究其性质。(1)、Ⅰ:硫代硫酸钠的制备
实验小组设计如下装置制备硫代硫酸钠

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2S2O3中S元素的化合价分别为-2和+6
仪器a的名称是。A中发生的化学反应方程式为。
(2)、为了保证Na2S2O3的产量,实验中通入的SO2不能过量,需控制A中SO2的生成速率,采取的措施是。(3)、Ⅱ:产品纯度的测定①溶液配制:准确取该硫代硫酸钠样品2.0000g,配制成250mL溶液。
②滴定:向锥形瓶中加入20.00mL0.01mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应: +5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2 = +2I-。
滴定终点现象为 , 消耗样品溶液的用量为25.00mL,则样品纯度为%(保留1位小数)
(4)、Ⅲ:硫代硫酸钠性质的探究①取Na2S2O3晶体,溶解,配成0.2mol/L溶液。
②取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2: (不考虑空气中氧气氧化)。
设计实验方案:

假设2是。
(5)、第②组实验中胶头滴管加入的试剂是。胶头滴管
现象
第①组
1mL饱和氯水
立即出现浑浊
第②组
一段时间后出现浑浊,且浑浊度比①组
(6)、依据现象,S产生的主要原因是。9. 实现碳中和成为各国科学家的研究重点,将二氧化碳转化为绿色液体燃料甲醇是一个重要方向。甲醇的制备原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
(1)、工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为。(2)、甲醇的制备反应一般认为通过如下两步来实现:①CO2(g)+H2(g) CO(g)+H2O(g)kJ/mol
②CO(g)+2H2(g) CH3OH(g)kJ/mol
根据盖斯定律,该反应的kJ·mol-1 , 反应能在(填“高温”或“低温”)自发进行。
(3)、为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2 , 进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:①反应开始到平衡,v(H2)=。
②该温度下的平衡常数K=(mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图像正确的是。
 (4)、我国科学家制备了一种ZO-ZrO2催化剂,实现CO2高选择性合成CH3OH。气相催化合成过程中,CO2转化率(x)及CH3OH选择性(S)随温度的变化曲线如图。
(4)、我国科学家制备了一种ZO-ZrO2催化剂,实现CO2高选择性合成CH3OH。气相催化合成过程中,CO2转化率(x)及CH3OH选择性(S)随温度的变化曲线如图。
①生成CH3OH的最佳温度约为。
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因:。
(5)、研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g) HCOOH(g)<0。在一容积固定的密闭容器中进行反应,实验测得: , 、为速率常数。温度为T1℃时,该反应K=2,温度为T2℃时, , 则T2℃时平衡压强(填“>”“<”或“=”)T1℃时平衡压强,理由是。10. 某兴趣小组用铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备K2Cr2O7晶体,流程如下: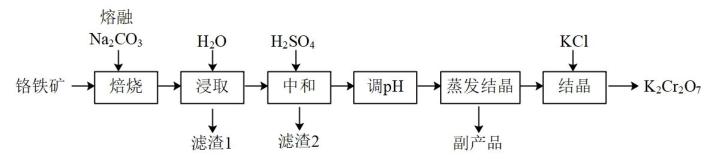 (1)、焙烧的目的是将FeCr2O4转化为Na2CrO4 , 并将Al、Si氧化物转化为可溶性钠盐。焙烧时气体与矿料逆流而行,目的是。该步骤不能使用陶瓷容器,原因是。(2)、滤渣2的主要成分是Al(OH)3和。(3)、流程中调溶液的pH使之变(填“大”或“小”),原因是(用离子方程式表示)。(4)、蒸发结晶所产生的副产品是。(5)、为结晶得到杂质较少的K2Cr2O7粗产品,请结合下图从下列选项中选出合理的操作并排序。
(1)、焙烧的目的是将FeCr2O4转化为Na2CrO4 , 并将Al、Si氧化物转化为可溶性钠盐。焙烧时气体与矿料逆流而行,目的是。该步骤不能使用陶瓷容器,原因是。(2)、滤渣2的主要成分是Al(OH)3和。(3)、流程中调溶液的pH使之变(填“大”或“小”),原因是(用离子方程式表示)。(4)、蒸发结晶所产生的副产品是。(5)、为结晶得到杂质较少的K2Cr2O7粗产品,请结合下图从下列选项中选出合理的操作并排序。
a.50℃蒸发溶剂
b.100℃蒸发溶剂
c.抽滤
d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
f.蒸发至溶液出现大量晶体,停止加热
(6)、该小组用m1kg铬铁矿(FeCr2O460%)制备K2Cr2O7 , 最终得到产品m2kg,产率为(列出计算式)。11. NH3与甲醛CH2O反应可以制备乌洛托品(六亚甲基四胺,分子结构为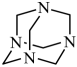 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题: (1)、基态氮原子的价电子轨道表达式为 , 第三电离能I3(C)I3(N)(填“>”或“<)。(2)、NH3的空间构型为 , CH2O中C采取的杂化类型为。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是。(3)、乌洛托品为(填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈几何体分布,该分子可与H+形成配位键,电子对给予体为原子。(4)、在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为。乌洛托品比金刚烷(C10H16
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题: (1)、基态氮原子的价电子轨道表达式为 , 第三电离能I3(C)I3(N)(填“>”或“<)。(2)、NH3的空间构型为 , CH2O中C采取的杂化类型为。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是。(3)、乌洛托品为(填“极性”或“非极性”)分子,分子中的所有N原子呈正四面体分布,所有C原子呈几何体分布,该分子可与H+形成配位键,电子对给予体为原子。(4)、在乌洛托品晶体中,分子采取体心立方堆积,其分子配位数为。乌洛托品比金刚烷(C10H16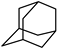 )水溶性更高,理由是。 (5)、金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3 , 阿伏加德罗常数为L×1023mol-1 , 则晶体的密度为g/cm3。
)水溶性更高,理由是。 (5)、金刚烷晶体采取分子密堆积、晶胞结构如图所示,若晶胞体积为Vnm3 , 阿伏加德罗常数为L×1023mol-1 , 则晶体的密度为g/cm3。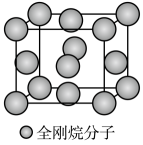 12. 苯氧乙酸(
12. 苯氧乙酸( )是一种重要的化工原料和制药中间体,下列有关苯氧乙酸衍生物的合成与应用的路线如下。回答下列有关问题:
)是一种重要的化工原料和制药中间体,下列有关苯氧乙酸衍生物的合成与应用的路线如下。回答下列有关问题: (1)、试剂BrCH2COOCH3中的含氧官能团名称为。C的核磁共振氢谱中,除苯环上的氢外有组峰。(2)、写出苯酚A与K2CO3反应产物有和。化合物B的分子式为C9H10O3 , B的化学名称为。(3)、B生成C步骤的反应类型为 , D的分子式为。(4)、化合物E不发生银镜反应,也不与饱和NaHCO3溶液反应,写出E的结构简式。(5)、D在稀酸条件下与过量甲酸反应生成二酯的化学方程式为。(6)、化合物B的同分异构体中,能同时满足下列条件的分子结构有种。
(1)、试剂BrCH2COOCH3中的含氧官能团名称为。C的核磁共振氢谱中,除苯环上的氢外有组峰。(2)、写出苯酚A与K2CO3反应产物有和。化合物B的分子式为C9H10O3 , B的化学名称为。(3)、B生成C步骤的反应类型为 , D的分子式为。(4)、化合物E不发生银镜反应,也不与饱和NaHCO3溶液反应,写出E的结构简式。(5)、D在稀酸条件下与过量甲酸反应生成二酯的化学方程式为。(6)、化合物B的同分异构体中,能同时满足下列条件的分子结构有种。a.苯环上只有两个对位取代基;
b.能与新制Cu(OH)2反应,产生砖红色沉淀;
c.与FeCl3发生显色反应;
d.可发生水解反应。