河北省邯郸市2022届高三下学期一模考试化学试题
试卷更新日期:2022-03-29 类型:高考模拟
一、单选题
-
1. 化学对提高人类生活质量和促进社会发展具有重要作用。运用化学知识对下列选项进行的分析合理的是( )A、石油的分馏、海水晒盐、煤的气化都是物理变化 B、烟熏腊肉中含有丰富的脂肪,脂肪属于酯类,是天然高分子化合物 C、制作湘绣需使用大量的丝绸,古代丝绸所含的天然纤维主要是蚕丝纤维 D、大量排放到空气中,不但能形成酸雨,而且易产生光化学烟雾危害环境2. 下列化学用语表达不正确的是( )A、氯化钙的电子式:
 B、中子数为70、质子数为51的锑(Sb)原子:
C、2-甲基丁烷的键线式:
B、中子数为70、质子数为51的锑(Sb)原子:
C、2-甲基丁烷的键线式: D、NaHS在水溶液中水解的离子方程式:
3. 劳动成就梦想。下列劳动项目与所述的化学知识解释不正确的是( )
D、NaHS在水溶液中水解的离子方程式:
3. 劳动成就梦想。下列劳动项目与所述的化学知识解释不正确的是( )选项
劳动项目
化学知识
A
社区服务(垃圾分类):废纸、塑料、玻璃均属于可回收物
废纸、塑料、玻璃均属于无机非金属材料
B
学农活动:波尔多液可用于防治植物的病虫害
能使蛋白质变性
C
家务劳动:用热的纯碱水溶液刷洗油污
纯碱的水溶液呈碱性,油脂在碱性条件下可水解
D
自主探究:制作西红柿电池
原电池原理
A、A B、B C、C D、D4. 下列除杂试剂和分离方法都正确的是( )选项
物质(括号内为杂质)
除杂试剂
分离方法
A
澄清石灰水
过滤
B
饱和溶液
洗气
C
粉
加热
D
饱和溶液
分液
A、A B、B C、C D、D5. 为阿伏加德罗常数的值。下列说法正确的是( )A、盐酸中含有的阴离子总数为 B、标准状况下,11.2L由和组成的混合气体中分子数为 C、与完全反应时转移的电子数为 D、5.6g铁粉与足量硝酸在加热条件下充分反应后,产生的分子数为6. 下列各组粒子在溶液中可以大量共存,且在加入试剂X后发生反应的离子方程式书写也正确的是( )选项
微粒组
试剂X
发生反应的离子方程式
A
、、、
少量溶液
B
、、、
少量氯水
C
、、、
适量的
D
、、、
适量
A、A B、B C、C D、D7. 某化合物(结构如图所示)可用作酿造酵母的培养剂、强化剂、膨松剂、发酵助剂。已知X、Y、Z、W为元素周期表中前20号元素且位于不同周期,原子序数依次增大,Y为地壳中含量最高的元素。下列有关说法正确的是( ) A、单质的氧化性: B、Z元素形成的单质均为白色固体 C、Y分别与X、Z、W三种元素均可形成至少两种化合物 D、X与Z形成的最简单化合物的沸点比X与Y形成的最简单化合物的沸点高8. 某药物的合成中间体R的结构如图所示,下列有关有机物R的说法正确的是( )
A、单质的氧化性: B、Z元素形成的单质均为白色固体 C、Y分别与X、Z、W三种元素均可形成至少两种化合物 D、X与Z形成的最简单化合物的沸点比X与Y形成的最简单化合物的沸点高8. 某药物的合成中间体R的结构如图所示,下列有关有机物R的说法正确的是( )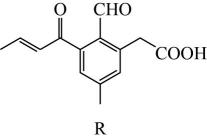 A、分子式为 B、与氢气加成时,最多消耗 C、有5种官能团,其中3种为含氧官能团 D、既能使溴水褪色,又能使酸性高锰酸钾溶液褪色9. 在给定条件下,下列物质间的转化均能一步实现的是( )A、 B、 C、 D、10. 用下列实验装置进行相应实验,其中装置符合题意且能达到实验目的的是( )
A、分子式为 B、与氢气加成时,最多消耗 C、有5种官能团,其中3种为含氧官能团 D、既能使溴水褪色,又能使酸性高锰酸钾溶液褪色9. 在给定条件下,下列物质间的转化均能一步实现的是( )A、 B、 C、 D、10. 用下列实验装置进行相应实验,其中装置符合题意且能达到实验目的的是( )



A.分离和
B.制取氯气
C.配制的溶液
D.酒精萃取碘水中的碘
A、A B、B C、C D、D11. 25℃时,向溶液中逐滴滴入等浓度的溶液,测得溶液的与[Y代表或]的关系如图。下列相关结论正确的是( ) A、曲线a表示与的变化关系 B、25℃时 C、当溶液的时, D、当滴入溶液时,
A、曲线a表示与的变化关系 B、25℃时 C、当溶液的时, D、当滴入溶液时,二、多选题
-
12. 为白色粉末,微溶于水,溶于浓盐酸或浓溶液,不溶于乙醇。往硫酸铜溶液中加入、 , 进行“还原,氯化”时,和的用量对产率的影响如图1、图2所示。下列说法中正确的是( )
 A、反应的离子方程式为 B、为减少的溶解损耗,可用乙醇洗涤沉淀 C、的用量越多,越大,的产率越大 D、易被空气氧化为 , 该反应中氧化剂和还原剂的物质的量之比为1:413. 某科研团队研制并设计了一种基于阳离子型活性分子的中性水系有机液流电池,以和分别作中性水系有机液流电池的正负极材料,已知放电时先转化为 , 后转化为 , 电池工作原理如图所示。下列说法不正确的是( )
A、反应的离子方程式为 B、为减少的溶解损耗,可用乙醇洗涤沉淀 C、的用量越多,越大,的产率越大 D、易被空气氧化为 , 该反应中氧化剂和还原剂的物质的量之比为1:413. 某科研团队研制并设计了一种基于阳离子型活性分子的中性水系有机液流电池,以和分别作中性水系有机液流电池的正负极材料,已知放电时先转化为 , 后转化为 , 电池工作原理如图所示。下列说法不正确的是( )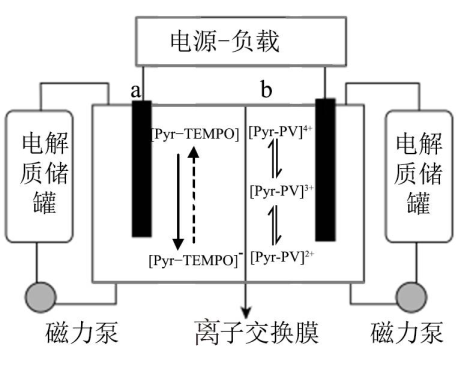 A、放电的过程中,氯离子由b电极向a电极移动 B、放电和充电时的电势均是a电极高于b电极 C、放电时,负极的电极反应式可能为 D、放电时,b电极为负极;充电时,b电极为阳极
A、放电的过程中,氯离子由b电极向a电极移动 B、放电和充电时的电势均是a电极高于b电极 C、放电时,负极的电极反应式可能为 D、放电时,b电极为负极;充电时,b电极为阳极三、综合题
-
14. 五氧化二钒()广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有、、、、、等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
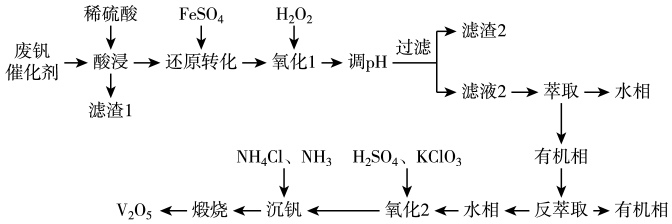
已知:
①“酸浸”时和与稀硫酸反应分别生成和。
②溶液中与可相互转化: , 且为沉淀。
(1)、“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是。(2)、“还原转化”中加入的目的是将转化为 , 写出反应的离子方程式:。(3)、加入的目的是将过量的转化为。“氧化1”后,溶液中含有的金属阳离子主要有、、 , 调节使离子沉淀,若溶液中 , 则调节溶液的最小值为可使沉淀完全(离子浓度≤时沉淀完全),此时(填“有”或“无”)沉淀生成。{假设溶液体积不变, , , }(4)、“氧化2”过程中发生反应的离子方程式为。(5)、“沉钒”时,通入氨气的作用是。(6)、若该废钒催化剂中的含量为10%(原料中所有的钒已换算成)。取100g待处理样品,按照上述流程进行实验。当加入溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是%(假设与反应后的操作步骤中钒元素无损失)。15. 二氯异氰尿酸钠(C3N3O3Cl2Na)为白色固体,难溶于冷水,是氧化性消毒剂中最为广谱、高效、安全的消毒剂。实验室用如图所示装置(夹持装置已略去)制备二氯异氰尿酸钠。请回答下列问题:
已知:实验原理为。
(1)、仪器X的名称为。(2)、完成上述实验选择合适的装置,按气流从左至右,导管连接顺序为(填字母)。(3)、装置D中发生反应的离子方程式为。(4)、当装置A内出现的现象时,打开装置A中分液漏斗的活塞,加入氰尿酸(C3H3N3O3)溶液,在反应过程中仍不断通入Cl2的目的是。(5)、实验过程中装置A的温度必须保持在7℃~12℃,pH控制在6.5~8.5,则该实验适宜的受热方式是(填“冷水浴”或“热水浴”)。(6)、测定粗产品中二氯异氰尿酸钠的纯度。将m g粗产品溶于无氧蒸馏水中配制成100 mL溶液,取20.00 mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min。用的标准溶液进行滴定,加入指示剂,滴定至终点时,消耗标准溶液。(杂质不与反应,涉及的反应为、)
①加入的指示剂是(填名称)。
②C3N3O3Cl2Na的百分含量为(用含m、c、V的代数式表示)%。
③下列操作会导致粗产品中二氯异氰尿酸钠的纯度偏低的是(填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸偏少
16. 以为原料制备甲醇等能源物质具有较好的发展前景。因此,研发利用技术,降低空气中含量成为研究热点。(1)、在催化剂的作用下,氢气还原的过程中可同时发生反应I、II。(已知活化能:)I.
II.
①则的 , 其中反应I能自发进行的条件是。
②保持温度T不变时,在容积不变的密闭容器中,充入一定量的及 , 起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
/mol
/mol
/mol
/mol
/mol
总压强/kPa
起始
0.5
0.9
0
0
0
平衡
m
0.3
p
若反应I、II均达到平衡, , 则表中m=;反应I的平衡常数(用含p的代数式表示)。
(2)、在kPa下,向恒压反应器中通入3mol、1mol , 的平衡转化率及的平衡产率随温度变化的关系如图。
已知:的产率
①下列说法正确的是(填标号)。
A.反应过程中,容器内压强不再变化,说明反应I达到平衡
B.反应过程中,气体密度保持不变,说明反应I达到平衡
C.反应过程中,气体的平均摩尔质量保持不变,说明反应I达到平衡
②图中500K以后,的平衡转化率随温度升高而增大的原因是。
(3)、工业上常用电解法将合成为羧酸以实现资源化处理。以Pt为电极、质子惰性有机溶剂为电解液的装置,可将转化为草酸(),其阴极的电极反应式为。17. 镍铜合金是由60%镍、33%铜、6.5%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能,耐腐蚀性好,耐磨性好,容易加工,无磁性,是制造电子管较好的结构材料。请回答下列问题:(1)、基态的价电子轨道表示式为。(2)、元素与的第二电离能分别为、 , 的原因是。(3)、O与形成的化合物为 , 与S形成的化合物为 , 的熔点比的(填“低”、“高”或“无法确定”)。(4)、可以形成一种离子化合物 , 若要确定该物质是晶体还是非晶体,最科学的方法是对它进行实验;其阴离子的空间构型是;加热该物质时,首先失去的是分子,原因是。(5)、甲基丙烯酸铜是一种重要的有机铜试剂,其结构为 。此有机铜试剂中,C原子的杂化类型有 , 1mol此有机铜试剂中含有键的物质的量为mol。 (6)、的化合物种类有很多,与形成的化合物的立方晶胞结构如图,已知立方晶胞的边长为 , 则与形成的化合物的密度(表示阿伏加德罗常数的值,用含a、的代数式表示)。
。此有机铜试剂中,C原子的杂化类型有 , 1mol此有机铜试剂中含有键的物质的量为mol。 (6)、的化合物种类有很多,与形成的化合物的立方晶胞结构如图,已知立方晶胞的边长为 , 则与形成的化合物的密度(表示阿伏加德罗常数的值,用含a、的代数式表示)。 18. 有机物F是一种药物合成的重要中间体,其合成路线如图。
18. 有机物F是一种药物合成的重要中间体,其合成路线如图。
已知:。
(1)、有机物A中含有的官能团的名称为。(2)、A→B的反应类型为。(3)、写出有机物E的结构简式:。(4)、写出CD的化学方程式:。(5)、有机物H是C的同分异构体,符合下列条件的H有种,其中核磁共振氢谱中有5组吸收峰且峰面积之比为3:2:2:2:1的结构简式为。①分子中除苯环外不含其他环状结构。
②仅含有一种官能团,能与新制反应,生成砖红色沉淀。
③苯环上有3个取代基。
(6)、设计以 和
和 为原料制备
为原料制备 的合成路线。(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线。(无机试剂和有机溶剂任用,合成路线示例见本题题干)