广东省广州市2022届高三一模考试化学试题
试卷更新日期:2022-03-29 类型:高考模拟
一、单选题
-
1. 中国空间站天和核心舱的主要能量来源是砷化镓(GaAs)太阳电池阵,其中Ga与Al同主族,化学性质相似。下列说法不正确的是( )A、砷化镓属于金属材料 B、GaAs中As的化合价是-3 C、镓既能与盐酸反应,又能与NaOH溶液反应 D、砷化镓电池能将光能转化为电能2. 北京2022年冬奥会体现了绿色奥运、科技奥运。下列说法不正确的是( )A、飞扬火炬使用纯氢作燃料,实现碳排放为零 B、火炬燃料出口处有钠盐涂层,火焰呈明亮黄色 C、可降解餐具用聚乳酸制造,聚乳酸是天然高分子材料 D、速滑馆使用CO2制冰,比用氟利昂制冰更环保3. 绢本宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石[主要成分为Cu(OH)2·CuCO3],红色来自赭石(赤铁矿),黑色来自炭黑。下列说法不正确的是( )A、蚕丝制品绢的主要成分是蛋白质 B、孔雀石受热易分解 C、赭石的主要成分是Fe3O4 D、炭黑由松枝烧制,该过程是化学变化4. 某学生设计了一种家用消毒液发生器,装置如图如示。下列说法不正确的是( )
 A、该消毒液的有效成分是NaClO B、通电时Cl-发生氧化反应 C、通电时电子从阳极经食盐溶液流向阴极 D、该装置的优点是随制随用5. 下列生活应用或生产活动,没有运用相应化学知识的是( )
A、该消毒液的有效成分是NaClO B、通电时Cl-发生氧化反应 C、通电时电子从阳极经食盐溶液流向阴极 D、该装置的优点是随制随用5. 下列生活应用或生产活动,没有运用相应化学知识的是( )选项
生活应用或生产活动
化学知识
A
用SO2漂白纸张
SO2具有氧化性
B
用铝槽车运输浓硝酸
Al在冷的浓硝酸中发生钝化
C
用生石灰作食品干燥剂
CaO易与水反应
D
用Si制作芯片
Si是良好的半导体材料
A、A B、B C、C D、D6. 一种合成玫瑰香油的主要原料的结构简式如图所示,关于该有机物说法正确的是( ) A、分子式为C10H18O,属于烯烃 B、不能使酸性高锰酸钾溶液褪色 C、能发生水解反应 D、能发生加成反应和取代反应7. 溴甲基蓝(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是( )A、0.01mol·L-1HBb溶液的pH=2 B、HBb溶液的pH随温度升高而减小 C、向NaOH溶液中滴加HBb指示剂,溶液显黄色 D、0.01mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)8. 部分含氮物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、分子式为C10H18O,属于烯烃 B、不能使酸性高锰酸钾溶液褪色 C、能发生水解反应 D、能发生加成反应和取代反应7. 溴甲基蓝(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是( )A、0.01mol·L-1HBb溶液的pH=2 B、HBb溶液的pH随温度升高而减小 C、向NaOH溶液中滴加HBb指示剂,溶液显黄色 D、0.01mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)8. 部分含氮物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、a既可被氧化,也可被还原 B、c溶于水可得d和b C、将铜丝插入d的浓溶液可产生b D、自然界可存在a→b→c→d→e的转化9. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、32g甲醇中含有C-H键的数目为4NA B、1molFe溶于过量稀硝酸,转移的电子数目为3NA C、0.1mol·L-1HClO,溶液中含有阳离子总数为0.1NA D、标准状况下,22.4LN2和H2混合气中含有的原子数为4NA10. 炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述不正确的是( )
A、a既可被氧化,也可被还原 B、c溶于水可得d和b C、将铜丝插入d的浓溶液可产生b D、自然界可存在a→b→c→d→e的转化9. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、32g甲醇中含有C-H键的数目为4NA B、1molFe溶于过量稀硝酸,转移的电子数目为3NA C、0.1mol·L-1HClO,溶液中含有阳离子总数为0.1NA D、标准状况下,22.4LN2和H2混合气中含有的原子数为4NA10. 炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述不正确的是( ) A、可减少CO2的排放 B、Fe3O4和CaO均可循环利用 C、过程①和④的转化均为氧化还原反应 D、过程①的反应中有非极性键的断裂和生成11. 某化合物可用于制造激光器,其结构如图所示。已知元素X、Y、Z、W原子序数依次递增,且均不大于20,X与W同族,元素W的原子比Z原子多4个电子。下列说法正确的是( )
A、可减少CO2的排放 B、Fe3O4和CaO均可循环利用 C、过程①和④的转化均为氧化还原反应 D、过程①的反应中有非极性键的断裂和生成11. 某化合物可用于制造激光器,其结构如图所示。已知元素X、Y、Z、W原子序数依次递增,且均不大于20,X与W同族,元素W的原子比Z原子多4个电子。下列说法正确的是( ) A、非金属性:Z>Y B、单质的沸点:Z>X>Y C、该化合物中Z满足8电子稳定结构 D、X、Y和W可形成既含有离子键又含有共价键的化合物12. 一定温度下向容器中加入A发生反应如下:①A→B,②A→C,③B⇌C。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法不正确的是( )
A、非金属性:Z>Y B、单质的沸点:Z>X>Y C、该化合物中Z满足8电子稳定结构 D、X、Y和W可形成既含有离子键又含有共价键的化合物12. 一定温度下向容器中加入A发生反应如下:①A→B,②A→C,③B⇌C。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法不正确的是( ) A、反应①的活化能大于反应② B、该温度下,反应③的平衡常数大于1 C、t1时,B的消耗速率大于生成速率 D、t2时,c(C)=c0-c(B)13. 下列实验操作或实验方案,不能达到目的的是( )
A、反应①的活化能大于反应② B、该温度下,反应③的平衡常数大于1 C、t1时,B的消耗速率大于生成速率 D、t2时,c(C)=c0-c(B)13. 下列实验操作或实验方案,不能达到目的的是( )选项
实验操作或实验方案
目的
A
向KMnO4固体中加入浓盐酸,产生的气体依次通过饱和食盐水和浓硫酸
制取并纯化氯气
B
取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液
检验Na2SO3固体是否变质
C
用Na2S2O3溶液分别与0.05mol·L-1、0.1mol·L-1的H2SO4反应,记录出现浑浊的时间
探究浓度对反应速率的影响
D
向AgNO3与AgCl的混合浊液中加入少量KBr溶液,沉淀颜色变为浅黄色
证明Ksp(AgCl)>Ksp(AgBr)
A、A B、B C、C D、D14. 下列物质性质实验对应的离子方程式书写正确的是( )A、Na2O2溶于水:Na2O2+H2O=2Na++2OH-+O2↑ B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O C、同浓度同体积NH4HSO4溶液与NaOH溶液混合:+OH-=NH3·H2O D、Na2S2O3溶液中通入足量氯气:+4Cl2+5H2O=2+8Cl-+10H+15. 我国科学家研发了一种室温下可充电的Na-CO2电池,示意图如下。放电时,Na2CO3与C均沉积在碳纳米管中,下列说法不正确的是( ) A、充电时,阴极反应为:Na++e-=Na B、充电时,电源b极为正极,Na+向钠箔电极移动 C、放电时,转移0.4mol电子,碳纳米管电极增重21.2g D、放电时,电池的总反应为3CO2+4Na=2Na2CO3+C16. 25℃时,用HCl和KOH固体改变0.1mol·L-1的邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3、Ka2=3.9×10-6)溶液的pH,lgc(H2A)、lgc(HA-)和Igc(A2-)随pH变化的关系如图所示。下列说法不正确的是( )
A、充电时,阴极反应为:Na++e-=Na B、充电时,电源b极为正极,Na+向钠箔电极移动 C、放电时,转移0.4mol电子,碳纳米管电极增重21.2g D、放电时,电池的总反应为3CO2+4Na=2Na2CO3+C16. 25℃时,用HCl和KOH固体改变0.1mol·L-1的邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3、Ka2=3.9×10-6)溶液的pH,lgc(H2A)、lgc(HA-)和Igc(A2-)随pH变化的关系如图所示。下列说法不正确的是( ) A、曲线①代表lgc(H2A),曲线③代表lgc(A2-) B、P点时,c(K+)=c(H2A)+c(HA-)+c(A2-) C、0.1mol·L-1KHA溶液中,c(K+)>c(HA-)>c(A2-)>c(H2A) D、用KOH固体改变KHA溶液pH至14过程中,c(A2-)一直增大
A、曲线①代表lgc(H2A),曲线③代表lgc(A2-) B、P点时,c(K+)=c(H2A)+c(HA-)+c(A2-) C、0.1mol·L-1KHA溶液中,c(K+)>c(HA-)>c(A2-)>c(H2A) D、用KOH固体改变KHA溶液pH至14过程中,c(A2-)一直增大二、综合题
-
17. 碘在科研与生活中有重要作用。(1)、I.实验室按如下实验流程提取海带中的碘。
海带→灼烧→过滤→氧化→萃取、分液→I2的CCl4溶液
上述实验流程中不需要用到的仪器是(从下列图中选择,写出名称)。
 (2)、“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为。(3)、海带灰中含有的其他可溶性无机盐。是在(从以上流程中选填实验操作名称)中实现与碘分离。(4)、II.定量探究+2I-=2+I2的反应速率与反应物浓度的关系。
(2)、“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为。(3)、海带灰中含有的其他可溶性无机盐。是在(从以上流程中选填实验操作名称)中实现与碘分离。(4)、II.定量探究+2I-=2+I2的反应速率与反应物浓度的关系。查阅资料:该反应速率与c(S2O82-)和c(I-)的关系v=kcm()cn(I-),k为常数。
实验任务:测定不同浓度下的反应速率确定所m、n的值。
实验方法:按下表体积用量V将各溶液混合,(NH4)2S2O8溶液最后加入,记录开始反应至溶液出现蓝色所用的时间t。实验过程中发生如下反应:+2I-=2+I2(慢)I2+2=2I-+(快)
实验记录表:
实验编号
A
B
C
D
E
0.2mol·L-1(NH4)2S2O8溶液/mL
10
5
2.5
10
10
0.2mol·L-1KI溶液/mL
10
10
10
5
2.5
0.05mol·L-1Na2S2O3溶液/mL
3
3
3
3
3
0.2mol·L-1KNO3溶液/mL
0
V1
V2
V3
V4
0.2mol·L-1(NH4)2SO4溶液/mL
0
V5
V6
V7
V8
0.2%淀粉溶液/mL
1
1
1
1
1
t/s
t1
t2
t3
t4
t5
加入KNO3、(NH4)2SO4溶液的目的是控制实验条件,其中V1 , V4 , V5。
(5)、当溶液中(填化学式)耗尽后溶液出现蓝色。根据实验A的数据,反应速率v(-)=mol·L-1·s-1(列出算式)。(6)、根据实验数据可确定m、n的值。n=1的判断依据是(用t的关系式来表示)。18. 锑(Sb)不用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3 , 还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如下: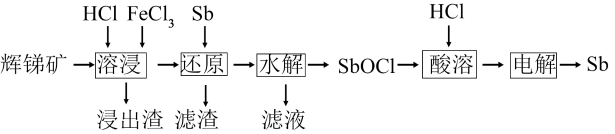
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe3+
Al3+
Fe2+
Mg2+
开始沉淀时(c=0.01mol·L-1)的pH
2.2
3.7
7.5
9.6
完全沉淀时(c=1.0×10-5mol·L-1)的pH
3.2
4.7
9.0
11.1
回答下列问题:
(1)、“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为。(2)、“还原”时加入Sb的目的是将还原,提高产物的纯度。(3)、“水解”时需控制溶液pH=2.5。①Sb3+发生水解的离子方程式为。
②下列能促进该水解反应的措施有(填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3 , Fe3+浓度应小于mol·L-1。
(4)、“滤液”中含有的金属阳离子有。向“滤液”中通入足量(填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。将沉淀溶于浓盐酸后,产物可返回工序循环使用。(5)、Sb可由SbCl电解制得,阴极的电极反应式为。19. 以CO2、H2为原料合成CH3OH涉及的反应如下:I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49kJ·mol-1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41kJ·mol-1
III.CO(g)+2H2(g)⇌CH3OH(g) ΔH3
回答下列问题:
(1)、Kp为分压平衡常数,各反应的lnKp随的变化如图所示。
计算反应III的ΔH3=kJ·mol-1 , 其对应的曲线为(填“a”或“c”)
(2)、在5MPa下,按照n(CO2):n(H2)=1:3投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图:
①图中代表CH3OH的曲线为(填“m”或“n”)。
②解释150~250℃范围内CO2转化率随温度升高而降低的原因。
③下列说法不正确的是(填字母)。
A.H2的平衡转化率始终低于CO2的
B.温度越低,越有利于工业生产CH3OH
C.加入选择性高的催化剂,可提高CH3OH的平衡转化率
D.150-400℃范围内,温度升高,H2O的平衡产量先减小后增大
④270℃时CO的分压为 , 反应II的平衡常数为(列出算式)。
20. 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。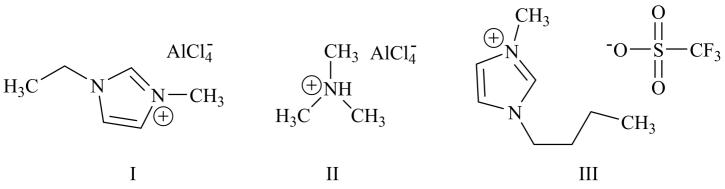
回答下列问题:
(1)、基态铝原子的核外电子排布式为。(2)、基态氮原子的价层电子排布图为____(填编号)。A、 B、
B、 C、
C、 D、
D、 (3)、化合物I中碳原子的杂化轨道类型为 , 化合物II中阳离子的空间构型为。(4)、化合物III中O、F、S电负性由大到小的顺序为。(5)、传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是。(6)、铝离子电池的其中一种正极材料为AlMn2O4 , 其晶胞中铝原子的骨架如图所示。
(3)、化合物I中碳原子的杂化轨道类型为 , 化合物II中阳离子的空间构型为。(4)、化合物III中O、F、S电负性由大到小的顺序为。(5)、传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是。(6)、铝离子电池的其中一种正极材料为AlMn2O4 , 其晶胞中铝原子的骨架如图所示。
①晶体中与Al距离最近的Al的个数为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( , , ),原子2的坐标为( , , ),则原子3的坐标为。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA , 则晶体的密度为g·cm-3(列出计算式)。
21. 化合物G是合成某强效镇痛药的关键中间体,其合成路线如下:
回答下列问题:
(1)、A的化学名称是。(2)、A生成B的方程式可表示为:A+I=B+Z+H2O,化合物Z的化学式为。(3)、D生成E的反应类型为。(4)、F生成G的离子反应方程式依次是: , 。(5)、化合物B的芳香族同分异构体中,同时满足以下条件的有种。条件:a.能够发生银镜反应;b.可与FeCl3溶液发生显色反应。
写出其中核磁共振氢谱在苯环上有两组峰,且峰面积为1:1的同分异构体的结构简式。
(6)、根据以上信息,写出以 及BrCH2COOC2H5为原料合成
及BrCH2COOC2H5为原料合成 的路线(其他试剂任选)。
的路线(其他试剂任选)。