北京市丰台区2022届高三下学期一模考试化学试题
试卷更新日期:2022-03-29 类型:高考模拟
一、单选题
-
1. 冬奥会冰球运动所需要的下列器材中,由金属材料制成的是( )
 A、冰球——橡胶 B、冰球杆——碳纤维 C、运动员面罩——钢丝网 D、运动员头盔——丙烯腈、丁二烯、苯乙烯形成的高聚物2. 下列化学用语或图示表达正确的是( )A、的结构示意图:
A、冰球——橡胶 B、冰球杆——碳纤维 C、运动员面罩——钢丝网 D、运动员头盔——丙烯腈、丁二烯、苯乙烯形成的高聚物2. 下列化学用语或图示表达正确的是( )A、的结构示意图: B、NaOH的电子式:
B、NaOH的电子式: C、的空间结构模型:
C、的空间结构模型: D、反式聚异戊二烯的结构简式:
D、反式聚异戊二烯的结构简式: 3. 下列物质的性质不能用化学键解释的是( )A、金属铜具有导电性 B、氮气化学性质稳定 C、金刚石硬度大 D、碘单质常温为固体4. 依据元素周期律,下列判断不正确的是( )A、第一电离能: B、原子半径: C、电负性: D、酸性:5. 下列关于物质保存的解释,反应方程式不正确的是( )A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:6. 依据图示关系,下列说法不正确的是( )
3. 下列物质的性质不能用化学键解释的是( )A、金属铜具有导电性 B、氮气化学性质稳定 C、金刚石硬度大 D、碘单质常温为固体4. 依据元素周期律,下列判断不正确的是( )A、第一电离能: B、原子半径: C、电负性: D、酸性:5. 下列关于物质保存的解释,反应方程式不正确的是( )A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:6. 依据图示关系,下列说法不正确的是( ) A、 B、1 mol S(g)完全燃烧释放的能量小于2968 kJ C、 D、16 g S(s)完全燃烧释放的能量为1484 kJ7. 实验室制取下列气体,所选反应试剂、制备装置与收集方法合理的是( )
A、 B、1 mol S(g)完全燃烧释放的能量小于2968 kJ C、 D、16 g S(s)完全燃烧释放的能量为1484 kJ7. 实验室制取下列气体,所选反应试剂、制备装置与收集方法合理的是( )
选项
气体
反应试剂
制备装置
收集方法
A
Cu、稀硝酸
b
e
B
、浓硫酸
c
f
C
、
a
d
D
、70%硫酸
b
f
A、A B、B C、C D、D8. 下列关于氨气的说法不正确的是( ) A、分子呈三角锥形,属于极性分子 B、易液化、易溶于水均与氢键的形成有关 C、与HCl反应的过程包含配位键的形成,属于共价化合物 D、烧瓶中溶液红色不变时,达平衡9. 下列事实不能用平衡移动加以解释的是( )A、实验室用NaOH溶液吸收尾气 B、用饱和食盐水除去中的HCl杂质 C、NaClO与浓盐酸混合产生氯气 D、漂白粉中加入适量醋酸可增强漂白性10. 蔗糖酯可由油酸()与蔗糖反应而得,其转化关系如下图所示:
A、分子呈三角锥形,属于极性分子 B、易液化、易溶于水均与氢键的形成有关 C、与HCl反应的过程包含配位键的形成,属于共价化合物 D、烧瓶中溶液红色不变时,达平衡9. 下列事实不能用平衡移动加以解释的是( )A、实验室用NaOH溶液吸收尾气 B、用饱和食盐水除去中的HCl杂质 C、NaClO与浓盐酸混合产生氯气 D、漂白粉中加入适量醋酸可增强漂白性10. 蔗糖酯可由油酸()与蔗糖反应而得,其转化关系如下图所示:
下列说法正确的是( )
A、蔗糖不能发生银镜反应 B、油酸是一种饱和高级脂肪酸 C、蔗糖酯属于油脂类物质 D、蔗糖酯在酸性条件下充分水解的最终产物为油酸和蔗糖11. 下列实验方案能达到实验目的的是( )A
B
C
D
目的
比较Mg、Al金属性的强弱
研究浓度对化学平衡的影响
比较、与酸反应的快慢
比较碳酸、醋酸、苯酚的酸性强弱
实验方案



 A、A B、B C、C D、D12. 水溶性荧光超支化聚合物P在生物、医药及组织工程和生物成像等领域都有较好的应用,合成P的单体由M(
A、A B、B C、C D、D12. 水溶性荧光超支化聚合物P在生物、医药及组织工程和生物成像等领域都有较好的应用,合成P的单体由M( )和W(
)和W( )在一定条件下反应得到,P的结构片段如下:
)在一定条件下反应得到,P的结构片段如下:
下列说法不正确的是( )
A、W不存在顺反异构 B、聚合物P的单体由M与W通过取代反应得到 C、M与W形成的单体通过缩聚反应制得聚合物P,同时有生成 D、聚合物P具有较好水溶性可能与存在多个亲水基团-OH有关13. 一种可充电的锌锰分液电池,其结构如下图所示: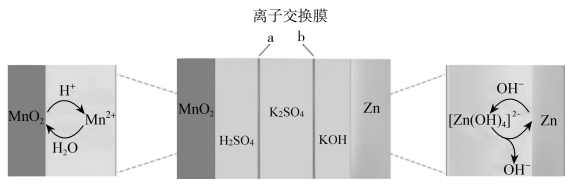
下列说法不正确的是( )
A、放电时,正极反应为: B、充电时,Zn作阴极: C、离子交换膜a和b分别为阳离子交换膜和阴离子交换膜 D、充电过程中溶液的浓度逐渐降低14. 某小组进行以下探究。实验①:Mg条与盐酸-KCl溶液(pH=3.08)反应;实验②:Mg条与0.001 溶液(pH=3.08)反应。两个实验所用的Mg条(打磨过)足量且表面积相同。测得溶液pH随时间变化的曲线如下图所示。两个实验过程中均观察到有无色气体产生,实验②中没有检测到和Fe。
下列说法不正确的是( )
A、无色气体为 B、0~200秒,实验②产生氢气的速率比实验①慢 C、实验①②中pH发生突变与Mg和水的反应有关 D、400秒时,:实验②>实验①二、综合题
-
15. 金属冶炼过程中一种用有机化合物从水溶液中提取的流程如下:(1)、有机化合物W的结构简式为:

该分子中碳原子的杂化轨道类型有种,N、O杂化轨道类型分别为、。
(2)、W可与形成化合物Q,其结构如下所示:
①基态的价电子排布式为。
②氢键对Q在水中溶解性的影响是(填“增大”或“减小”)。
③W与之间以共价键和配位键相结合,其中一定是配位键的是键(填“Cu—O”或“Cu—N”)。
(3)、有机化合物的合成通常使用催化剂,一种催化剂晶体的晶胞示意图如下:
①Y原子为(填元素符号)。与每个Y原子距离最近且等距的X原子有个。
②该晶胞边长为a nm,阿伏加德罗常数为 , 则该晶体的密度(列出计算式,的摩尔质量为123 )。
16. 铜冶炼过程中,产生的粗硫酸镍废液中含有、、、、等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:
已知:常温下,
(1)、步骤ⅰ的操作名称是。(2)、①中As的化合价为。②步骤ⅱ中的作用是。
(3)、步骤ⅲ,加入的目的是通过调pH进一步去除 , 使 。若溶液2中 , 则需控制pH的大致范围为。(4)、①步骤ⅳ,沉淀3的主要成分有(填化学式)。②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是。
(5)、结合下图说明由溶液4得到的操作是。 17. 铁的腐蚀与防护与生产生活密切相关。(1)、Ⅰ.研究铁的腐蚀
17. 铁的腐蚀与防护与生产生活密切相关。(1)、Ⅰ.研究铁的腐蚀实验步骤如下:
步骤1:将铁粉放置于0.002 溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。

第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为。
(2)、第二、三阶段主要发生吸氧腐蚀。①选取b点进行分析,经检验溶液中含有 , 写出Fe被腐蚀的总反应。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点被氧化的离子方程式。
③依据b点发生的反应,分析第二阶段pH上升的原因是。
(3)、Ⅱ.研究铁的防护在铁表面镀锌可有效防止铁被腐蚀
已知:放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的相连。
②向电解液中加入NaCN溶液,将转化为 , 电解得到的镀层更加致密、细腻,原因是。
(4)、电镀后的废水中含有 , 一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 溶液滴定,消耗溶液V mL。已知:(无色) , 。①滴定终点的现象是。
②废水中的含量是(填计算式)。
18. 某喹啉类化合物P的合成路线如下:
已知:
 (1)、A为链状,按官能团分类,其类别是。(2)、B→C的反应方程式是。(3)、C→D所需的试剂a是。(4)、下列关于E的说法正确的是____。A、能发生银镜反应 B、能发生氧化、消去、加聚反应 C、核磁共振氢谱显示峰面积比为3:2:2:3 D、1 mol E可以与6 mol 发生反应(5)、G的结构简式为。(6)、H→I的反应类型为。(7)、由I和E合成P的流程如下,M与N互为同分异构体,写出J、M、N的结构简式:、、。
(1)、A为链状,按官能团分类,其类别是。(2)、B→C的反应方程式是。(3)、C→D所需的试剂a是。(4)、下列关于E的说法正确的是____。A、能发生银镜反应 B、能发生氧化、消去、加聚反应 C、核磁共振氢谱显示峰面积比为3:2:2:3 D、1 mol E可以与6 mol 发生反应(5)、G的结构简式为。(6)、H→I的反应类型为。(7)、由I和E合成P的流程如下,M与N互为同分异构体,写出J、M、N的结构简式:、、。 19. 实验室研究不同价态铜元素之间的转化。(1)、Ⅰ.研究、的转化
19. 实验室研究不同价态铜元素之间的转化。(1)、Ⅰ.研究、的转化下列试剂能实现转化的是____。
A、浓硝酸 B、硫黄 C、氯气(2)、两种转化所需试剂在性质上具有的共性和差异性是。(3)、Ⅱ.研究的转化已知:
为无色,在空气中极易被氧化为
物质
CuCl(白色)
CuI(白色)
(黑色)
CuS(黑色)
Ksp
实验如下:
实验a
实验b

现象:无明显变化

现象:产生白色沉淀
实验a中反应难以发生的原因是。
(4)、实验b中反应的离子方程式为。(5)、通过对上述实验的分析,甲预测溶液与KI溶液混合也能实现转化①甲预测的理由是。
②为了验证猜测,甲进行实验c;向溶液中加入KI溶液,观察到溶液变为棕色,并伴有浑浊产生。
甲认为仅依据溶液变为棕色这一现象,无法证明实现了转化,理由是。
③甲将实验c中反应所得浊液过滤, , 观察到 , 证明实验c中实现了转化。
(6)、基于实验c,乙认为与也能反应得到 , 但将两溶液混合后只得到了CuS。①从速率角度分析与反应没有生成的原因。
②乙利用上述实验中的试剂,改进实验方案,证明在一定条件下可以将转化为+1价Cu,并进一步得到了 , 实验方案是。