2021年山东省威海市文登区(五四制)中考二模化学试题
试卷更新日期:2022-03-25 类型:中考模拟
一、单选题
-
1. 下列过程中,没有发生化学变化的是( )A、光合作用
 B、金属导电
B、金属导电 C、钢铁生锈
C、钢铁生锈 D、烧制陶瓷
D、烧制陶瓷 2. 下列关于原子、分子、离子等微观粒子和物质及其变化的认识中,正确的是( )
2. 下列关于原子、分子、离子等微观粒子和物质及其变化的认识中,正确的是( )①原子中核外电子,特别是最外层电子,是决定元素化学性质的关键
②原子的种类、数量和排列方式决定分子的种类
③有限的化学元素组成了多样的化学物质
④原子得失电子变成离子后,元素的种类随之发生了改变
⑤在物理变化中分子的能量、间隔、相互作用均不变
⑥物质能否发生化学变化是由构成物质的微粒决定的
⑦研究化学变化的意义在于实现物质和能量的转化
⑧同种分子排列方式不同,化学性质不同
⑨汤姆生之前,科学家对原子的认识是原子是构成物质的最小粒子,不可再分
⑩卢瑟福等科学家在汤姆生研究的基础上,根据α粒子轰击金箔实验结论,提出了原子核式结构模型
A、全部 B、①③⑤⑥⑦⑧⑩ C、①②③⑥⑦⑨⑩ D、③④⑤⑥⑦⑧⑨3. 常用的医用酒精是体积分数为75%的乙醇溶液,可用于杀菌消毒。乙醇分子的模型如图所示,其中 代表碳原子,
代表碳原子,
 代表氢原子,
代表氢原子,
 代表氧原子,下列有关乙醇的说法不正确的是( )
代表氧原子,下列有关乙醇的说法不正确的是( )
 A、从乙醇的分子结构模型可知∶乙醇的化学式为C2H6O B、从物质分类的角度看,乙醇是一种有机物 C、从物质的结构分析可知:75%的乙醇溶液中含有的微粒只有乙醇分子 D、从物质变化的角度看∶乙醇充分燃烧后的产物是二氧化碳和水4. 为除去物质中混有的少量杂质,下列所采用的相应除杂质方案中,不正确的是( )
A、从乙醇的分子结构模型可知∶乙醇的化学式为C2H6O B、从物质分类的角度看,乙醇是一种有机物 C、从物质的结构分析可知:75%的乙醇溶液中含有的微粒只有乙醇分子 D、从物质变化的角度看∶乙醇充分燃烧后的产物是二氧化碳和水4. 为除去物质中混有的少量杂质,下列所采用的相应除杂质方案中,不正确的是( )选项
物质
杂质
除杂质方案
A
H2
HCl
通过足量NaOH溶液,干燥
B
NaOH溶液
Na2CO3
加入适量稀盐酸
C
NaCl固体
AgCl
加足量水溶解,过滤,蒸发结晶
D
CaCl2溶液
HCl
加入过量CaCO3 , 充分反应后再过滤
A、A B、B C、C D、D5. 下列图象表示的化学反应过程,与实际情况相符合的是,(说明:①至④对应的每组实验其他条件均相同) ( ) A、图①表示等质量等溶质质量分数的过氧化氢溶液分别在有、无MnO2的条件下反应 B、图②表示等质量的碳酸钙粉末分别与足量的溶质质量分数为 5%和 10%的稀盐酸反应 C、图③表示等质量的锌粉和铁粉分别与足量的等溶质质量分数的稀盐酸反应 D、图④表示等质量的锌粉和锌粒分别与足量的等溶质质量分数的稀盐酸反应6. 10℃时,将3g甲、乙两种可溶性固体分别放入盛有10mL水的试管中。两种物质的溶解情况(见图I),两种物质的溶解度随温度的变化(见图Ⅱ)。下面对甲、乙两物质的判断,不正确的是( )
A、图①表示等质量等溶质质量分数的过氧化氢溶液分别在有、无MnO2的条件下反应 B、图②表示等质量的碳酸钙粉末分别与足量的溶质质量分数为 5%和 10%的稀盐酸反应 C、图③表示等质量的锌粉和铁粉分别与足量的等溶质质量分数的稀盐酸反应 D、图④表示等质量的锌粉和锌粒分别与足量的等溶质质量分数的稀盐酸反应6. 10℃时,将3g甲、乙两种可溶性固体分别放入盛有10mL水的试管中。两种物质的溶解情况(见图I),两种物质的溶解度随温度的变化(见图Ⅱ)。下面对甲、乙两物质的判断,不正确的是( ) A、10℃时,甲、乙两物质的溶液都是饱和溶液 B、温度升高至25℃时,甲、乙两物质的溶液都是不饱和溶液 C、甲物质对应的溶解度曲线为a D、可用降温结晶法分离甲、乙两种物质的混合物7. 欲探究铁和铝的金属活动性差异,采用金属样品与酸溶液反应的实验,通过观察反应现象得出结论。下列有关做法中,不符合控制变量要求的是( )A、取用表面积(形状、大小和数)相向的铁片和铝片进行实验 B、取用的稀盐酸浓度和体积相同 C、取铁和稀盐酸反应,铝和稀硫酸反应 D、在相同的温度下进行实验8. 氧循环和碳循环是自然界中的重要循环(如图)。分析两种循环,其中不正确的是( )
A、10℃时,甲、乙两物质的溶液都是饱和溶液 B、温度升高至25℃时,甲、乙两物质的溶液都是不饱和溶液 C、甲物质对应的溶解度曲线为a D、可用降温结晶法分离甲、乙两种物质的混合物7. 欲探究铁和铝的金属活动性差异,采用金属样品与酸溶液反应的实验,通过观察反应现象得出结论。下列有关做法中,不符合控制变量要求的是( )A、取用表面积(形状、大小和数)相向的铁片和铝片进行实验 B、取用的稀盐酸浓度和体积相同 C、取铁和稀盐酸反应,铝和稀硫酸反应 D、在相同的温度下进行实验8. 氧循环和碳循环是自然界中的重要循环(如图)。分析两种循环,其中不正确的是( )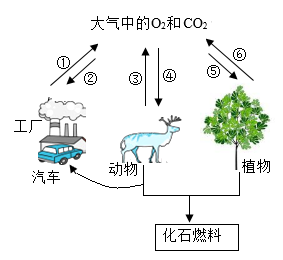 A、碳循环和氧循环过程中均发生了化学反应 B、氧气只有通过燃烧才能参与碳循环 C、通过减少化石燃料的使用和大力植树造林以控制二氧化碳的排放量 D、碳循环和氧循环有利于维持自然界中氧气和二氧化碳含量的相对稳定9. 下表中对部分化学知识的归纳完全正确的一组是( )
A、碳循环和氧循环过程中均发生了化学反应 B、氧气只有通过燃烧才能参与碳循环 C、通过减少化石燃料的使用和大力植树造林以控制二氧化碳的排放量 D、碳循环和氧循环有利于维持自然界中氧气和二氧化碳含量的相对稳定9. 下表中对部分化学知识的归纳完全正确的一组是( )A.化学与生活
B.化学与环境
①常用加热煮沸的方法软化硬水
②病人输入葡萄糖溶液能及时补充能量
③可用适量的食醋除去水壶内的水垢
①提倡焚烧秸秆还田以提高土壤肥力
②PM2.5是造成雾霾天气的元凶之一
③向废水中加入火碱处理其中含有的酸
C.化学与安全
D.化学与健康
①皮肤沾上浓烧碱溶液,先用水冲洗,再涂上3%-5%的碳酸氢钠溶液
②煤炉上放盆水能防止CO中毒
③点燃甲烷气体前一定要检验它的纯度
①钙是人体中含量最多的金属元素
②制作糕点时加入适量的碳酸氢钠,可使糕点松软可口
③人体最主要的供能物质是蛋白质
A、A B、B C、C D、D10. 推理是一种重要的化学思维方法,以下推理合理的是( )A、有机物都含碳元素,所以含碳元素的化合物一定是有机物 B、均一稳定的混合物是溶液,碘酒均一稳定,则碘酒属于溶液 C、化学变化伴随有能量变化,则有能量变化的变化一定是化学变化 D、同种元素的粒子质子数相同,则质子数相同的粒子一定属于同种元素二、填空题
-
11. 化学与环境保护
人与自然和谐共生的理念,已成为国家的意志,保护自然环境,人人有责。试回答:
(1)、威海市已全面启动城镇生活垃圾分类工作,生活垃圾将全面得到无害化处理。现有下列四种生活垃圾,不能投放到可回收物垃圾桶内的是____(填选项序号之一)。A、废旧纸张 B、金属易拉罐 C、废弃水果皮 D、塑料饮料瓶(2)、保护水源就是保护我们的生命之源,自来水厂通常用高铁酸钾(K2FeO4)作为净水剂和消毒剂来处理天然水。在高铁酸钾中,铁、氧两种元素的质量之比为(填最简整数比)。(3)、化石燃料的大量使用会影响生态环境。煤燃烧产生的二氧化硫和汽车尾气中的氮氧化物是导致酸雨的重要原因。写出用烧碱溶液吸收二氧化硫的化学方程式。现在的汽车排气管上都安装了“催化转化器”(如图),使尾气中的一氧化碳和氮氧化物(NOx)转化为氮气和二氧化碳,这样就能减少对空气的污染,其主要原因是(填下列选项序号之一)。
A.生成的N2属于单质
B.生成的N2和CO2都不属于空气污染
C.生成的N2和CO2都不能燃烧
D.生成的CO2属于氧化物
(4)、绿色化学也称环境友好化学,就是利用化学原理,实现从生产源头减少或消除对环境的污染。某化学小组的同学欲利用单质铜制备硫酸铜,设计了如下甲、乙两个制备实验方案:甲:
乙:(已知:)
在上述两方案中,更符合绿色化学观念的是(填“甲”、“乙”之一)。若用相同质量的单质铜,分别用上述两方案制备硫酸铜,将两者理论上最多可制备硫酸铜的质量进行比较,结果为(填下列选项序号之一)。
A.甲方案较多 B.乙方案较多 C.二者相等
12. 溶液与人们的生产生活密切相关。(1)、下列常见物质不属于溶液的是____(填序号)。A、生理盐水 B、澄清的石灰水 C、医用酒精 D、冰水混合物(2)、下图是A物质的溶解度曲线,下表是B物质在不同温度时的溶解度。
温度/℃
B物质溶解度/g
0
32
20
35
40
40
60
45
80
55
①60℃时,A物质的溶解度是g。
②50℃时,向100g水中加40gB物质,充分溶解后得到的是(填“饱和”或“不饱和”)溶液,此时溶液的溶质质量分数是(结果保留一位小数)。
③AB两种物质溶解度相同时的温度约是℃。
(3)、新型冠状病毒肺炎疫情期间,居民多用75%酒精消毒液对手、皮肤等进行消毒。请分析酒精浓度与杀死细菌的时间对比表(如下)中的数据,酒精消毒液的最合适浓度应为。根据酒精的物理性质,你认为两者浓度差异的主要原因是。酒精(C2H5OH)因易燃,使用时要注意远离火源。酒精燃烧的化学方程式是。酒精浓度(%)
大肠杆菌
金黄色葡萄球菌
溶血性链球菌
90
15小时
30分钟
5分钟
80
1小时
30分钟
5分钟
70
30秒
5分钟
10秒
60
20秒
30分钟
10秒
50
20秒
2小时
20秒
40
22分钟
4小时
2分钟
三、综合题
-
13. 下图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
 (1)、用高炉冶铁的主要反应原理是(用化学方程式表示)(2)、分析流程图,三脱装置中发生反应的基本反应类型是。(3)、向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中(填一种仪器的名称)的作用。(4)、铁与镍相比,铁的金属活动性镍(选填“>”、“=”或“<”),判断依据是(用化学方程式表示)。(5)、通过以上信息,得出白铜的成分是 , 其硬度和抗腐蚀性比纯铜(填“大”或“小”)。14. 无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO2、Fe2O3、MgSO4等杂质)为原料,生产无水氯化钙的流程如下图:
(1)、用高炉冶铁的主要反应原理是(用化学方程式表示)(2)、分析流程图,三脱装置中发生反应的基本反应类型是。(3)、向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中(填一种仪器的名称)的作用。(4)、铁与镍相比,铁的金属活动性镍(选填“>”、“=”或“<”),判断依据是(用化学方程式表示)。(5)、通过以上信息,得出白铜的成分是 , 其硬度和抗腐蚀性比纯铜(填“大”或“小”)。14. 无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO2、Fe2O3、MgSO4等杂质)为原料,生产无水氯化钙的流程如下图:
回答下列问题:
(1)、从流程图中推知:SiO2具有的化学性质是。(2)、加入盐酸酸溶一步发生反应的化学方程式为、。(3)、滤液1与BaCl2发生反应的化学方程式为。(4)、滤液2与石灰乳发生反应的化学方程式为。滤渣3中除有Ca(OH)2外,还有(填化学式,下同)。15. 某探究小组为了探究镁、铝、铜的金属活动性强弱,设计了以下实验探究方案。(1)、【实验探究1】将大小一样且均未打磨的镁、铝、铜片分别放入等质量的溶质质量分数相同的稀盐酸中。【实验现象】镁片表面很快产生大量气泡,铝表面过一段时间后才产生较少气泡,铜不反应。
【结论】镁、铝、铜的金属活动性由强到弱的顺序为(用符号表示)。
(2)、铝片放入稀盐酸中一段时间后表面产生气泡过程中发生反应的化学方程式为、(用化学方程式表示)。(3)、有同学提出疑问:镁、铝、铜片均未打磨,会影响反应现象,那么实验前镁、铝、铜片打磨的目的是。(4)、【实验探究2】取打磨过的镁片、铝片分别插入盛有硫酸铜溶液的试管中。镁片、铝片表面都有红色疏松的物质析出,硫酸铜溶液颜色变浅。据此可以探究出三者的金属活动性强弱。写出铝与硫酸铜溶液反应的化学方程式该反应的实质是。该反应的实质是。
(5)、【拓展探究】细心的同学发现,将打磨过的镁片插入硫酸铜溶液中时,镁片表面除了有红色疏松的物质析出,还有气泡产生,为什么会有气泡产生呢?【查阅资料】在硫酸铜溶液中,由于铜离子的水解作用,溶液显酸性,硫酸铜溶液的浓度越大,铜离子的水解作用越强。
试从微观的视角用化学符号表示出镁片与硫酸铜溶液反应产生气泡的过程。
(6)、试设计实验探究硫酸铜溶液的浓度与铜离子的水解作用的关系。16. 某实验小组选择“铜和硫酸反应的探究”的课题开展探究,下表是他们分别用相同质量的铜粉和足量硫酸反应的几组实验数据:实验编号
硫酸的质量分数/%
温度/℃
铜粉消失的时间/s
①
98
120
400
②
98
200
200
③
80
120
500
④
80
200
280
⑤
70
200
不消失
⑥
40
200
不消失
(1)、实验①、②表明:该反应快慢与有关,其关系是;能表明硫酸浓度对反应快慢有影响的实验编号组合是。(2)、如果把实验①中硫酸的质量分数改为85%,请你推出铜粉消失时间(用t表示)的取值范围。(3)、同学们都知道铜和稀硫酸不反应,从上表来看,这里的“稀硫酸”指的是溶液质量分数小于(取整数)的硫酸。(4)、影响金属和酸化学反应速度的因素除了上述因素以外还可能有、。(5)、铜与浓硫酸在加热的条件下,产生刺激性气味的气体同时还有蓝色溶液出现,试写出该反应的化学方程式。(6)、该实验除了用铜粉消失的时间来衡量反应的快慢外,还能有哪些方法来衡量该反应的快慢?方法1:。
方法2:。
四、计算题
-
17. 现有NaCl和CaCl2的固体混合物80g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,固体物质完全溶解,再向烧杯中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,滴入Na2CO3溶液的质量与生成沉淀的质量关系如图所示,试回答:
 (1)、当滴入Na2CO3溶液150g时(至图中B点),烧杯中溶液里一定大量存在的金属阳离子是(写离子符号)。(2)、求该固体混合物中NaCl的质量是多少?(写出计算过程,计算结果精确至0.1g)
(1)、当滴入Na2CO3溶液150g时(至图中B点),烧杯中溶液里一定大量存在的金属阳离子是(写离子符号)。(2)、求该固体混合物中NaCl的质量是多少?(写出计算过程,计算结果精确至0.1g)