山东省临沂市沂南县2021年中考一模化学试题
试卷更新日期:2022-03-25 类型:中考模拟
一、单选题
-
1. 下列变化中,一定发生化学变化的是( )A、日光灯通电发光 B、将黄瓜切成片 C、粮食酿酒 D、干冰人工降雨2. 下列物质分别加入适量水中,充分搅拌,能够得到溶液的是( )A、牛奶 B、苏打 C、花生油 D、面粉3. 下列实验基本操作正确的是( )A、
 B、
B、 C、
C、 D、
D、 4. 古丝绸之路贸易中的下列商品,主要成分不属于有机化合物的是( )A、丝绸 B、草药 C、茶叶 D、瓷器5. 下列“水”能使无色酚酞溶液变红的是( )A、氨水 B、汽水 C、冰水 D、糖水6. 关于氧气和二氧化碳的说法正确的是( )A、构成:都是由分子构成,且都含有氧分子 B、性质:常温下均为气体,且都易溶于水 C、用途:氧气可用作燃料,二氧化碳可用作化工原料 D、转化:在自然界中氧气和二氧化碳可以相互转化7. 银杏果中含有银杏酸(银杏酸化学式为C22H34O3),下列有关银杏酸说法正确的是( )
4. 古丝绸之路贸易中的下列商品,主要成分不属于有机化合物的是( )A、丝绸 B、草药 C、茶叶 D、瓷器5. 下列“水”能使无色酚酞溶液变红的是( )A、氨水 B、汽水 C、冰水 D、糖水6. 关于氧气和二氧化碳的说法正确的是( )A、构成:都是由分子构成,且都含有氧分子 B、性质:常温下均为气体,且都易溶于水 C、用途:氧气可用作燃料,二氧化碳可用作化工原料 D、转化:在自然界中氧气和二氧化碳可以相互转化7. 银杏果中含有银杏酸(银杏酸化学式为C22H34O3),下列有关银杏酸说法正确的是( )
A、从宏观上看:银杏酸分子由碳、氢、氧三种元素组成 B、从微观上看:银杏酸由22个碳原子、34个氢原子和3个氧原子构成 C、从类别上看:银杏酸属于有机化合物 D、从质量上看:银杏酸中碳元素和氢元素的质量比为11:178. 某物质的化学式为CaWOx ,其中钨(W)元素为+6价,则x的值为( )A、2 B、3 C、4 D、59. 将宏观、微观及化学符号联系在一起是化学学科的特点。某化学反应微观示意图如图所示,下列叙述正确的是( )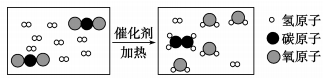 A、反应前后各元素化合价不变 B、该化学变化中发生改变的微粒是原子 C、该反应不符合质量守恒定律 D、参加反应的CO2和H2分子个数比为1:310. 硅是信息技术的关键材料。从石英砂制取芯片的重要反应是SiO2+2C Si+2CO↑,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应11. 下列实验现象描述正确的是( )A、镁条在空气中燃烧,发出白光,生成黑色固体 B、细铁丝在氧气中燃烧,火星四射,生成了四氧化三铁 C、铁锈与稀盐酸反应后溶液颜色由无色变成了黄色 D、将紫色石蕊试液滴入到稀氢氧化钠溶液中变红12. 元素观、微粒观是化学的重要观念。下列有关元素和微粒的说法不正确的是( )A、分子、原子和离子都是成物质的粒子 B、同种元素的原子核内质子数与中子数一定相等 C、元素的原子序数与该元素原子核电荷数在数值上相同 D、在物质发生化学变化时,原子的种类不变,元素的种类也不会改变13. 下列各组离子在水中能大量共存的是( )A、K+、、H+ B、Ca2+、、Na+ C、Fe3+、OH−、Cl− D、Ba2+、、K+14. 膳食平衡是人体健康的重要保证。蛋白质是构成细胞的基本物质,下列食物中富含蛋白质的是( )A、大米、小麦 B、牛奶、鸡蛋 C、花生油、猪油 D、黄瓜、苹果15. 下图表示a、b、c三种物质的溶解度曲线。下列说法正确的是( )
A、反应前后各元素化合价不变 B、该化学变化中发生改变的微粒是原子 C、该反应不符合质量守恒定律 D、参加反应的CO2和H2分子个数比为1:310. 硅是信息技术的关键材料。从石英砂制取芯片的重要反应是SiO2+2C Si+2CO↑,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应11. 下列实验现象描述正确的是( )A、镁条在空气中燃烧,发出白光,生成黑色固体 B、细铁丝在氧气中燃烧,火星四射,生成了四氧化三铁 C、铁锈与稀盐酸反应后溶液颜色由无色变成了黄色 D、将紫色石蕊试液滴入到稀氢氧化钠溶液中变红12. 元素观、微粒观是化学的重要观念。下列有关元素和微粒的说法不正确的是( )A、分子、原子和离子都是成物质的粒子 B、同种元素的原子核内质子数与中子数一定相等 C、元素的原子序数与该元素原子核电荷数在数值上相同 D、在物质发生化学变化时,原子的种类不变,元素的种类也不会改变13. 下列各组离子在水中能大量共存的是( )A、K+、、H+ B、Ca2+、、Na+ C、Fe3+、OH−、Cl− D、Ba2+、、K+14. 膳食平衡是人体健康的重要保证。蛋白质是构成细胞的基本物质,下列食物中富含蛋白质的是( )A、大米、小麦 B、牛奶、鸡蛋 C、花生油、猪油 D、黄瓜、苹果15. 下图表示a、b、c三种物质的溶解度曲线。下列说法正确的是( ) A、P点表示t1℃时a、b溶液的溶质质量分数相等 B、t1℃时a、c饱和溶液升温到t2℃,均变为不饱和 C、a中含有少量b时,可采用蒸发结晶的方法提纯a D、t1℃时,125克b的饱和溶液中,含有b物质25克16. 下列归纳总结完全正确的一组是( )
A、P点表示t1℃时a、b溶液的溶质质量分数相等 B、t1℃时a、c饱和溶液升温到t2℃,均变为不饱和 C、a中含有少量b时,可采用蒸发结晶的方法提纯a D、t1℃时,125克b的饱和溶液中,含有b物质25克16. 下列归纳总结完全正确的一组是( )A.化学与社会发展
B.化学与健康
①广泛使用太阳能能有效减少碳排放
②普通玻璃属于无机非金属材料
③煤燃烧产生的二氧化硫易形成酸雨
①缺碘会引起骨质疏松
②糖类是人体最主要的供能物质
③为补充蛋白质只吃肉类不吃蔬菜
C.化学与安全
D.化学实验中的先与后
①进入溶洞前做灯火实验
②煤气泄露立即开灯查找泄露
③煤炉上放盆水防止CO中毒
①制取气体:先加药品后检查装置气密性能
②称量一定质量药品:先加药品后加砝码
③可燃性气体燃烧:先验纯后点燃
A、A B、B C、C D、D17. 下列实验中提供的方案不能达到目的的是( )A、除去CO2气体中混有的少量CO,可将混合气体通过足量灼热的CuO粉末 B、不需要加入其他任何试剂就能鉴别出NaOH、NaCl、MgCl2、CuSO4四种溶液 C、除去CuCl2溶液中混有的少量FeCl2 , 可加入过量铁粉,过滤 D、鉴别NH4NO3固体和NaOH固体,可以加水溶解18. 下列图像正确反映对应变化关系的是( )A、 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
B、
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
B、 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C、
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C、 加热一定质量的高锰酸钾
D、
加热一定质量的高锰酸钾
D、 氢气还原一定质量的氧化铜
氢气还原一定质量的氧化铜
二、填空题
-
19. 坚持“人与自然和谐共生”是新时代中国特色社会主义的基本方略之一,让“山更绿,水更清,空气更清新”是我们共同的追求。(1)、“山更绿”离不开绿色植物。
①植物光合作用需要吸收空气中的水和(填化学式)可有效减缓温室效应。
②酸雨不利于植物生长。煤燃烧产生的(填化学式)进入大气后可形成“硝酸型”酸雨。
(2)、“水更清”就得保护好水资源。“赤潮”或“水华”主要是由于水中某些营养元素含量过高,导致藻类大量繁殖,鱼类等死亡。这里的营养元素主要指(填元素符号,写出一种即可)。
(3)、“空气更清新”需要监测防治大气污染①目前未计入空气污染指数监测项目的有(填字母)。
A.一氧化碳 B.二氧化氮 C.可吸入颗粒物 D.二氧化碳
②硝酸工厂排放的尾气中常含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收。则X的化学式为。
20. 图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的结构示意图,仔细分析答题: (1)、图甲中,铝元素的信息有处不正确,请加以改正;(2)、铝原子的相对原子质量 ;(3)、图乙中,属于稳定结构的原子是 (填序号, 下同);(4)、图乙中,与铝不属于同一周期元素的是。21. 某可燃物燃烧后生成的产物中有二氧化碳、二氧化硫和一氧化碳,则该可燃物中一定含有元素,可能含有元素.22. 学好化学能使我们更好、更轻松、更合理地解决实际问题。请回答下列问题:(1)、家里炒菜时油锅着火,最好的方法是;(2)、某些胃病患者胃酸过多,常服用一些含氢氧化铝的药物,有关反应的化学方程式为。(3)、烧煤气(主要成分CO)的家用燃气灶,改烧天然气后,需要对空气进气管进行改造,请分别写出煤气和天然气在空气中燃烧的化学方程式:;。由此可知,改造后燃气灶的空气进气管直径应(填“增大”或“减小”)。23. 回答以下问题:(1)、实验室配制100g10%的氯化钠溶液时,需要g氯化钠固体。(2)、称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是下图的(填字母)。
(1)、图甲中,铝元素的信息有处不正确,请加以改正;(2)、铝原子的相对原子质量 ;(3)、图乙中,属于稳定结构的原子是 (填序号, 下同);(4)、图乙中,与铝不属于同一周期元素的是。21. 某可燃物燃烧后生成的产物中有二氧化碳、二氧化硫和一氧化碳,则该可燃物中一定含有元素,可能含有元素.22. 学好化学能使我们更好、更轻松、更合理地解决实际问题。请回答下列问题:(1)、家里炒菜时油锅着火,最好的方法是;(2)、某些胃病患者胃酸过多,常服用一些含氢氧化铝的药物,有关反应的化学方程式为。(3)、烧煤气(主要成分CO)的家用燃气灶,改烧天然气后,需要对空气进气管进行改造,请分别写出煤气和天然气在空气中燃烧的化学方程式:;。由此可知,改造后燃气灶的空气进气管直径应(填“增大”或“减小”)。23. 回答以下问题:(1)、实验室配制100g10%的氯化钠溶液时,需要g氯化钠固体。(2)、称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是下图的(填字母)。 (3)、量取水时需要用(选填“10mL”、“50mL”、“100mL”)量筒。24. 维生素C俗称抗坏血酸,常用于治疗坏血病造成的不良血管破裂出血,为了解维生素C的化学性质,我们将6片维生素C碾碎,溶于10mL水,然后过滤,取几毫升滤液,做以下实验:(1)、将滤液滴在蓝色石蕊试纸上,试纸呈红色,再用pH试纸测得该滤液的pH在1至2之间,说明维生素C具有性。(2)、在CuSO4溶液中加入滤液并加热煮沸,发现有红色的铜析出,从氧化还原的角度说明维生素C具有性。25. 某化学实验兴趣小组的同学向含有Fe(NO3)2和Cu(NO3)2的混合溶液中加入一定质量的镁粉,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则滤渣中一定含有的物质是(用化学用语表示,下同),滤液中可能含有的阳离子是 , 向滤渣中加入稀硫酸,一定发生的反应是。26. 某工业园区甲、乙两化工厂排放的废水中含有K+、Cu2+、Fe3+、Cl-、OH-、NO
(3)、量取水时需要用(选填“10mL”、“50mL”、“100mL”)量筒。24. 维生素C俗称抗坏血酸,常用于治疗坏血病造成的不良血管破裂出血,为了解维生素C的化学性质,我们将6片维生素C碾碎,溶于10mL水,然后过滤,取几毫升滤液,做以下实验:(1)、将滤液滴在蓝色石蕊试纸上,试纸呈红色,再用pH试纸测得该滤液的pH在1至2之间,说明维生素C具有性。(2)、在CuSO4溶液中加入滤液并加热煮沸,发现有红色的铜析出,从氧化还原的角度说明维生素C具有性。25. 某化学实验兴趣小组的同学向含有Fe(NO3)2和Cu(NO3)2的混合溶液中加入一定质量的镁粉,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则滤渣中一定含有的物质是(用化学用语表示,下同),滤液中可能含有的阳离子是 , 向滤渣中加入稀硫酸,一定发生的反应是。26. 某工业园区甲、乙两化工厂排放的废水中含有K+、Cu2+、Fe3+、Cl-、OH-、NO2-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来严重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水呈碱性。
(1)、甲厂废水中一定含有的离子是(填离子符号,下同),可能含有的离子是;(2)、经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是 , 过滤后的废水中主要含有两种物质(填化学式),处理后的废水符合排放标准。三、综合题
-
27. 钛和钛合金被认为是21世纪的重要金属材料,他们具有很多优良性能,如熔点高、密度小、可塑性好等。以钛铁矿(主要成分为FeTiO3 , 同时含有少量的Fe2O3、FeO等)为原料制TiO2 , 再由TiO2 , 制金属Ti的工艺流程如下:

【查阅资料】钛、镁在高温下能与空气中的氧气、二氧化碳等反应。
(1)、在生产生活中,钛和钛合金常见的用途为(写一种即可)。(2)、操作2的名称是。(3)、该工艺流程中,水解属于(填“物理变化”或“化学变化”)。(4)、工业上常在高温下用金属镁和TiCl4反应的方法制备Ti,试写出反应的化学方程式。(5)、该反应需要在氩气的氛围中进行,氩气的作用是。(6)、写出工艺流程中生成硫酸铁的化学方程式。28. 实验课上,同学们利用下列装置进行气体制备的学习。请回答下列问题: (1)、用装置A制取O2的化学方程式为;(2)、装置B或C均可用于实验室制取氢气,与装置B相比,装置C的优点是;(3)、实验室可用装置D、E或F收集气体,收集O2和CO2都能用的装置是。(填序号)29. 某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深。(1)、【提出问题】溶液红色加深,则反应后溶液的碱性(填“增强”、“不变”或“减弱”)。(2)、为确定气体和固体的成分,该同学进行了如下的探究。
(1)、用装置A制取O2的化学方程式为;(2)、装置B或C均可用于实验室制取氢气,与装置B相比,装置C的优点是;(3)、实验室可用装置D、E或F收集气体,收集O2和CO2都能用的装置是。(填序号)29. 某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深。(1)、【提出问题】溶液红色加深,则反应后溶液的碱性(填“增强”、“不变”或“减弱”)。(2)、为确定气体和固体的成分,该同学进行了如下的探究。①点燃产生的气体,火焰为淡蓝色:将燃烧产物通入澄清石灰水中,无现象。则该气体为〔写化学式)。
②对白色固体做出如下猜测并进行实验:
(3)、【猜想与假设】查阅资料1:Mg(HCO3)2能溶于水。
猜想一:白色固体可能是MgCO3;
猜想二:白色固体可能是;
猜想三:白色固体可能是MgCO3和Mg(OH)2。
(4)、【进行实验】取洗净后的白色固体,加入足量的稀盐酸,观察到 , 则白色固体一定含有MgCO3。
(5)、为进一步确定白色固体的组成,该同学进行了定量实验:称取干燥的白色固体22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重1.8g,则白色固体中含有 , 再通过足量氢氧化钠溶液,溶液增重8.8g,则固体中各成分的质量比为(化成最简整数比)。
(6)、实验中氢氧化钠溶液增重的原因(用化学方程式表示)。四、计算题
