浙教版科学八下第二章 阶段性测试(四) [范围:微粒的模型与符号(2.1~2.3)]
试卷更新日期:2022-03-25 类型:同步测试
一、选择题(每题3分,共42分)
-
1. 下列各项中不属于模型的是( )A、
 B、
B、 C、
C、 D、
D、 2. 2021年4月,我国科学家首次合成的铀-214,是目前已知质量最小的铀原子。其相对原子质量为214,质子数是92。则铀-214原子的核外电子数为( )A、92 B、122 C、214 D、3063. 关于下列四种分子的分析不正确的是( )
2. 2021年4月,我国科学家首次合成的铀-214,是目前已知质量最小的铀原子。其相对原子质量为214,质子数是92。则铀-214原子的核外电子数为( )A、92 B、122 C、214 D、3063. 关于下列四种分子的分析不正确的是( ) A、一个水分子和一个二氧化碳分子都由三个原子构成 B、比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成 C、原子都比分子体积小 D、比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成4. 从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质。从下列图中不能获取的信息是( )
A、一个水分子和一个二氧化碳分子都由三个原子构成 B、比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成 C、原子都比分子体积小 D、比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成4. 从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质。从下列图中不能获取的信息是( ) A、构成物质的粒子之间有空隙 B、硅原子是由原子核和电子构成的 C、构成物质的粒子有分子、原子和离子 D、受热使水分子运动速率加快5. 下列有关原子的说法中正确的是( )A、原子不显电性是因为在原子中不存在带电荷的粒子 B、原子中的质子数与中子数一定相等 C、原子中质子数和核外电子数相等 D、原子是不能再分的最小粒子6. 某些物质是由原子构成的,原子是由电子、质子与中子等更微小的粒子所构成。若以
A、构成物质的粒子之间有空隙 B、硅原子是由原子核和电子构成的 C、构成物质的粒子有分子、原子和离子 D、受热使水分子运动速率加快5. 下列有关原子的说法中正确的是( )A、原子不显电性是因为在原子中不存在带电荷的粒子 B、原子中的质子数与中子数一定相等 C、原子中质子数和核外电子数相等 D、原子是不能再分的最小粒子6. 某些物质是由原子构成的,原子是由电子、质子与中子等更微小的粒子所构成。若以 分别代表电子、中子与质子,则下列各示意图中,带正电的是( ) A、
分别代表电子、中子与质子,则下列各示意图中,带正电的是( ) A、 B、
B、 C、
C、 D、
D、 7. 下列关于Mg、Mg2+两种粒子的判断中不正确的是( )A、核电荷数相同 B、质量几乎相等 C、中子数相同 D、电荷数相同8. 稀土元素包括镧(La)与钇(Y)等17种元素,被称为当代的“工业味精”。镧、钇原子的本质区别是( )A、电子数不同 B、中子数不同 C、质子数不同 D、原子质量不同9. 树林中含有抗氧化防衰老的负氧离子。一种负氧离子( )的一个原子团是由一个O2分子俘获了空气中一个自由电子形成的微粒,每个 中共含有的电子数为( )A、8 B、9 C、16 D、1710. 某原子A的质子数为a,若B3+和A2-具有相同的核外电子数,则B元素的质子数为( )A、a+1 B、a-1 C、a+5 D、a-511. 下列关于分子、原子、离子的理解错误的是( )A、分子、原子、离子都是构成物质的微粒 B、原子通过得失电子变成离子,但离子不能变成原子 C、原子的内部含有带电的微粒,但原子不显电
7. 下列关于Mg、Mg2+两种粒子的判断中不正确的是( )A、核电荷数相同 B、质量几乎相等 C、中子数相同 D、电荷数相同8. 稀土元素包括镧(La)与钇(Y)等17种元素,被称为当代的“工业味精”。镧、钇原子的本质区别是( )A、电子数不同 B、中子数不同 C、质子数不同 D、原子质量不同9. 树林中含有抗氧化防衰老的负氧离子。一种负氧离子( )的一个原子团是由一个O2分子俘获了空气中一个自由电子形成的微粒,每个 中共含有的电子数为( )A、8 B、9 C、16 D、1710. 某原子A的质子数为a,若B3+和A2-具有相同的核外电子数,则B元素的质子数为( )A、a+1 B、a-1 C、a+5 D、a-511. 下列关于分子、原子、离子的理解错误的是( )A、分子、原子、离子都是构成物质的微粒 B、原子通过得失电子变成离子,但离子不能变成原子 C、原子的内部含有带电的微粒,但原子不显电性,由原子构成的分子也不显电性
D、离子是带电的原子或原子团12. 石墨烯是从石墨中分离出来的一层或多层碳原子构成的石墨片,下列相关说法中正确的是( )A、石墨烯不可以转变成金刚石,因为它们组成的元素种类相同 B、超导材料适合用来做家庭电路中输电导线 C、石墨烯属于单质,但不具有可燃性 D、石墨烯和石墨互为同位素13. 核外电子数相同,核内质子数不同的两种粒子,它们可能是( )①一种元素的原子和另一种元素的离子 ②同种元素的原子和离子
③两种不同元素的原子 ④两种不同元素的离子
A、①③ B、①④ C、②③ D、③④14. 如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法中正确的是( ) A、该原子核外有6个电子 B、该原子的核电荷数为4 C、该原子带电 D、该原子核由2个质子和2个中子构成
A、该原子核外有6个电子 B、该原子的核电荷数为4 C、该原子带电 D、该原子核由2个质子和2个中子构成二、填空题(每空3分,共45分)
-
15. 碘是紫黑色晶体,可以溶解在汽油中形成紫红色溶液。(1)、碘的汽油溶液中,溶质是 , 溶剂是。(2)、甲、乙、丙三个同学分别画出如图所示的示意图,表示溶液中碘分子的分布(汽油分子没有画出)。

根据你在实验中观察到的现象可知,(填“甲”“乙”或“丙”)的示意图符合事实。
16. 如图是锂原子的结构示意图,根据图示信息回答下列问题: (1)、锂元素的原子序数为。(2)、锂原子核内有个质子,核外有个电子。(3)、下列对原子构成的理解错误的是 (填字母)。A、原子整体不显电性 B、原子核比原子小得多 C、原子核是不可分割的实心球体 D、原子质量主要集中在原子核上17. 如图是电解水的过程中水分子分解的示意图。
(1)、锂元素的原子序数为。(2)、锂原子核内有个质子,核外有个电子。(3)、下列对原子构成的理解错误的是 (填字母)。A、原子整体不显电性 B、原子核比原子小得多 C、原子核是不可分割的实心球体 D、原子质量主要集中在原子核上17. 如图是电解水的过程中水分子分解的示意图。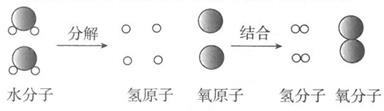 (1)、从微观粒子角度,水通电时,水分子分裂成和 , 分裂出来的又重新组合成 ,它们不再有水的化学性质。可见,是保持水的化学性质的最小微粒。(2)、由该实验可知,分子由构成,是化学变化中的最小粒子。分子和原子的本质区
(1)、从微观粒子角度,水通电时,水分子分裂成和 , 分裂出来的又重新组合成 ,它们不再有水的化学性质。可见,是保持水的化学性质的最小微粒。(2)、由该实验可知,分子由构成,是化学变化中的最小粒子。分子和原子的本质区别是 。
三、实验探究题(共13分)
-
18. 如表是几种原子的构成情况,三位同学认真思考后,提出了各自的观点。
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
镁
12
12
12
24
小光:原子里质子数等于核外电子数。
小红:相对原子质量=质子数十中子数。
小伟:原子都是由质子、中子和核外电子构成的。
老师听了三位同学提出的观点后说:“大家总结得非常好,都开动了脑筋,体现了良好的求知态度。
但有一位同学的结论不准确,需要加以修正,而且表中还隐藏着其他的一些结论。
请你认真分析三位同学的观点,并对照上表回答下列问题。
(1)、三位同学的结论中,不准确的是的观点,理由是。(2)、从表中你还能得出的结论有(至少写出两条)。19. 探究原子结构的奥秘。[情境提供]19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验]1911年英国科学家卢瑟福进行了著名的a粒子轰击金属箔的实验。如图所示:
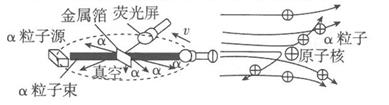
①放射源——放射性物质放出 a粒子(带正电荷),质量是电子质量的7 000倍;
②金属箔——作为靶子,厚度 1 μm,重叠了3 000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
[收集证据]绝大多数α粒子穿过金属箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大角度的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达180°,像是被金属箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构。上,否则大角度的散射是不可能的。
[解释与结论]
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。(2)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为 (填字母)。A、 道尔顿模型特点:不可再分的实心球体
B、
道尔顿模型特点:不可再分的实心球体
B、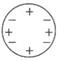 汤姆生模型特点:正负电荷均匀分布
C、
汤姆生模型特点:正负电荷均匀分布
C、 卢瑟福模型特点:核位于原子中心,质量集中在核上
卢瑟福模型特点:核位于原子中心,质量集中在核上