初中科学2022年中考二轮复习专题:15化学解答题
试卷更新日期:2022-03-24 类型:二轮复习
一、解答题
-
1. A是地壳中含量最高的金属元素铝,B元素的一种气体单质是支持人类呼吸的氧气,C元素是原子核外只有两个电子的氦。请写出相应的化学符号:(1)、A和B组成的化合物 , C元素组成的气体单质。(2)、已知高锰酸钾的化学式为 , 在化学式中的钾、锰元素符号上分别标出他们的化合价 。2. 珍爱生命,拒绝毒品”是每个公民的责任,但是在某些娱乐场所,还有人服用俗称“摇头丸”的毒品。该毒品能使人手舞足蹈,呈癫狂状态,严重危害人的身心健康和社会稳定。有一种“摇头丸”的化学式为 , 相对分子质量为209。试回答下列问题。(1)、该物质的一个分子中,含个氢原子。(2)、该物质中碳元素与氧元素的质量比为多少?(3)、氮元素所占的质量分数为多少?3. 人体中钙元素主要以羟基磷酸钙晶体 形式存在于骨略和牙齿中,而牛奶是含钙丰富又易吸收的理想食品,下图为某乳业公可纯奶包装标签:
配料:鲜牛奶
净含量: /盒
营养成分(每 )
蛋白质
钙
保质期:8个月
(1)、羟基磷酸钙由种元素组成;(2)、羟基磷酸钙中钙、氧元素的质量比为多少(写出计算过程)(3)、若人体每天至少需要 钙,每天已从食物中摄入所需钙的一半,则每天至少要喝这种牛奶盒。(4)、除了喝牛奶以外,青少年还可以通过服用含碳酸钙 的钙片来补钙。求 碳酸钙 和多少质量的氢氧化钙 所含的钙元素质量相等?(写出计算过程)4. 2011年3月11日,日本近海发生9.0级强烈地震,从而引发核泄露危机,核事故时往往泄漏出污染物(具有放射性的碘原子)。为避免核辐射,需一次性口服100毫克(不具放射性的碘原子),使人体甲状腺中碘达到饱和而不再吸收外界的碘,从而起到保护作用。请回答:(1)、碘-131是一种质子数为53、中子数为78的碘原子。该原子核外电子数为。(2)、存在于自然界中的另外一种碘原子“碘-127”,其核内质子数是53,中子数是74,它与碘-131的关系是____。A、同种元素 B、同种物质 C、同种分子 D、同种原子(3)、假设所处的环境已受污染,通过服用加碘食盐(注:加碘食盐中的碘为)的方法能否有效起到避免核辐射的目的呢?【查阅资料】成人每天食用食盐的质量通常为6 g;某种加碘食盐的标签如图所示。
配料表:氯化钠、碘酸钾()
净含量:500 g
碘含量(以I计):
【问题分析】500 g该品牌食盐中,含碘的最大质量是。
【结论】日常服用加碘食盐能否起到避免核辐射目的? , 原因是。
5. 阿司匹林是防止心血管病发生的常用药物,它具有抗血栓防止心肌梗塞等作用。阿司匹林又称乙酰水杨酸,化学式为C6H13O5N。 (1)、人体有维持体温恒定的调节机制,健康人的体温一般为左右。阿斯匹林进入循环系统后,可作用于脑干中(下丘脑)的中枢。此中枢会监视血液温度,引发身体产热或散热的反应.阿斯匹林因此有退烧作用(2)、乙酰水杨酸中各元素的质量比为C:H:O:N=(3)、若每片药剂含C6H13O5N 90%,某成人每天服用此药物2片,该成人每天从药物中摄入N元素多少毫克?(请写出计算过程,计算结果精确到0.1.假设药片其它成分中不含N元素)6. 钱江晚报报道浙江沿海地区“碘过量”。食物中碘过量易引起有患甲状腺疾病,眼球突出,脖子粗大,身体消瘦。因此呼吁大家再也不能吃加碘盐了。某兴趣小组就沿海地区甲状腺疾病患者明显增多的现象,开展了“沿海地区城镇居民甲状腺肿瘤流行病学调查”,提出“浙江沿海地区食盐中是否有必要加碘值得关注”。
(1)、人体有维持体温恒定的调节机制,健康人的体温一般为左右。阿斯匹林进入循环系统后,可作用于脑干中(下丘脑)的中枢。此中枢会监视血液温度,引发身体产热或散热的反应.阿斯匹林因此有退烧作用(2)、乙酰水杨酸中各元素的质量比为C:H:O:N=(3)、若每片药剂含C6H13O5N 90%,某成人每天服用此药物2片,该成人每天从药物中摄入N元素多少毫克?(请写出计算过程,计算结果精确到0.1.假设药片其它成分中不含N元素)6. 钱江晚报报道浙江沿海地区“碘过量”。食物中碘过量易引起有患甲状腺疾病,眼球突出,脖子粗大,身体消瘦。因此呼吁大家再也不能吃加碘盐了。某兴趣小组就沿海地区甲状腺疾病患者明显增多的现象,开展了“沿海地区城镇居民甲状腺肿瘤流行病学调查”,提出“浙江沿海地区食盐中是否有必要加碘值得关注”。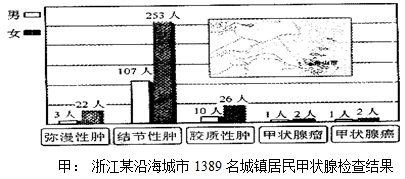 (1)、如图甲是上述调查得到的图表之一,此图表能够反映出的信息是____;A、该地区居民中患甲状腺瘤的男性人数是女性的一半 B、该地区女性居民更容易患甲状腺疾病 C、该地区居民中甲状腺疾病患者明显增多 D、该地区居民比其他地区居民更容易患甲状腺疾病(2)、碘是合成甲状腺激素的重要原料之一。加碘食盐中的碘,是指:____;A、碘原子 B、碘元素 C、含碘的化合物 D、含碘的单质(3)、如下表为某品牌食盐的产品说明,其中“含碘量(35±15)mg/kg”符合国家食盐含碘量的标准。以含碘量35毫克/千克为标准,食盐厂家应该在1千克食盐中加入多少毫克碘酸钾。(结果取整数)(4)、“碘是一把双刃剑”,碘过量也会引起甲状腺疾病。初中生每天碘元素适宜摄入量约为0.15毫克,假设碘元素全部来自“加碘盐”,你一天最多可以摄入含碘量为35毫克/千克的食盐多少克?(结果保留一位小数)
(1)、如图甲是上述调查得到的图表之一,此图表能够反映出的信息是____;A、该地区居民中患甲状腺瘤的男性人数是女性的一半 B、该地区女性居民更容易患甲状腺疾病 C、该地区居民中甲状腺疾病患者明显增多 D、该地区居民比其他地区居民更容易患甲状腺疾病(2)、碘是合成甲状腺激素的重要原料之一。加碘食盐中的碘,是指:____;A、碘原子 B、碘元素 C、含碘的化合物 D、含碘的单质(3)、如下表为某品牌食盐的产品说明,其中“含碘量(35±15)mg/kg”符合国家食盐含碘量的标准。以含碘量35毫克/千克为标准,食盐厂家应该在1千克食盐中加入多少毫克碘酸钾。(结果取整数)(4)、“碘是一把双刃剑”,碘过量也会引起甲状腺疾病。初中生每天碘元素适宜摄入量约为0.15毫克,假设碘元素全部来自“加碘盐”,你一天最多可以摄入含碘量为35毫克/千克的食盐多少克?(结果保留一位小数)产品标准号
GB5461—2000
配 料
精制食盐(NaCl)碘酸钾(KIO3)
质量等级
一级
含 碘 量
(35±15)mg/kg
食用方法
待食品熟后加入碘盐
储藏方法
密封保存、防潮防热
分装日期
见封口
7. 2020年9月,习近平在联大针对气候变化表示:“中国将力争碳排放于2030年前达到峰值,争取在2060年前实现碳中和。”如下图是一种利用NaOH溶液实现“碳捕获”的技术主要流程。当高浓度的二氧化碳经过吸收器.分离器和反应器后以低浓度排出从而达到碳减排目的。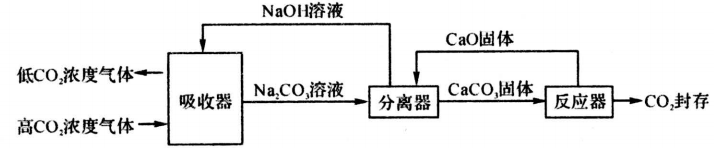 (1)、吸收器中,NaOH溶液用喷淋方式加入,其优点是。(2)、用该技术进行“碳捕获"有效利用了原材料,在该过程中被循环利用的物质有。(3)、分离器中,有溶质质量分数为10.6%的Na2CO3 溶液100千克,求完全反应后,理论上可生成CaCO3的质量(要求根据化学方程式计算)。8. 台风是湖州地区夏天常见的自然灾害。
(1)、吸收器中,NaOH溶液用喷淋方式加入,其优点是。(2)、用该技术进行“碳捕获"有效利用了原材料,在该过程中被循环利用的物质有。(3)、分离器中,有溶质质量分数为10.6%的Na2CO3 溶液100千克,求完全反应后,理论上可生成CaCO3的质量(要求根据化学方程式计算)。8. 台风是湖州地区夏天常见的自然灾害。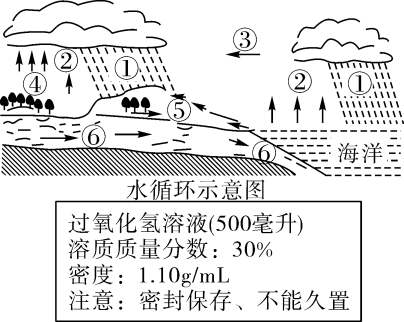 (1)、右图为水循环示意图,台风能加强(填图中数字)环节,给陆地带来强降水。(2)、台风、洪灾过后,为防止细菌、病毒传染,水淹后的房间应及时消毒。过氧化氢溶液俗称双氧水,是常用消毒剂。小科要配制220克质量分数为15%的过氧化氢溶液,需要右图所示的过氧化氢溶液多少毫升?请写出计算过程。(3)、如果用量筒量水时仰视读数.则所配制的溶液中溶质质量分数会(填“偏大”、“偏小”或“不变”)。9. 农民伯伯在挑选种子时,要挑选颗粒饱满的当作种子,通常用 10%-20%的食盐溶 液选种。现需配制 200 千克质量分数为 16%的食盐溶液, 问:(1)、需要食盐千克;(2)、你认为农民伯伯该挑选(选填“浮在液面上”或“沉入盐水中”) 的用作 种子;(3)、取上述配制好的质量分数为 16%的食盐溶液 45 千克, 配制成质量分数变为 9%的食盐 水,则需加多少千克水?10. 疫情时期广泛使用的二氧化氯是国际上公认的安全、高效消毒剂,它能够迅速、彻底杀灭各种细菌和病毒.现有一瓶二氧化氯消毒液,瓶上的标签如下表。
(1)、右图为水循环示意图,台风能加强(填图中数字)环节,给陆地带来强降水。(2)、台风、洪灾过后,为防止细菌、病毒传染,水淹后的房间应及时消毒。过氧化氢溶液俗称双氧水,是常用消毒剂。小科要配制220克质量分数为15%的过氧化氢溶液,需要右图所示的过氧化氢溶液多少毫升?请写出计算过程。(3)、如果用量筒量水时仰视读数.则所配制的溶液中溶质质量分数会(填“偏大”、“偏小”或“不变”)。9. 农民伯伯在挑选种子时,要挑选颗粒饱满的当作种子,通常用 10%-20%的食盐溶 液选种。现需配制 200 千克质量分数为 16%的食盐溶液, 问:(1)、需要食盐千克;(2)、你认为农民伯伯该挑选(选填“浮在液面上”或“沉入盐水中”) 的用作 种子;(3)、取上述配制好的质量分数为 16%的食盐溶液 45 千克, 配制成质量分数变为 9%的食盐 水,则需加多少千克水?10. 疫情时期广泛使用的二氧化氯是国际上公认的安全、高效消毒剂,它能够迅速、彻底杀灭各种细菌和病毒.现有一瓶二氧化氯消毒液,瓶上的标签如下表。二氧化氯消毒液1升
溶质的质量分数
60%
密度
1.2克/厘米3
强腐蚀性,阴冷,密封储藏
(1)、二氧化氯消毒液的溶剂是。(2)、请算出这瓶二氧化氯消毒液中溶质的质量。(3)、欲配制72千克质量分数为1 %的稀二氧化氯消毒液,需要这种浓二氧化区消毒液多少毫升?11. 学校某兴趣小组做了氧化铜和盐酸反应的实验,小虎为测定反应后混合溶液的成分及含量,向烧杯中分5次共加入200克10%的氢氧化钠溶液,得到沉淀的质量记录如下:加入NaOH溶液的质量/克
40.0
80.0
120.0
160.0
200.0
生成沉淀的质量/克
0.0
2.45
7.35
9.8
9.8
(1)、分析实验过程,第一次加入40.0克氢氧化钠溶液,为什么没有生成沉淀?。(2)、分析实验过程,如果加入 90 克 NaOH 溶液,溶液中的溶质是。(3)、原来混合溶液中氯化铜的质量为多少克?(写出计算过程)(4)、若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会造成计算氯化 铜的含量。(填“偏高”、“偏低”或“不变”)12. 甲图所示是一种全景漂浮房屋,其底部是一个浮动平台,使房屋可以轻松地在水中四处移动;房屋内还安装了先进的污水净化装置和温度调节设备。 (1)、若一艘大船快速地从漂浮房屋一侧驶过时,漂浮房屋会 (选填“靠近”或"远离")大船。(2)、漂浮房周围的水经过净化、消毒等一系列处理后能供人饮用,乙图所示是一种活性炭净水器示意图,为使净化效果更好,进水口应在图中的处(填字母), 经过这样净化后得到的水属于(填“纯净物”或"混合物")。
(1)、若一艘大船快速地从漂浮房屋一侧驶过时,漂浮房屋会 (选填“靠近”或"远离")大船。(2)、漂浮房周围的水经过净化、消毒等一系列处理后能供人饮用,乙图所示是一种活性炭净水器示意图,为使净化效果更好,进水口应在图中的处(填字母), 经过这样净化后得到的水属于(填“纯净物”或"混合物")。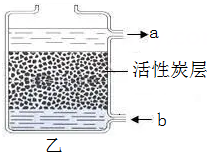 (3)、人体内也有“净化装置”,当血液流经肾小球时,除血细胞和 外,血液中的其它成分,都可以过滤到肾小囊中形成原尿。(4)、在漂浮房屋的屋顶种植一些草类、花卉等植物,并配置相应的传感器与灌溉技术既美观又可降室温,能降温的原因是。13. 某同学为探究铜铁合金中铁的质量分数,先后进行了四次实验,实验数据如表。请分析与计算:
(3)、人体内也有“净化装置”,当血液流经肾小球时,除血细胞和 外,血液中的其它成分,都可以过滤到肾小囊中形成原尿。(4)、在漂浮房屋的屋顶种植一些草类、花卉等植物,并配置相应的传感器与灌溉技术既美观又可降室温,能降温的原因是。13. 某同学为探究铜铁合金中铁的质量分数,先后进行了四次实验,实验数据如表。请分析与计算:第一次
第二次
第三次
第四次
所取合金的质量/g
10
10
20
20
所加稀硫酸的质量/g
100
120
80
180
生成氢气的质量/g
0.2
0.2
0.2
X
(1)、表中X=;(2)、第次实验中,稀硫酸过量;(3)、求铜铁合金中铁的质量分数;(4)、求所加稀硫酸的溶质质量分数。14. 氢气被视为未来理想的能源,科学家对氢的研究从未停歇。氢能源的广泛使用需解决制氢、储氢等问题。
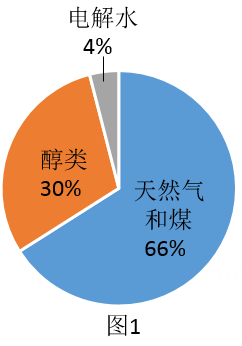
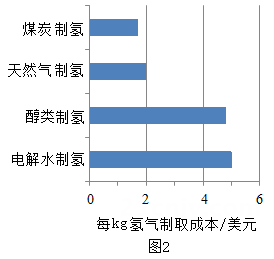
(1)、图1、图2分别为全球制氢原料占比和主流制氢方法的经济性对比图。①由图象可知:日前氢气的主要来源是(填“天然气和煤"、“醇类"或“水"),选择该原料制氢的可能原因是 ;
②电解水制氢需要消耗大量的电能,下列获取电能的方式中,一定存在碳排放的是(选填字母)。
A.水力发电
B.太阳能发电
C.燃煤发电
D.核能发电
(2)、氢气的储存有以下两种方式:①方法一:将氢气直接加压储存在由某种镁铝合金制造的储氢罐中备用。从物质分类的角度来看,镁铝合金属于 (填“纯净物"或“混合物");
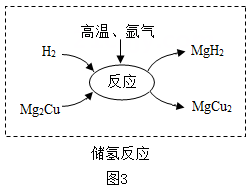
②方法二:先通过Mg,Cu与氢气反应,将氢气转化为MgH2暂时“储存”起来,此为储氢反应(如图3);需要使用氢气时,可通过释氢反应实现: MgH2 +2HCl =MgCl2 +2H2↑。请写出储氢反应的化学方程式。 如果将储氢反应生成的MgH2全部与足量稀盐酸反应,则释放出来的H2质量参加储氢反应的H2质量(填“大于”、“等于“或“小于”)。
(3)、采用氢能源的“未来汽车”正逐渐出现在我们的生活中,氢能源汽车主要有氨内燃汽车和氢燃料电池车两种。①从理论上讲,在其它条件相同的情况下,携带相同质量的燃料,氢内燃汽车要比普通燃油汽车行驶更远的距离,这主要是因为氢气的大;
②2013年,我国首辆氢燃料电池电动机车“蓝天号”成功运行。该车采用功率为150kW的电机,其转化为机械能的效率为90%,那么当该车以18m/s的速度匀速行驶时,能产生多大的牵引力?
15. 在每年的杨梅季结束后,果农为了给杨梅果园杀菌灭虫需要喷洒农药,小明爸爸觉得农药A低毒高效。该农药的产品信息标签如图:农药A
规格: 100mL
质量分数: 20%
密度: 1.1g/cm3
求:
(1)、这100毫升农药A的质量是g,其中溶质是g。(2)、小明爸爸欲配制20kg质量分数为4%的该农药来给杨梅果园杀菌灭虫,需要多少千克农药A和多少千克水?16. 图甲是一款简易呼吸器,可用于人工呼吸急救,图乙是它的工作原理。急救时,让制氧罐中的制氧剂产生氧气,打开进气阀,氧气进入气囊。按压气囊,气囊内气压增大,进气阀关闭,呼吸阀门自动打开,病人就可从面罩口吸入氧气。限压阀可以控制气压,当气压过大时,限压阀会打开,让气体排出。制氧剂的主要成分如下表,反应原理:2Na2CO4 2Na2CO3+O2↑。
制氧剂成分
质量/包
A剂:过碳酸钠(Na2CO3)
50克/包
B剂:二氧化锰(MnO2)
5克/包
(1)、限压阀的压强值可以人工设定,为呼吸暂停的病人急救时,限压阀的压强设定值P1与病人肺内气压值P2的大小关系是P1P2。(填“大于”、“小于”或“等于”)(2)、小明查阅资料发现,普通供氧时加入制氧剂为“2A+1B”(2包A剂和1包B剂),供氧速度约为0.8克/分钟。急救时需要提供1.5克/分钟的氧气,持续16分钟,那么添加“4A+2B”剂量,能否满足要求,请通过计算说明。(3)、请结合该简易呼吸器的功能和工作原理,推测气袋的作用是。17. 使用一定浓度消毒液对物品和环境进行消毒,可以阻止传染病传播。图甲为某含氯消毒片的相关信息。图乙为不同消毒对象所对应的消毒液含氯浓度。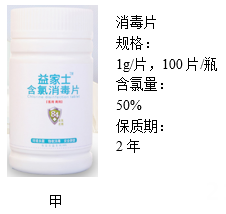
消毒对象
消毒液含氯浓度
食具果蔬
0.5%
家庭环境
1%
卫生洁具
2%
污染物品
3%
(1)、消毒液需即配即用,因为存放过程中有效成分挥发而导致浓度变。(2)、小红将10片消毒片加入1L水配制成一定浓度的消毒液,计算分析其所配制消毒液的消毒对象。18. 疫情时期广泛使用的二氧化氯是国际上公认的安全、高效消毒剂,它能够迅速、彻底杀灭各种细菌和病毒。现有一瓶二氧化氯消毒液,瓶上的标签如下表。二氧化氯消毒液 1升
溶质的质量分数
60%
密度
1.2克/厘米3
强腐蚀性,阴冷,密封储藏
(1)、二氧化氯消毒液的溶剂是。(2)、请算出这瓶二氧化氯消毒液中溶质的质量。(3)、欲配制72千克质量分数为1 %的稀二氧化氯消毒液,需要这种浓二氧化氯消毒液多少毫升?19. 2021年12月9日,航天员王亚平在太空授课时将半片泡腾片放入蓝色水球中,水球不断变大,里面出现大量气泡,但气泡并没有从水球中跑出来,让大家看得直呼神奇。看完后小宁对泡腾片起了浓厚的兴趣,他发现家中有一瓶维C泡腾片,仔细观察成分表发现其主要成分是维生素C(C6H8O6)、碳酸氢钠、柠檬酸(C6H8O7)。(1)、泡腾片中的维生素C(C6H8O6)属于。(填“有机物”或“无机物”)(2)、泡腾片中的柠檬酸(C6H8O7)中碳、氢元素的质量比为。(3)、小宁想通过实验确定泡腾片加入水中后溶液的酸碱性,他可以使用。(填序号)①pH试纸 ②紫色石蕊试液 ③无色酚酞
20. 某科学兴趣小组为探究酸的化学性质,将一定量的稀硫酸加入到盛有少量氧化铜的烧杯中,观察到黑色粉末全部溶解,他们取124.5g该反应后溶液于烧杯中,然后将120g氢氧化钠溶液分六次加入其中,每次充分反应后过滤,称量所得溶液的质量及产生沉淀的质量,测量数据如表所示。第1次
第2次
第3次
第4次
第5次
第6次
加入氢氧化钠溶液的质量/g
20
0
20
20
20
20
反应后溶液的质里/g
144.5
164.5
179.6
189.8
200
220
每次产生沉淀的质量g
0
0
m
n
9.8
0
请回答:
(1)、上述表格中产生沉淀的质量n=。(2)、求所加氢氧化钠溶液的溶质质量分数。(3)、写出124.5g反应后溶液中的溶质(填化学式),并计算每种溶质的质量。(写出计算过程)21. 如图为实验室某浓硫酸试剂瓶标签中的部分内容。请回答: (1)、实验室需要配制19.6%的稀硫酸500g,则需用该浓硫酸多少毫升?需加入水的体积多少毫升?(写出计算过程)(2)、电解水的实验中常加入一定量的稀硫酸,目的是。某次实验时,在一定量的蒸馏水中加入配制好的19.6%的稀硫酸50g进行电解,结束后测得剩余溶液的质量为100g,已知电解前后硫酸溶质质量不变。请计算剩余溶液中溶质的质量分数。(计算结果保留一位小数)22. 小科同学在盛有约20℃水的烧杯中加入了硝酸钾固体,充分溶解后溶液的温度降到10℃左右,此时烧杯中还有大量固体剩余。再往溶液中放入一块木块,放置了一段较长时间,随着环境温度的变化,发生了如图ABCD所示的顺序变化。请回答:
(1)、实验室需要配制19.6%的稀硫酸500g,则需用该浓硫酸多少毫升?需加入水的体积多少毫升?(写出计算过程)(2)、电解水的实验中常加入一定量的稀硫酸,目的是。某次实验时,在一定量的蒸馏水中加入配制好的19.6%的稀硫酸50g进行电解,结束后测得剩余溶液的质量为100g,已知电解前后硫酸溶质质量不变。请计算剩余溶液中溶质的质量分数。(计算结果保留一位小数)22. 小科同学在盛有约20℃水的烧杯中加入了硝酸钾固体,充分溶解后溶液的温度降到10℃左右,此时烧杯中还有大量固体剩余。再往溶液中放入一块木块,放置了一段较长时间,随着环境温度的变化,发生了如图ABCD所示的顺序变化。请回答: (1)、硝酸钾固体溶于水后,溶液温度下降的原因。(2)、根据图示的现象,请判断在此过程中硝酸钾溶液温度的变化。(3)、请结合所学知识,解释烧杯内硝酸钾固体量变化及木块沉浮变化的原因。(硝酸钾溶解度随温度变化如下表)
(1)、硝酸钾固体溶于水后,溶液温度下降的原因。(2)、根据图示的现象,请判断在此过程中硝酸钾溶液温度的变化。(3)、请结合所学知识,解释烧杯内硝酸钾固体量变化及木块沉浮变化的原因。(硝酸钾溶解度随温度变化如下表)温度(℃)
0
10
20
30
40
50
60
70
硝酸钾(克)
13.3
20.9
32
45.8
64
85.5
110
138
23. 研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据:温度/℃
20
30
40
50
60
80
100
溶解度/g
21.8
39.7
48.8
47.3
46.4
45.1
44.7
(1)、由表中数据可知,碳酸钠属于物质(填“易溶”、“可溶”、“微溶”或“难溶”)。(2)、由表中数据可知,碳酸钠的溶解度随温度升高而。(3)、小东同学进行了如图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入克碳酸钠,升温至60℃时,烧杯④中会出现现象。 24. 咸鸭蛋是中国特色食品,风味独特、营养丰富深受人们喜爱。其腌制过程如下:(1)、第一步:挑选鸭蛋。将鸭蛋放入食盐溶液,通过观察鸭蛋的浮沉情况进行挑选。现有四种食盐溶液供选择,其溶质质量分数与密度关系如表一。鸭蛋的新鲜情况与其密度变化如图一。分析图一和表一信息,应选用表一中溶质质量分数为的食盐溶液才能挑选出新鲜鸭蛋。
24. 咸鸭蛋是中国特色食品,风味独特、营养丰富深受人们喜爱。其腌制过程如下:(1)、第一步:挑选鸭蛋。将鸭蛋放入食盐溶液,通过观察鸭蛋的浮沉情况进行挑选。现有四种食盐溶液供选择,其溶质质量分数与密度关系如表一。鸭蛋的新鲜情况与其密度变化如图一。分析图一和表一信息,应选用表一中溶质质量分数为的食盐溶液才能挑选出新鲜鸭蛋。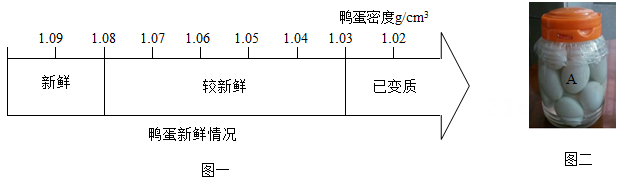
表一食盐溶液溶质质量分数与密度对照表
溶质质量分数
溶液密度 (g/cm})
2%
1.01
6%
1.03
10%
1.07
15%
1.10
(2)、第二步:配制溶液。使用溶质质量分数过大的食盐溶液,鸭蛋的水分流失快、味咸且口感不鲜;使用溶质质量分数过小的食盐溶液,防腐能力较差、营养价值会降低。人们常选用质量分数为10%-20%的食盐溶液。现配制4000毫升质量分数为15%食盐溶液,需要食盐多少克。(3)、第三步:浸泡腌制。将鸭蛋放入容器再倒入15%食盐溶液将其浸没,加盖保存,如图二所示。图二中鸭蛋A的体积为80cm3 , 计算鸭蛋A所受的浮力大小。25. 现有一含杂 质的碳酸钙样品(杂质不含钙元素)。取该样品200 g,经测定,样品中钙元素的质量分数为30%,请计算:(1)、该样品中钙元素的质量。(2)、碳酸钙(CaCO3)中钙元素的质量分数。(3)、该样品中含碳酸钙的质量。(4)、该样品中碳酸钙的质量分数。26. 鲨鱼是世界上唯一不患癌症的动物,研究发现其体内含有的角鲨烯(化学式为C30H50)有 抗癌作用。试计算:(1)、角鲨烯中碳、氢两种元素的质量比为。(2)、41 g角鲨烯与多少克水中所含氢元素的质量相等?27. 为适应不同人群的需要,市场上供应的食盐除普通碘盐外还有无碘盐、低钠盐和健康平衡盐等,现有两种品牌的食盐A和B,主要成分的含量见表:(注:两种食盐仅NaCl中含有钠元素:35.1 g/100 g表示每100g食盐中含钠元素质量为35.1 g)
食盐种类
食盐A
食盐B
主要成分的含量
35.1 g/100 g(以钠元素质量计)
93.0 g/100 g(以NaCl 质量计)
(1)、KIO3在物质分类上属于(填“混合物”“单质”或“化合物”)。(2)、请计算比较食盐A、B中NaCl含量较高的是 (填“A”或“B”)。(3)、食盐中的Na+既可增加食物的咸味,又是人体必需的无机盐。但卫生机构建议,人体每天钠元素的摄入量不超过2.3 g。如果人体所需的钠元素全部来源于食盐,那么,一个人食用食盐A每天摄入量不宜超过g(结果精确到0.01)。(4)、了解有关食品添加剂知识后,当你在选购食品时应该 (填字母)。A、尽量选择加工度低的食品,以免摄入过多的添加剂 B、尽量选择色、香、味俱全的食品,以保证口味 C、多关注食品营养表中添加剂的品种和用量 D、只关注食品的营养成分,不在乎是否含有添加剂28. 某化肥厂的墙体上做了一个大型户外广告,如图所示,根据相关信息回答下列问题。xx牌化肥——国际首创
主要成分:碳酸氢铵( NH4HCO3)
含氮量居全球化肥之首: 24.1%
净含量: 50 kg/袋
x x化肥有限责任公司出品
(1)、碳酸氢铵中氮元素的质量分数是多少? (精确到0.1%)(2)、判断该广告属于“真实”广告还是“虚假”广告?(3)、当地质检部门对该厂生产的化肥做了质量检测,该化肥的实际含氮量仅有11.7%,试计算每袋这样的化肥实际含氮元素的质量是多少?该产品中碳酸氢铵的质量分数为多少? (要求写出计算过程)29. “84”消毒液是常用的杀菌消毒剂,下面是“84”消毒液的产品说明书。产品品名
“84”消毒液
主要原料
次氯酸钠(NaClO),有效含氯量大于等于5%
主要作用
瓜、餐具、厨房用品;白色衣物及物体表面;肝炎、病毒性感冒及肺炎患者的污染物
产品规格
500g
(1)、NaClO中钠、氯、氧三种元素的原子个数比是。(2)、NaClO中氯元素的化合价为 。(3)、计算NaClO中氯元素的质量分数。(写出计算过程)(4)、该消毒液中至少含有次氯酸钠的质量是多少?(写出计算过程,结果精确到0.1)30. 近几年,诺如病毒日趋严重,并出现了许多变种,尤其是教室内空气流通不畅,学生比较容易感染。最有效的预防方法之一就是用消毒液对教室空气消毒。学校采用的二氧化氯消毒液是国际上公认的新一代强力,广谱,安全,高效的消毒剂,已被世界卫生组织(WHO)列为A1级安全消毒剂。二氧化氯消毒液能够迅速,彻底杀灭各种细菌(大肠杆菌,白色念珠菌等)和病毒(肝炎病毒,流感病毒等)。小科同学观察到瓶上的标签如下表所示。二氧化氯( )1000毫升
溶质质量分数
80%
密度
1.2克/厘米3
强腐蚀性,阴冷,密封储藏
(1)、这1000毫升二氧化氯消毒液中含溶质二氧化氯多少克。(2)、若将这1000毫升二氧化氯消毒液与5000克水均匀混合。所得稀二氧化氯溶质质量分数是多少。(保留小数点后一位)(3)、我校欲配制30千克质量分数为20%的稀二氧化氯消毒液,需要多少千克这样的二氧化氯消毒液和多少千克水?(写出计算过程)31. 某同学在化工颜料店发现一种“银粉”,他猜想该“银粉”可能是银粉、铝粉或锌粉中的一种。为了确定“银粉”的成分,他将一小包“银粉”带回实验室,并进行了如下实验和相关分析。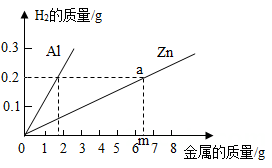 (1)、取少量“银粉”于试管中,滴加适量盐酸,观察到有产生,说明“银粉”一定不是银。(2)、为了进一步确定“银粉”是铝还是锌,他通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图象。在绘制锌的图象时,a点所对应的锌的质量m为多少?(通过计算回答)(3)、取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是 ▲ 。计算实验中所用稀盐酸的溶质质量分数。32. 碳排放导致全球变暖,极端天气事件增加。2020年9月22日,我国政府承诺:中国力争于2030年前实现“碳达峰”、2060年前实现“碳中和”目标。“碳达峰”是指在某一个时点,二氧化碳的排放不再增长,达到峰值,之后逐步回落;“碳中和”是指在一定时间内,通过植树造林等途径,抵消自身所产生的二氧化碳排放量,实现二氧化碳“零排放”。(1)、植物的光合作用是自然界消耗二氧化碳的最重要途径之一,人们称其为地球上最重要的能量转化过程。请说出植物进行光合作用时,能量形式发生的转化。(2)、“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。在实际生产中,经常用NaOH溶液来“捕捉”CO2 , 流程如图所示(部分条件及物质未标出)。
(1)、取少量“银粉”于试管中,滴加适量盐酸,观察到有产生,说明“银粉”一定不是银。(2)、为了进一步确定“银粉”是铝还是锌,他通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图象。在绘制锌的图象时,a点所对应的锌的质量m为多少?(通过计算回答)(3)、取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是 ▲ 。计算实验中所用稀盐酸的溶质质量分数。32. 碳排放导致全球变暖,极端天气事件增加。2020年9月22日,我国政府承诺:中国力争于2030年前实现“碳达峰”、2060年前实现“碳中和”目标。“碳达峰”是指在某一个时点,二氧化碳的排放不再增长,达到峰值,之后逐步回落;“碳中和”是指在一定时间内,通过植树造林等途径,抵消自身所产生的二氧化碳排放量,实现二氧化碳“零排放”。(1)、植物的光合作用是自然界消耗二氧化碳的最重要途径之一,人们称其为地球上最重要的能量转化过程。请说出植物进行光合作用时,能量形式发生的转化。(2)、“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。在实际生产中,经常用NaOH溶液来“捕捉”CO2 , 流程如图所示(部分条件及物质未标出)。

①“反应、分离”过程中发生的化学反应除了CaO+H2O=Ca(OH)2 , 还会发生另外一个反应,其化学方程式为A,通过这两个反应可以让NaOH循环利用起来。
②二氧化碳的资源化利用是一个世界性难题。2020年9月25日,二氧化碳加氢制甲醇的关键技术及工程示范项目通过了评估,该技术的大规模应用,让碳减排真正有利可图。二氧化碳加氢制甲醇的反应原理可以表示为:CO2+3H2催化剂 CH3OH+H2O。试计算生产4.8吨甲醇,可回收空气中的CO2多少吨?
(3)、为实现“碳达峰”“碳中和”目标,风能、太阳能和生物质能将成为未来的主要能源。某小区路灯利用与太阳能电池板相连的蓄电池作电源,已知蓄电池电压为12V、容量为24A·h(安·小时)。若路灯的规格为“12V、24W”,充满电的蓄电池可供路灯连续工作多少小时?
33. 通过水的电解实验,我们知道了水的组成。请回答以下问题:(1)、在水中加入稀硫酸,其作用是;(2)、写出电解水的文字表达式;(3)、若实验中用4%的稀硫酸150克,通电一段时间后,稀硫酸溶质质量分数变为5%,忽略水的蒸发,求被电解的水的质量。