初中科学2022年中考二轮复习专题:11物质的鉴别与推断
试卷更新日期:2022-03-24 类型:二轮复习
一、单选题
-
1. 如果试剂只有水,常温下,不能将各种物质分别鉴别出来的一组是( )A、BaCO3、Zn(OH)2、Ca(NO3)2 B、Na、Hg、Ag C、Mg(OH)2、CuSO4、KNO3 D、NaOH、NaCl、NH4NO32. 浙江省博物馆近期展出了三星堆遗址出土的重量级文物——青铜面具,面具上的铜绿【Cu2(OH)2CO3】属于( )A、酸 B、碱 C、盐 D、氧化物3. 下列实验方案合理的是( )
选项
实验目的
所用试剂或方法
A
稀释浓硫酸
把水倒入浓硫酸中,不断搅拌
B
鉴别NaCl溶液和稀盐酸
向盛有两种溶液的试管中分别滴入AgNO3溶液
C
除去NaOH溶液中的Na2CO3
加入适量的Ca(OH)2溶液、搅拌、过滤
D
验证Zn、Cu、Fe的金属活动性强弱
将铜片分别插入ZnSO4和FeSO4溶液中
A、A B、B C、C D、D4. 2021年,温州多个小区开展垃圾分类投放,实现回收利用。如生活废旧镉电池内的硫酸镉(CdSO4)回收后可作为生产新电池的原料。按物质的组成分类,硫酸镉属于( )A、酸 B、碱 C、盐 D、氧化物5. 下列对各组成分的鉴别,根据现象得出的结论正确的是( )鉴别
方法
现象
结论
A
鉴别固体中的成分(含有BaCl2、Na2SO4、Na2CO3中的一种或几种)
取部分样品溶于水中
产生白色沉淀
一定有BaCl2、Na2SO4 , 可能有Na2CO3
B
鉴别溶液中的溶质(含有Na2SO4、Na2CO3、NaNO3中的一种或几种)
取部分溶液,先加入足量的稀盐酸,再加入氯化钡溶液
产生气泡;产生白色沉淀
一定有Na2SO4、Na2CO3 , 可能有NaNO3
C
鉴别气体的成分(含有CO、H2、H2O中的一种或几种)
将气体先后通入装有氧化铜的玻璃管中,再对玻璃管加热→无水硫酸铜→澄清石灰水
黑色的氧化铜变红;无水硫酸铜变蓝;澄清石灰水变浑浊
一定有CO、H2、H2O
D
鉴别生成的沉淀(含有Mg(OH)2、BaCO3、AgCl中的一种或几种)
过滤得到的沉淀中加入足量的稀硝酸
沉淀部分溶解,产生气泡
一定有Mg(OH)2、BaCO3、AgCl
A、A B、B C、C D、D6. 一包固体可能由硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某兴趣小组设计并开展以下实验。其中,步骤I中固体全部消失,溶液呈蓝色,无气泡产生,步骤II、III中均可观察到有白色沉淀生成。下列说法正确的是( )
 A、步骤I的实验现象说明原固体中一定没有氢氧化钠 B、步骤II所得的白色固体中一定含有碳酸钡 C、步骤II所得蓝色滤液中含有的阳离子只有3种 D、原固体中一定有硝酸铜、硫酸钠,可能有氯化钠、氢氧化钠7. 下列图象能正确反映其对应关系的是( )
A、步骤I的实验现象说明原固体中一定没有氢氧化钠 B、步骤II所得的白色固体中一定含有碳酸钡 C、步骤II所得蓝色滤液中含有的阳离子只有3种 D、原固体中一定有硝酸铜、硫酸钠,可能有氯化钠、氢氧化钠7. 下列图象能正确反映其对应关系的是( )
 A、图①:向一定量的石灰石中加入过量的稀盐酸 B、图②:探究重力势能大小与物体质量之间的关系 C、图③:将一定量的淀粉酶和淀粉混合后,逐渐升温 D、图④:向等质量的铝和铁中加入同种稀盐酸至过量8. 用一种试剂就能直接区分KOH、H2SO4、NaNO3三种无色溶液,这种试剂是( )A、酚酞 B、氯化镁溶液 C、紫色石蕊 D、稀盐酸9. 下列实验设计或操作正确,且能达到实验目的的是( )
A、图①:向一定量的石灰石中加入过量的稀盐酸 B、图②:探究重力势能大小与物体质量之间的关系 C、图③:将一定量的淀粉酶和淀粉混合后,逐渐升温 D、图④:向等质量的铝和铁中加入同种稀盐酸至过量8. 用一种试剂就能直接区分KOH、H2SO4、NaNO3三种无色溶液,这种试剂是( )A、酚酞 B、氯化镁溶液 C、紫色石蕊 D、稀盐酸9. 下列实验设计或操作正确,且能达到实验目的的是( )序号
实验目的
实验方案
A
区分氢氧化钠溶液和氢氧化钙溶液
取样品,加入碳酸钠溶液
B
用pH试纸测定溶液的酸碱性
将pH试纸进入待测液体
C
探究稀盐酸和氢氧化钠溶液是否完全反应
向反应后溶液中加入硝酸银溶液
D
除去氢氧化钠溶液中的碳酸钠
滴加稀盐酸,直到刚好无气泡产生
A、A B、B C、C D、D10. 小红同学向盐酸与氯化钡的混合溶液中逐滴滴入碳酸钠溶液至过量。记录滴入的碳酸钠溶液的质量(x)与有关量的变化关系如图所示。下列判断正确的是( )
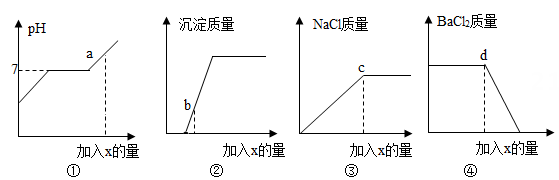 A、①图中,当碳酸钠溶液加至a点时,溶液中Na2CO3正与BaCl2发生反应 B、②图中,当碳酸钠溶液加至b点时,所得溶液的pH=7 C、③图中,当碳酸钠溶液加至c点时,溶液中含有的溶质是氯化钠和氯化钡 D、④图中,当碳酸钠溶液加至d点时,溶液中BaCl2与Na2CO3恰好反应完全11. 一包不纯的Na2CO3固体,杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是( )A、加水得澄清溶液,样品中一定没有CaCl2 B、样品中一定含有NaCl,可能含有NaHCO3 C、样品中杂质可能只含有NaCl D、所加的稀盐酸溶质质量分数大于7.3%12. 一定质量的Zn加入到含有Fe(NO3)2和AgNO3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )
A、①图中,当碳酸钠溶液加至a点时,溶液中Na2CO3正与BaCl2发生反应 B、②图中,当碳酸钠溶液加至b点时,所得溶液的pH=7 C、③图中,当碳酸钠溶液加至c点时,溶液中含有的溶质是氯化钠和氯化钡 D、④图中,当碳酸钠溶液加至d点时,溶液中BaCl2与Na2CO3恰好反应完全11. 一包不纯的Na2CO3固体,杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是( )A、加水得澄清溶液,样品中一定没有CaCl2 B、样品中一定含有NaCl,可能含有NaHCO3 C、样品中杂质可能只含有NaCl D、所加的稀盐酸溶质质量分数大于7.3%12. 一定质量的Zn加入到含有Fe(NO3)2和AgNO3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )①滤液中一定有Zn2+、Fe2+ ②滤液中可能有Ag+ ③滤渣中一定有Ag,可能有Fe
A、①② B、①③ C、②③ D、①②③13. 利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象: A试管溶液变红色, B试管中有白色沉淀生成。则残留液中含有的溶质有( ) A、盐酸 B、碳酸钠 C、硫酸钠 D、氯化钠14. 小科把家里的一种白色粉末拿到学校实验室进行实验,如图,则该粉末( )
A、盐酸 B、碳酸钠 C、硫酸钠 D、氯化钠14. 小科把家里的一种白色粉末拿到学校实验室进行实验,如图,则该粉末( )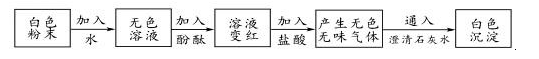 A、可能是碳酸钠 B、可能是碳酸钙 C、一定是一种碱 D、一定是生石灰15. 有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
A、可能是碳酸钠 B、可能是碳酸钙 C、一定是一种碱 D、一定是生石灰15. 有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:溶液
甲+乙
乙+丙
丙+丁
甲+丁
现象
无明显现象
白色沉淀
白色沉淀
无色气体
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
A、HCl、BaCl2、Na2CO3、H2SO4 B、Na2CO3、BaCl2、H2SO4、HCl C、H2SO4、HCl、Na2CO3、BaCl2 D、HCl、H2SO4、BaCl2、Na2CO3二、填空题
-
16. 为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:
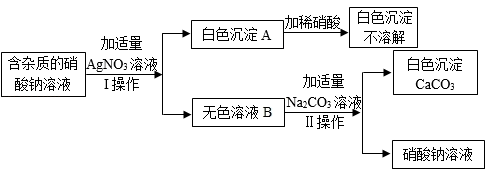
请回答下列问题:
(1)、I,Ⅱ为操作。(2)、经分析,原溶液中的杂质可能由一种或几种物质组成。杂质的成分可能是:若原溶液中的杂质由一种物质组成,则该杂质是。17. 有一包白色固体,可能由BaCl2 、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。
 (1)、白色沉淀C的化学式为。(2)、这包白色固体是由(填化学式)组成的。18. 有一包粉末,可能含有碳酸钙、氧化铁、氧化铜、木炭粉中的一种或几种,现做实验如下:
(1)、白色沉淀C的化学式为。(2)、这包白色固体是由(填化学式)组成的。18. 有一包粉末,可能含有碳酸钙、氧化铁、氧化铜、木炭粉中的一种或几种,现做实验如下:
(1)高温加热混合物,产生能使澄清石灰水变浑浊的气体;
(2)向剩余残渣中加入足量稀盐酸,残渣全部溶解且放出可燃性气体。由此推断:原混合物中一定含有 , 可能含有;
若要确认可能含有物质是否存在,可设计如下实验:。
19. 一包白色固体粉末,可能由氯化钠、氢氧化钠、碳酸钠、硫酸钠、氢氧化钙中的一种或几种组成,为了探究这包粉末的组成,进行以下实验:(提示:碳酸钠溶液具有弱碱性)①取少量样品,加水溶解,无现象。加入足量的稀盐酸,有气泡产生。
②另取少量样品,加水溶解,滴加无色酚酞试液,溶液变红色。
③取第②步红色溶液,进行了如下实验。
 (1)、白色沉淀M是。(填名称)(2)、加入的试剂X是。(填化学式)(3)、通过上述实验确定该白色粉末中一定含有。(填化学式)20. “低钠盐”可以控制钠的摄入量,从而防治高血压等疾病。某品牌低钠盐中含70%的氯化钠、25%的氯化钾及5%的镁盐。(1)、利用该品牌低钠盐配制得到的溶液中,数量最多的离子是。(2)、若所加镁盐只可能是硫酸镁和氯化镁中的一种,为确认其成分,可用加以鉴别。(写出一种物质)(3)、人体中的钾主要通过肾脏排出,若钾含量过高会导致心率不齐等症状。专家建议高温作业者、重体力劳动者不宜长时间吃低钠盐,其原因是。21. 有一包白色粉末,可能含有Na2CO3、Na2SO4、NaCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如下图所示:
(1)、白色沉淀M是。(填名称)(2)、加入的试剂X是。(填化学式)(3)、通过上述实验确定该白色粉末中一定含有。(填化学式)20. “低钠盐”可以控制钠的摄入量,从而防治高血压等疾病。某品牌低钠盐中含70%的氯化钠、25%的氯化钾及5%的镁盐。(1)、利用该品牌低钠盐配制得到的溶液中,数量最多的离子是。(2)、若所加镁盐只可能是硫酸镁和氯化镁中的一种,为确认其成分,可用加以鉴别。(写出一种物质)(3)、人体中的钾主要通过肾脏排出,若钾含量过高会导致心率不齐等症状。专家建议高温作业者、重体力劳动者不宜长时间吃低钠盐,其原因是。21. 有一包白色粉末,可能含有Na2CO3、Na2SO4、NaCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如下图所示:
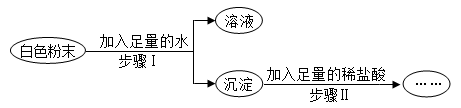 (1)、如果步骤Ⅱ中沉淀全部溶解,写出步骤Ⅰ中生成沉淀的化学方程式。(2)、如果步骤Ⅱ中沉淀部分溶解,则原白色粉末中一定含有。22. 有一包固体,可能含有锌粉、碳粉、氧化铜、氢氧化钾、氯化钠中的一种或几种。为探究该固体组成,某科学兴趣小组的成员进行了如图所示的实验。
(1)、如果步骤Ⅱ中沉淀全部溶解,写出步骤Ⅰ中生成沉淀的化学方程式。(2)、如果步骤Ⅱ中沉淀部分溶解,则原白色粉末中一定含有。22. 有一包固体,可能含有锌粉、碳粉、氧化铜、氢氧化钾、氯化钠中的一种或几种。为探究该固体组成,某科学兴趣小组的成员进行了如图所示的实验。请回答下列问题:
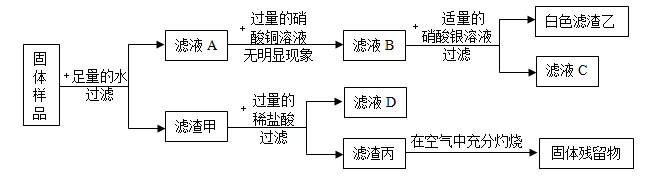 (1)、原固体中一定不含有一种物质,理由是。(2)、原固体中一定含有的物质是。23. 物质王国举行击鼓传花的游戏。某学习小组由铁、氢气、氧化铜、二氧化碳、稀硫酸、氢氧化钠、氯化铜七名成员组成。游戏的规则是:相互之间能发生反应就可以进行传递。请把上述成员安排在A-G的相应位置上,使花束能从A传到G。其中 A为组长,其固体俗称为干冰,F为副组长,其为黑色固体,请回答:
(1)、原固体中一定不含有一种物质,理由是。(2)、原固体中一定含有的物质是。23. 物质王国举行击鼓传花的游戏。某学习小组由铁、氢气、氧化铜、二氧化碳、稀硫酸、氢氧化钠、氯化铜七名成员组成。游戏的规则是:相互之间能发生反应就可以进行传递。请把上述成员安排在A-G的相应位置上,使花束能从A传到G。其中 A为组长,其固体俗称为干冰,F为副组长,其为黑色固体,请回答: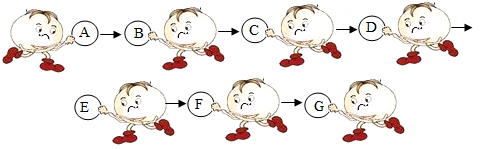 (1)、氢氧化钠应放在位置上。(2)、C和D反应的化学方程式为。(3)、当G换成另一个与G同类别的物质时就能将花束传回起点A,它是(填物质名称)。24. 实验室的某一废液中含有CuCl2、FeCl和AlCl3三种溶质。小科设计了如下流程来回收AlCl3和有关金属。根据以下实验过程和现象回答问题:
(1)、氢氧化钠应放在位置上。(2)、C和D反应的化学方程式为。(3)、当G换成另一个与G同类别的物质时就能将花束传回起点A,它是(填物质名称)。24. 实验室的某一废液中含有CuCl2、FeCl和AlCl3三种溶质。小科设计了如下流程来回收AlCl3和有关金属。根据以下实验过程和现象回答问题:
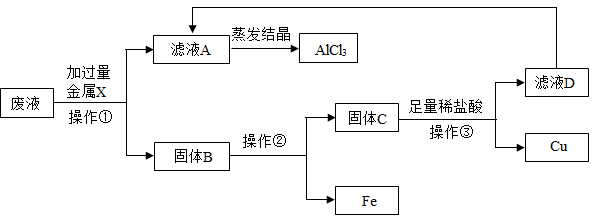 (1)、金属X为(填化学式),操作①需要的玻璃仪器有(写出两种)。(2)、固体B中含金属(填化学式),操作②为 。25. 现有一包不纯的K2CO3固体,可能含有Fe(NO3)3、CaCO3、KCl、BaCl2、Na2SO4、Na2CO3中的一种或几种。某科学小组做了如下实验:(1)、取固体试样溶于足量水,得无色溶液A,则原固体一定不含。(2)、向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C.加入Ba(NO3)2溶液时一定发生反应的化学方程式是。(3)、向固体B中加入足量稀HNO3 , 固体完全溶解,取少量滤液C,先滴加过量稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀,通过以上实验可知,原固体中仍无法确定的物质是。
(1)、金属X为(填化学式),操作①需要的玻璃仪器有(写出两种)。(2)、固体B中含金属(填化学式),操作②为 。25. 现有一包不纯的K2CO3固体,可能含有Fe(NO3)3、CaCO3、KCl、BaCl2、Na2SO4、Na2CO3中的一种或几种。某科学小组做了如下实验:(1)、取固体试样溶于足量水,得无色溶液A,则原固体一定不含。(2)、向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C.加入Ba(NO3)2溶液时一定发生反应的化学方程式是。(3)、向固体B中加入足量稀HNO3 , 固体完全溶解,取少量滤液C,先滴加过量稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀,通过以上实验可知,原固体中仍无法确定的物质是。三、实验探究题
-
26. 有一包白色固体粉末,可能含有硫酸铜、氯化钡、硫酸钠、碳酸钠、氯化钠中的一种或几种,某同学对其组成进行了探究,过程如下:
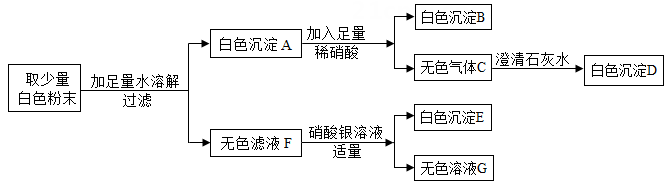 (1)、沉淀B的化学式是(2)、原混合物中可能含有的物质是(3)、写出由C生成D的反应化学方程式27. H2、CO和CO2都是初中化学常见的气体。(1)、可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先。(2)、某无色气体X可能含有上述3种气体中的一种或几种。为了确认气体X的组成,同学们按下图装置进行实验。(小资料:碱石灰的主要成分是CaO和NaOH)
(1)、沉淀B的化学式是(2)、原混合物中可能含有的物质是(3)、写出由C生成D的反应化学方程式27. H2、CO和CO2都是初中化学常见的气体。(1)、可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先。(2)、某无色气体X可能含有上述3种气体中的一种或几种。为了确认气体X的组成,同学们按下图装置进行实验。(小资料:碱石灰的主要成分是CaO和NaOH)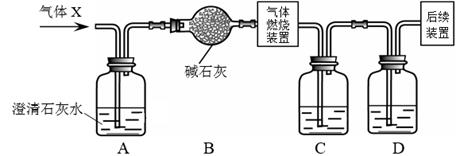
①装置C、D中盛放的试剂依次是。(填序号)
a.烧碱溶液 b.浓硫酸
②若取一定质量的气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C和装置D质量均增加。则气体X的组成是。
28. 实验室有两瓶失去标签的无色溶液,分别是澄清石灰水和氢氧化钠溶液。(1)、为了鉴别它们:先把两支试管分别贴上标签①、②,然后进行如下实验。实验步骤
实验现象
结论
取少量未知无色溶液于①②两支试管中,分别滴加碳酸钠溶液
①中无明显现象
②中产生白色沉淀
①试管中加入的无色溶液为
(2)、继续探究②试管反应后溶液中溶质的成分。【提出问题】反应后溶液中溶质的成分是什么?
【作出猜想】猜想一:氢氧化钠
猜想二:
猜想三:氢氧化钠和碳酸钠
(3)、【验证猜想】若通过下列实验得出猜想三成立,请写出相应的实验过程与现象。实验过程
实验现象
实验结论
猜想三成立
29. 小乐借鉴网上资料腌制松花蛋。她先将纯碱和食盐加入容器中,然后用沸水溶解,接着慢慢加入生石灰充分反应,冷却后得到料液,最后将鸭蛋放入其中浸渍一段时间。回答问题:(1)、生石灰加入沸水中,水能持续保持沸腾,其原因是。(2)、小乐对冷却后得到的料液产生了浓厚的兴趣;于是取了适量料液(上层清液),对其中的溶质进行探究。①小乐认为,料液中一定存在NaCl和NaOH,料液中一定有NaOH的原因是(用化学方程式表示)。
②小乐猜想,料液中还有可能存在Ca(OH)2或Na2CO3 , 于是进行了如下实验:
实验1:取少量上层清液放入试管中,滴加少量Na2CO3溶液,有白色沉淀。
实验2:取少量上层清液放入试管中,滴加过量稀盐酸,没有明显现象。
由此可以得出,该料液中除NaOH与NaCl外,还含有(填写化学式)。
30. 某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):根据流程图回答问题:
 (1)、反应④的化学方程式为。(2)、根据实验现象推断该混合物中一定含有的物质是( 填化学式)。(3)、该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是(填化学式),其质量为g。
(1)、反应④的化学方程式为。(2)、根据实验现象推断该混合物中一定含有的物质是( 填化学式)。(3)、该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是(填化学式),其质量为g。四、解答题
-
31. 某化肥厂以“钾泻盐”(MgSO4·KCl·nH20)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:

试可答下列问题;
(1)、加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了外,还生成了微溶的Ag2SO4。(2)、方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)外,一定含有的溶质是。(3)、该钾泻盐样品中KCl的质量分数为多少?(精确到1%)(4)、该钾泻盐化学式中n的值是多少?(要写出计算过程)32. 某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。回答下列问题: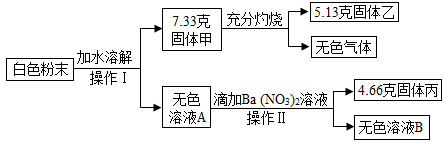 (1)、固体甲的成分是。(2)、无色气体的质量是多少克?(3)、白色粉末中肯定含有的物质总质量。33. 丢弃的废铜屑(其中混有少量铁屑),活动小组的同学欲利用其制取胆矾晶体(CuSO4·5H2O),他们设计了下面的两种制取流程。已知:
(1)、固体甲的成分是。(2)、无色气体的质量是多少克?(3)、白色粉末中肯定含有的物质总质量。33. 丢弃的废铜屑(其中混有少量铁屑),活动小组的同学欲利用其制取胆矾晶体(CuSO4·5H2O),他们设计了下面的两种制取流程。已知:①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O②2Cu+2H2SO4(稀)+O2 2CuSO4+2H2O;
请回答:
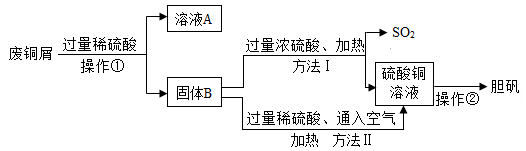 (1)、操作①名称是。(2)、溶液A的溶质有(写化学式)(3)、比较上述两种方法,符合绿色化学要求的是方法(填“Ⅰ”或“Ⅱ”)。(4)、弃置金属会带来环境问题,请你说出一条:。34. 硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+ , 用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如图方法回收Cu和Ag(图中标注的试剂均不同)。
(1)、操作①名称是。(2)、溶液A的溶质有(写化学式)(3)、比较上述两种方法,符合绿色化学要求的是方法(填“Ⅰ”或“Ⅱ”)。(4)、弃置金属会带来环境问题,请你说出一条:。34. 硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+ , 用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如图方法回收Cu和Ag(图中标注的试剂均不同)。 (1)、加入过量Fe粉发生的主要反应为 (写化学方程式)。(2)、试剂1和试剂3的名称依次是 。(3)、若向66g物质1中加入100g试剂2后,恰好完全反应,剩余固体质量为60.4g。求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。35. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图的实验方案:
(1)、加入过量Fe粉发生的主要反应为 (写化学方程式)。(2)、试剂1和试剂3的名称依次是 。(3)、若向66g物质1中加入100g试剂2后,恰好完全反应,剩余固体质量为60.4g。求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。35. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图的实验方案: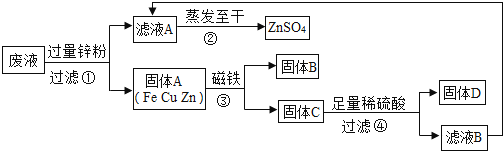 (1)、步骤①中锌粉必须过量的原因是。(2)、要检验步骤④中加入的稀硫酸是否足量的方法是。(3)、若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量(填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量的质量。36. 某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。
(1)、步骤①中锌粉必须过量的原因是。(2)、要检验步骤④中加入的稀硫酸是否足量的方法是。(3)、若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量(填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量的质量。36. 某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。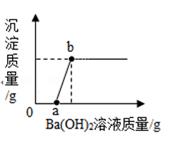 (1)、ab段生成的沉淀是:(填化学式)。(2)、某同学说该溶液中一定没有CuSO4 , 他的理由是。(3)、a中溶液含有种溶质。(4)、原溶液中含有的溶质是。(填化学式)37. 因为缺乏科学知识,有人误把被称为“工业用盐”的亚硝酸钠(化学式NaNO2)当做食盐放进食物。亚硝酸钠对人来说是剧毒的,食用后易造成严重的中毒事件。
(1)、ab段生成的沉淀是:(填化学式)。(2)、某同学说该溶液中一定没有CuSO4 , 他的理由是。(3)、a中溶液含有种溶质。(4)、原溶液中含有的溶质是。(填化学式)37. 因为缺乏科学知识,有人误把被称为“工业用盐”的亚硝酸钠(化学式NaNO2)当做食盐放进食物。亚硝酸钠对人来说是剧毒的,食用后易造成严重的中毒事件。项目
亚硝酸钠
氯化钠
溶解性(15℃)
81.5g
35.8g
熔点
271℃
801℃
水溶液酸碱性
碱性
中性
跟稀盐酸作用
放出红棕色气体NO2
无现象
跟硝酸银溶液作用
生成白色沉淀
生产白色沉淀
(1)、根据亚硝酸钠的化学式,你能否确定什么组成成分是有毒的?(2)、请你阅读上表有关资料,并结合已有的化学知识,设计实验:用两种方法鉴别食盐和亚硝酸钠。①;
②.
38. 图甲中 A 是一种常见的酸,它能与黑色固体 B 反应,B 质量为 8 克。将 NaOH溶液缓缓加入到 C 中,生成的蓝色沉淀 E 与加入 NaOH 溶液的质量关系如图乙所示。在D 中加入 Ba(NO3)2 溶液能生成一种不溶于稀硝酸的白色沉淀。请回答: (1)、A 溶液中溶质的化学式为;(2)、NaOH 溶液的溶质质量分数是多少?(列式计算)(3)、C 溶液中加入 NaOH 溶液至恰好完全反应时,所得溶液溶质质量是多少?(列式计算)39. 某KNO3化肥中可能混进了NH4Cl、(NH4)2SO4、K2CO3三种物质中的一种或几种,同学们对该化肥开展了以下探究活动。
(1)、A 溶液中溶质的化学式为;(2)、NaOH 溶液的溶质质量分数是多少?(列式计算)(3)、C 溶液中加入 NaOH 溶液至恰好完全反应时,所得溶液溶质质量是多少?(列式计算)39. 某KNO3化肥中可能混进了NH4Cl、(NH4)2SO4、K2CO3三种物质中的一种或几种,同学们对该化肥开展了以下探究活动。 (1)、KNO3是一种肥,白色沉淀E是;(2)、加入盐酸,无气泡产生,说明混合物中不含;(3)、小明通过白色沉淀F,认为该化肥中一定混进了NH4Cl和(NH4)2SO4、一定没有K2CO3 , 小强认为这个结论不正确,他的理由是 , 为了使小明的结论正确,小强对上述实验进行了改动,他的做法是;40. 有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动。
(1)、KNO3是一种肥,白色沉淀E是;(2)、加入盐酸,无气泡产生,说明混合物中不含;(3)、小明通过白色沉淀F,认为该化肥中一定混进了NH4Cl和(NH4)2SO4、一定没有K2CO3 , 小强认为这个结论不正确,他的理由是 , 为了使小明的结论正确,小强对上述实验进行了改动,他的做法是;40. 有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动。【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
【活动与探究】取一定量上述固体粉末,加足量水溶解。
(1)、【现象与结论】经上述操作,得到蓝色澄清溶液,则原固体粉末中一定没有和(填化学式)。(2)、【探索与拓展】为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:
①计算产生最大沉淀量时所加NaOH溶液的质量。
②通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量)