浙江省百校2021-2022学年高三下学期开学模拟检测化学试题
试卷更新日期:2022-03-22 类型:开学考试
一、单选题
-
1. 下列物质属于纯净物的是( )A、氯水 B、五水硫酸铜 C、福尔马林 D、磁铁矿2. 下列化合物的类别完全正确的是( )A、Na2CO3、碱、电解质 B、MgO、金属氧化物、非电解质 C、H2SO4、酸、电解质 D、CO2、酸性氧化物、电解质3. 下列物质的化学成分不正确的是( )A、熟石膏: B、摩尔盐: C、阿司匹林:
 D、漂白粉的有效成分:
4. 下列实验操作正确的是( )
D、漂白粉的有效成分:
4. 下列实验操作正确的是( )A
B
C
D
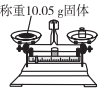


称量10.05g固体
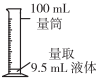
量取9.5mL液体
稀释浓硫酸
滴加液体
A、A B、B C、C D、D5. 下列化学用语使用不正确的是( )A、苯的球棍模型: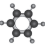 B、的结构示意图:
B、的结构示意图: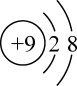 C、分子的结构式:
C、分子的结构式: D、次氯酸的电子式:
D、次氯酸的电子式: 6. 下列说法正确的是( )
6. 下列说法正确的是( )①金刚石和石墨互为同分异构体
②生石灰作干燥剂涉及化学变化
③酸性氧化物都能与水反应生成酸
④碱性氧化物一定是金属氧化物
⑤酸性氧化物一定是非金属氧化物
⑥乙醚和乙醇属于同系物
⑦、互为同素异形体
⑧、互为同位素
A、①③⑥ B、⑥⑦⑧ C、②④ D、②④⑤7. 下列关于化学反应类型描述正确的是( )A、(置换反应) B、(氧化还原反应) C、(消去反应) D、 (缩聚反应)8. 反应中,氧化产物和还原产物的物质的量之比是( )A、1∶2 B、1∶1 C、1∶5 D、5∶19. 下列说法不正确的是( )A、在通常情况下,碘单质是紫黑色固体、易升华 B、铝及其合金是目前产量最大,使用最广泛的金属 C、高纯硅可以制成计算机.通信设备和家用电器等的芯片,以及光伏电站、人造卫星和电动汽车等的硅太阳能电池 D、液氨汽化时吸收大量的热而使周围温度急剧下降,因此可用作制冷剂10. 下列物质与其主要成分的化学式或者说法对应正确的是( )A、侯氏制碱法得到的物质是碱式盐——碳酸钠 B、水玻璃很稳定,长期暴露在空气中也不变质 C、丹霞地貌的岩层因含而呈红色 D、卤素主要单质有、、、等,都能与氢氧化钠溶液发生歧化反应11. 下列实验操作和实验室突发事件应对措施不恰当的是( )A、如果不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸 B、一旦发生火灾,应立即切断室内电源,移走可燃物 C、分离物质的量之比为1∶1的NaCl和固体,采用溶解、蒸发结晶、趁热过滤、冷却结晶的方法 D、中学实验室中可以将未用完的钠、钾、白磷等丢弃至实验水池进行处理12. 下列类比推理结果正确的是( )A、根据主族元素最高正价与族序数的关系,类比推出卤族元素最高正价都是7 B、铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸,类比推出铁或铝制成的槽车可以密封贮运浓盐酸 C、根据反应,类比推出反应 D、根据化合价可写成 , 类比推出可写成13. 下列离子反应方程式不正确的是( )A、氮化钠和水反应: B、溶液腐蚀印刷电路板: C、溶液中通入过量: D、溶液中滴加过量溶液:14. 下列说法正确的是( )A、麦芽糖、纤维二糖和乳糖都是非还原性糖,不能发生银镜反应 B、油脂的硬化过程是油脂和水发生加成反应的过程 C、氨基酸溶于过量氢氧化钠溶液中生成的离子,在直流电场中向阳极移动 D、蛋白质溶液中加入饱和 溶液,能够破坏蛋白质溶解形成的胶体结构而发生变性15. 我国嫦娥五号探测器带回的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z的原子序数依次增大,四种元素最外层电子数之和为15,X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )A、简单离子的半径大小顺序为W>Y>Z>X B、Y元素最高价氧化物对应的水化物具有两性 C、工业上均采用电解法制备Y和Z的单质 D、四种元素的最高正价等于主族序数16. 下列关于反应方向、速率和平衡的说法正确的是( )A、一般来说,温度升高,反应速率加快;活化能大的反应,升高温度后比活化能小的反应速率增大的幅度更大 B、一般来说,放热越多的反应,反应速率也越快 C、对于存在竞争的主反应和副反应,主副产物的占比只与反应的时间有关 D、氢气和氧气在常温下混合后没有明显反应现象,需要点燃才能够反应,故该反应在常温下不自发17. 制备环氧丙醇的反应如下:①
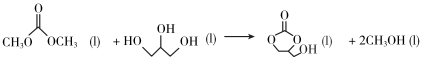
②
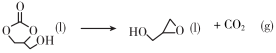
③
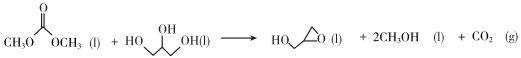
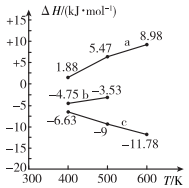
已知上述反应的焓变会随温度变化发生改变,焓变与温度的关系如图,下列说法不正确的是( )
 A、曲线a代表反应②的焓变 B、 C、曲线b在60℃对应的 D、曲线c代表反应①的焓变18. 下列说法不正确的是( )A、将纯水加热,增大,pH不变,仍为中性 B、常温下,向的溶液中加入少量晶体,溶液的pH增大,说明溶液存在电离平衡 C、常温下,酸式盐NaHA的 , 则一定是弱酸 D、常温下,等pH的盐酸和醋酸溶液加水稀释10倍后,19. 通过电氧化合成法可制得特殊高价金属化合物高铜酸钠(化学式为NaCuO2)。关于该物质的推测,下列有关说法不正确的是( )A、具有强氧化性,是因为存在过氧根离子 B、与浓盐酸作用会产生有刺激性气味的气体 C、该物质在酸性条件下不能稳定存在 D、与氢气反应可能有紫红色固体生成20. 下列说法正确的是( )A、含氧酸HClO、HBrO、HIO的电离平衡常数依次为 、 、 , 由此可知,氯、溴、碘的非金属性逐渐减弱 B、NaClO与少量 反应生成HClO和 , 则 与少量 反应生成HClO和 C、向硅酸钠溶液中滴加盐酸,有白色胶状沉淀生成.可证明非金属性:Cl>Si D、化学腐蚀、电化学腐蚀本质上均为因金属失去电子发生氧化反应而被腐蚀21. 设为阿伏加德罗常数的值,下列说法不正确的是( )A、1mol晶体中含有的阳离子总数为 B、1L的的溶液中含有的的数目为 C、将1mol通入水中,则(N表示粒子数) D、46g中含有的碳氢键数目为22. 某新型可连续工作的锂液流电池,其工作原理如图。下列说法正确的是( )
A、曲线a代表反应②的焓变 B、 C、曲线b在60℃对应的 D、曲线c代表反应①的焓变18. 下列说法不正确的是( )A、将纯水加热,增大,pH不变,仍为中性 B、常温下,向的溶液中加入少量晶体,溶液的pH增大,说明溶液存在电离平衡 C、常温下,酸式盐NaHA的 , 则一定是弱酸 D、常温下,等pH的盐酸和醋酸溶液加水稀释10倍后,19. 通过电氧化合成法可制得特殊高价金属化合物高铜酸钠(化学式为NaCuO2)。关于该物质的推测,下列有关说法不正确的是( )A、具有强氧化性,是因为存在过氧根离子 B、与浓盐酸作用会产生有刺激性气味的气体 C、该物质在酸性条件下不能稳定存在 D、与氢气反应可能有紫红色固体生成20. 下列说法正确的是( )A、含氧酸HClO、HBrO、HIO的电离平衡常数依次为 、 、 , 由此可知,氯、溴、碘的非金属性逐渐减弱 B、NaClO与少量 反应生成HClO和 , 则 与少量 反应生成HClO和 C、向硅酸钠溶液中滴加盐酸,有白色胶状沉淀生成.可证明非金属性:Cl>Si D、化学腐蚀、电化学腐蚀本质上均为因金属失去电子发生氧化反应而被腐蚀21. 设为阿伏加德罗常数的值,下列说法不正确的是( )A、1mol晶体中含有的阳离子总数为 B、1L的的溶液中含有的的数目为 C、将1mol通入水中,则(N表示粒子数) D、46g中含有的碳氢键数目为22. 某新型可连续工作的锂液流电池,其工作原理如图。下列说法正确的是( ) A、放电时,左侧浓度持续增大 B、充电时,电极B发生的电极反应: C、当外电路电流为零时,再向储液罐中注入电池可快速充电,重新工作 D、充电时,电极A质量增加ag时,右侧共有转移至左侧23. 三元酸(用H3A表示),溶液中H3A、H2A-、HA2-、A3-的百分含量随pH的变化曲线如图所示,下列说法中不正确的是( )
A、放电时,左侧浓度持续增大 B、充电时,电极B发生的电极反应: C、当外电路电流为零时,再向储液罐中注入电池可快速充电,重新工作 D、充电时,电极A质量增加ag时,右侧共有转移至左侧23. 三元酸(用H3A表示),溶液中H3A、H2A-、HA2-、A3-的百分含量随pH的变化曲线如图所示,下列说法中不正确的是( )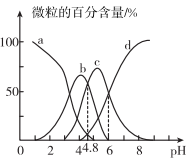 A、曲线c表示的变化曲线 B、的第二步电离常数和第三步电离常数的比值约为 C、溶液中水的电离受到抑制 D、时,24. 酸性条件下,催化氧化反应的化学方程式为 , 该反应的物质间转化如图所示。下列分析正确的是( )
A、曲线c表示的变化曲线 B、的第二步电离常数和第三步电离常数的比值约为 C、溶液中水的电离受到抑制 D、时,24. 酸性条件下,催化氧化反应的化学方程式为 , 该反应的物质间转化如图所示。下列分析正确的是( ) A、反应I的离子方程式为 B、是总反应的催化剂 C、反应Ⅲ是氧化还原反应. D、黄铁矿催化氧化反应中NO是中间产物25. 下列方案设计、现象和结论都正确的是( )
A、反应I的离子方程式为 B、是总反应的催化剂 C、反应Ⅲ是氧化还原反应. D、黄铁矿催化氧化反应中NO是中间产物25. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
检验溶液中是否含有
取少量该溶液于试管中,通入足量CO2
若有白色沉淀产生,则该溶液中含有
B
比较HCl与HI的酸性强弱
将AgCl固体加入水中,再向其中滴入几滴HI
若固体由白色变为黄色,则HI酸性强
C
比较Al与Cu的金属性强弱
将足量氨水分别滴入盛有溶液、溶液的烧杯中,观察现象
溶液的烧杯中出现白色沉淀后不溶解,溶液的烧杯中出现蓝色沉淀后溶解,金属性强弱:Al>Cu
D
验证苯和液溴发生取代反应
苯和液溴在催化下发生反应,将得到的气体通过足量后通入紫色石蕊试液中
若紫色石蕊试液变红,则苯和液溴发生取代反应
A、A B、B C、C D、D二、填空题
-
26. 回答下列问题:(1)、我们知道,水在4℃时密度最大,请结合物质结构与性质的知识做出解释:。(2)、硅和卤素单质反应可以得到 , 的熔、沸点如下表:
熔点/K
183
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
、、、沸点依次升高的原因是。
三、计算题
-
27. 已知酸HA和HB的电离平衡常数为、 , 则:(1)、反应的化学平衡常数为。(2)、常温下的NaB溶液中。
四、综合题
-
28. 某合金X由两种元素组成,一定条件下将其完全溶于一定量的稀硝酸中,可发生如下转化。其中溶液B、D均只含一种溶质,且具有相同的阴离子。
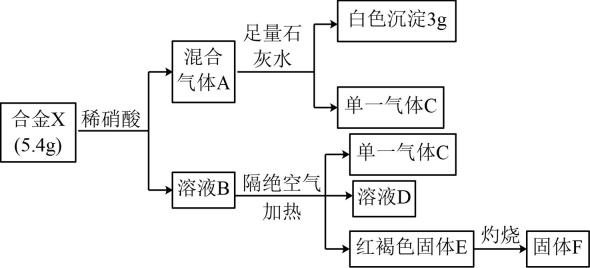
回答下列问题:
(1)、合金X的化学式为 , 溶液D中溶质的化学式为。(2)、溶液B隔绝空气加热的化学方程式为。(3)、气体C和足量的氧气完全溶于NaOH溶液,写出反应的离子方程式:。(4)、在强碱性溶液中D与NaClO生成一种理想的水处理剂,写出反应的离子方程式:。(5)、溶液B长期露置于空气中易变质,请设计实验方案判断溶液B是否变质:。29. 我国在2021年两会上首次将碳达峰、碳中和写人政府工作报告,力争2030年前实现碳达峰,2060年前实现碳中和。转化利用是碳治理的重要方法,有利于实现碳资源的有效循环。已知:甲醇的气相标准燃烧热(焓):;
氢气的标准燃烧热(焓):;
转化为:。
回答下列问题:
(1)、 。(2)、制备甲醇两种路径的势能图如图,根据势能图,下列说法正确的是____。 A、提高分压一定可以提高CO2在催化剂表面的吸附速率 B、甲酸盐路径的决速步反应是 C、中间体比更稳定 D、使用高活性催化剂可降低反应焓变,加快反应速率(3)、研究者向恒压(3.0MPa)密闭装置中通入反应物混合气[混合比例),测定甲醇时空收率随温度的变化曲线如图所示。(甲醇时空收率是表示单位物质的量催化剂表面甲醇的平均生成速率)。请解释甲醇时空收率“抛物线”前半段升高的原因: , 催化剂最佳配比、最佳反应温度为。
A、提高分压一定可以提高CO2在催化剂表面的吸附速率 B、甲酸盐路径的决速步反应是 C、中间体比更稳定 D、使用高活性催化剂可降低反应焓变,加快反应速率(3)、研究者向恒压(3.0MPa)密闭装置中通入反应物混合气[混合比例),测定甲醇时空收率随温度的变化曲线如图所示。(甲醇时空收率是表示单位物质的量催化剂表面甲醇的平均生成速率)。请解释甲醇时空收率“抛物线”前半段升高的原因: , 催化剂最佳配比、最佳反应温度为。 (4)、二氧化碳加氢制甲醇的速率方程可表示为 , 其中k为速率常数,各物质分压的指数为反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用催化剂时,反应温度由169℃升高到223℃,若反应级数 , 反应级数不变,试计算速率常数之比。(5)、在催化加氢制甲醇过程中存在竞争性的反应产生CO: , 在恒温密闭容器中,维持压强和投料不变,将和按一定流速通过反应器,二氧化碳转化率和甲醇选择性随温度变化关系如图所示。若催化剂活性受温度影响不大,试分析235℃后图中两条曲线下降的原因:。
(4)、二氧化碳加氢制甲醇的速率方程可表示为 , 其中k为速率常数,各物质分压的指数为反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用催化剂时,反应温度由169℃升高到223℃,若反应级数 , 反应级数不变,试计算速率常数之比。(5)、在催化加氢制甲醇过程中存在竞争性的反应产生CO: , 在恒温密闭容器中,维持压强和投料不变,将和按一定流速通过反应器,二氧化碳转化率和甲醇选择性随温度变化关系如图所示。若催化剂活性受温度影响不大,试分析235℃后图中两条曲线下降的原因:。 30. 氯化亚铜(CuCl)是一种重要的化工产品,常用作催化剂、杀菌剂、媒染剂、脱色剂等,它难溶于水和乙醇,可溶于浓HCl与氨水形成的混合物,实验室用酸性蚀刻液(含、、、)和碱性蚀刻液[含、、]来制备CuCl,实验过程的流程如下:
30. 氯化亚铜(CuCl)是一种重要的化工产品,常用作催化剂、杀菌剂、媒染剂、脱色剂等,它难溶于水和乙醇,可溶于浓HCl与氨水形成的混合物,实验室用酸性蚀刻液(含、、、)和碱性蚀刻液[含、、]来制备CuCl,实验过程的流程如下: (1)、步骤Ⅳ需要控制pH为1~2、80℃下进行,合适的加热方式是。(2)、步骤Ⅱ过滤得到固体,下列说法正确的是____。A、为加快过滤速度,得到较干燥的固体,可进行抽滤 B、宜用酸溶液洗涤沉淀 C、在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 D、在抽滤装置中洗涤晶体时,为减少晶体的损失,应使洗涤剂快速通过滤纸(3)、步骤Ⅴ为了得到较为纯净的硫酸铜晶体,根据下表中物质的溶解度(单位为g)随温度的变化,写出步骤Ⅴ得到硫酸铜晶体的操作:。
(1)、步骤Ⅳ需要控制pH为1~2、80℃下进行,合适的加热方式是。(2)、步骤Ⅱ过滤得到固体,下列说法正确的是____。A、为加快过滤速度,得到较干燥的固体,可进行抽滤 B、宜用酸溶液洗涤沉淀 C、在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 D、在抽滤装置中洗涤晶体时,为减少晶体的损失,应使洗涤剂快速通过滤纸(3)、步骤Ⅴ为了得到较为纯净的硫酸铜晶体,根据下表中物质的溶解度(单位为g)随温度的变化,写出步骤Ⅴ得到硫酸铜晶体的操作:。温度
物质
0℃
20℃
40℃
60℃
80℃
100℃
氯化铜
75
80
85
90
100
108
硫酸铜
12
18
30
50
60
87
(4)、写出还原过程中发生主要反应的离子方程式:。(5)、CuCl的定量分析,称取样品0.25g置于预先放入玻璃珠和过量溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入50mL水,邻菲罗啉指示剂2滴,立即用的硫酸铈标准液滴定至绿色出现为终点,消耗标准液20.00mL,发生的反应为 , , 则样品的CuCl的质量分数为。31. G是一种用于治疗原发性高血压的药物,其合成路线如下: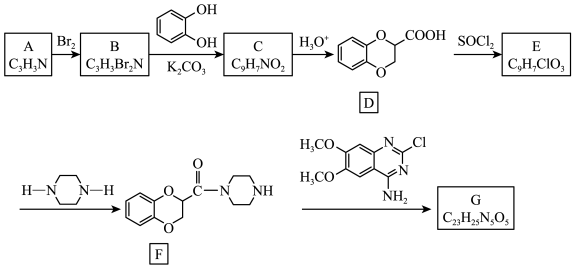
回答下列问题:
(1)、写出物质D中两种含氧官能团的名称:和。(2)、写出化合物C的键线式:;写出化合物G的结构简式:。(3)、下列说法不正确的是____。A、化合物A分子中所有原子共平面 B、化合物B能与硝酸银溶液作用产生淡黄色沉淀 C、化合物E能发生取代、加成、消去、水解反应 D、化合物E→F反应中还可能生成一种有机副产物(4)、写出反应F→G的化学方程式:。(5)、写出满足以下条件的D的所有同分异构体的结构简式。①含有一个苯环外无其他环,且苯环上的一取代产物只有两种
②水解后的产物能与氯化铁溶液发生显色反应
③与溶液反应放出气体
(6)、根据题中信息,以对氯苯乙烯为原料,设计合成 的路线(用流程图表示,无机试剂、有机试剂任选)。
的路线(用流程图表示,无机试剂、有机试剂任选)。
-
-