江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题
试卷更新日期:2022-03-22 类型:开学考试
一、单选题
-
1. 2022北京冬奥会火炬采用碳纤维和复合材质打造,以氢气为燃料,并添加显色剂来调节火焰颜色。下列有关奥运火炬的说法不正确的是( )A、碳纤维是一种轻而强的有机高分子材料 B、氢气作为火炬燃料能实现碳的零排放 C、添加显色剂调节火焰颜色利用的是焰色反应原理 D、奥运火炬就是一款轻量化小型化的氢气减压装置2. 天津大学马一太、田华教授团队在国家重点研发计划——科技冬奥专项支持下,通过校企合作,研发了国际先进的二氧化碳(R744)跨临界直冷制冰技术,满足不同项目对冰面的要求,被誉为是“最快的冰”。下列有关说法正确的是( )A、跨临界制冰过程破坏了碳氧共价键 B、的电子式:
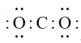 C、冰属于分子晶体
D、的空间构型为直线形
3. 下列有关物质性质与用途对应关系不正确的是( )A、NaHCO3能与碱反应,可用作焙制糕点的膨松剂 B、CaO能与SO2反应,可作为工业废气处理时的脱硫剂 C、硅的导电性介于导体和绝缘体之间,可用于制造计算机硅芯片的材料 D、饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强4. 侯氏制碱法制取的原理为。实验室用如题图所示的装置模拟侯氏制碱法制取少量固体。下列有关说法正确的是( )
C、冰属于分子晶体
D、的空间构型为直线形
3. 下列有关物质性质与用途对应关系不正确的是( )A、NaHCO3能与碱反应,可用作焙制糕点的膨松剂 B、CaO能与SO2反应,可作为工业废气处理时的脱硫剂 C、硅的导电性介于导体和绝缘体之间,可用于制造计算机硅芯片的材料 D、饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强4. 侯氏制碱法制取的原理为。实验室用如题图所示的装置模拟侯氏制碱法制取少量固体。下列有关说法正确的是( )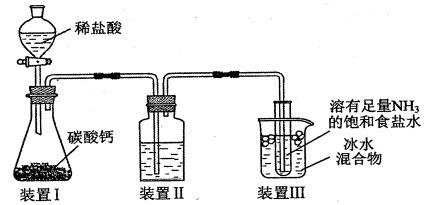 A、装置Ⅰ中反应的离子方程式为 B、向装置Ⅱ洗气瓶中加入饱和溶液以除去中的少量 C、装置Ⅲ中用冰水浴冷却试管内溶液有利于析出固体 D、析出固体的上层清液中不存在5. 短周期元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y原子2p原子轨道上有5个电子,Z的周期序数是族序数的3倍,W与Y属于同一主族。下列说法正确的是( )A、原子半径: B、X的第一电离能比同周期相邻元素的大 C、Y的简单气态氢化物的热稳定性比W的弱 D、ZW中阳离子与阴离子具有相同的电子层结构6. 铁氰化钾{}俗称赤血盐,遇发生反应: , 生成深蓝色沉淀,常用于检验;黄血盐{}溶液可用于检验。下列有关铁及其化合物的说法正确的是( )
A、装置Ⅰ中反应的离子方程式为 B、向装置Ⅱ洗气瓶中加入饱和溶液以除去中的少量 C、装置Ⅲ中用冰水浴冷却试管内溶液有利于析出固体 D、析出固体的上层清液中不存在5. 短周期元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y原子2p原子轨道上有5个电子,Z的周期序数是族序数的3倍,W与Y属于同一主族。下列说法正确的是( )A、原子半径: B、X的第一电离能比同周期相邻元素的大 C、Y的简单气态氢化物的热稳定性比W的弱 D、ZW中阳离子与阴离子具有相同的电子层结构6. 铁氰化钾{}俗称赤血盐,遇发生反应: , 生成深蓝色沉淀,常用于检验;黄血盐{}溶液可用于检验。下列有关铁及其化合物的说法正确的是( ) A、Fe元素位于周期表的第ⅦB族 B、基态外围电子排布式为 C、赤血盐中提供空轨道形成配位键的是 D、若黄血盐受热分解产物之一的晶胞结构如图所示,则其化学式为7. 在指定条件下,下列铁及其化合物之间的转化能实现的是( )A、 B、 C、 D、8. 铁的氧化物是重要的化工原料,可用作反应的催化剂。工业含铁废渣中含有大量铁的氧化物,常用于制取聚合硫酸铁铝净水剂。对于反应 , 下列有关说法正确的是( )A、加入催化剂 , 反应的焓变变小 B、升高温度,反应体系的活化分子百分数增多 C、向固定容积的反应体系中充入氦气,反应速率加快 D、其他条件相同,增大 , 反应的平衡常数K增大9. 由工业废渣(主要含Fe、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下:
A、Fe元素位于周期表的第ⅦB族 B、基态外围电子排布式为 C、赤血盐中提供空轨道形成配位键的是 D、若黄血盐受热分解产物之一的晶胞结构如图所示,则其化学式为7. 在指定条件下,下列铁及其化合物之间的转化能实现的是( )A、 B、 C、 D、8. 铁的氧化物是重要的化工原料,可用作反应的催化剂。工业含铁废渣中含有大量铁的氧化物,常用于制取聚合硫酸铁铝净水剂。对于反应 , 下列有关说法正确的是( )A、加入催化剂 , 反应的焓变变小 B、升高温度,反应体系的活化分子百分数增多 C、向固定容积的反应体系中充入氦气,反应速率加快 D、其他条件相同,增大 , 反应的平衡常数K增大9. 由工业废渣(主要含Fe、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下: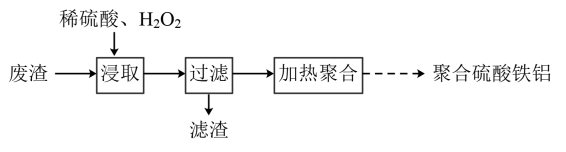
下列有关说法不正确的是( )
A、“浸取”时先将废渣粉碎并不断搅拌,有利于提高铁、铝元素浸取率 B、与稀硫酸反应的离子方程式为 C、“过滤”前用检验浸取液中是否存在的反应是氧化还原反应 D、聚合硫酸铁铝水解形成的胶体具有吸附作用10. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是( )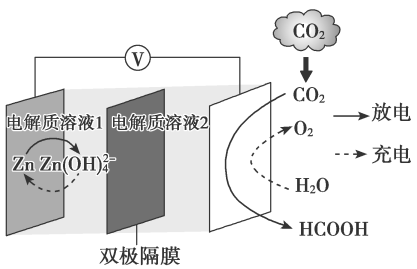 A、放电时,负极反应为 B、电解质溶液1为碱性,电解质溶液2为酸性 C、充电时,阳极溶液中浓度升高 D、充电时,电池总反应为:11. 化合物Z是合成多发性骨髓瘤药物帕比司他的重要中间体,可由下列反应制得。
A、放电时,负极反应为 B、电解质溶液1为碱性,电解质溶液2为酸性 C、充电时,阳极溶液中浓度升高 D、充电时,电池总反应为:11. 化合物Z是合成多发性骨髓瘤药物帕比司他的重要中间体,可由下列反应制得。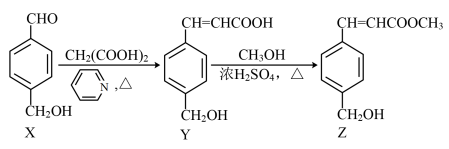
下列有关X、Y、Z的说法正确的是( )
A、1mol X中含有键 B、Y与足量HBr反应生成的有机化合物中不含手性碳原子 C、Z在水中的溶解度比Y在水中的溶解度大 D、X、Y、Z分别与足量酸性溶液反应所得芳香族化合物相同12. 室温下,通过下列实验探究溶液的性质(假设实验前后溶液体积不变)。实验
实验操作和现象
1
用pH试纸测定溶液的pH,测得pH约为2
2
向溶液中加入溶液,产生沉淀
3
向溶液中通入足量的 , 产生红褐色沉淀
4
向溶液中加入NaHS溶液,产生浅黄色沉淀
下列说法正确的是( )
A、溶液中存在 B、实验2中沉淀仅为 C、实验3得到的溶液中有 D、实验4中发生反应的离子方程式为13. 室温下,用溶液浸泡粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知 , 。下列说法不正确的是( )A、浸泡时向溶液中加入适量浓氨水可促进的转化 B、反应正向进行,需满足 C、过滤后所得清液中一定存在:且 D、滤渣中加入醋酸反应的离子方程式:14. 与重整生成和CO的过程中主要发生下列反应反应Ⅰ:
反应Ⅱ:
在恒压、反应物起始物质的量比条件下,和的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
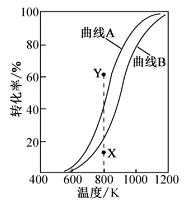 A、升高温度、增大压强均有利于提高的平衡转化率 B、曲线B表示的平衡转化率随温度的变化 C、相同条件下,改用高效催化剂能使曲线A和曲线B相重叠 D、图中X点所示条件下,延长反应时间,的转化率能达到Y点
A、升高温度、增大压强均有利于提高的平衡转化率 B、曲线B表示的平衡转化率随温度的变化 C、相同条件下,改用高效催化剂能使曲线A和曲线B相重叠 D、图中X点所示条件下,延长反应时间,的转化率能达到Y点二、综合题
-
15. 在磁性材料、电化学领域应用广泛。以钴矿[主要成分是CoO、、 , 还含及少量、、CuO及等]为原料可制取。主要步骤如下:(1)、浸取:用盐酸和溶液浸取钴矿,浸取液中含有、、、、、、等离子。写出发生反应的离子方程式:。(2)、除杂:向浸取液中先加入足量氧化 , 再加入NaOH调节pH除去、、。有关沉淀数据如下表(“完全沉淀”时金属离子浓度):
沉淀
恰好完全沉淀时的pH
5.2
2.8
9.4
6.7
10.1
若浸取液中 , 则须调节溶液pH的范围是(加入和NaOH时,溶液的体积变化忽略)。
(3)、萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA)2 , 发生反应:。实验测得:当溶液pH处于4.5~6.5范围内,萃取率随溶液pH的增大而增大(如图-1所示),其原因是。向萃取所得有机相中加入 , 反萃取得到水相。该工艺中设计萃取、反萃取的目的是。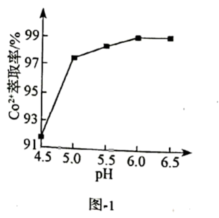 (4)、沉钴、热分解:向反萃取后得到的水相中加入溶液,过滤、洗涤、干燥,得到固体,加热制备。在空气中加热,反应温度对反应产物的影响如图-2所示,请写出500~1000℃时,发生主要反应的化学方程式。
(4)、沉钴、热分解:向反萃取后得到的水相中加入溶液,过滤、洗涤、干燥,得到固体,加热制备。在空气中加热,反应温度对反应产物的影响如图-2所示,请写出500~1000℃时,发生主要反应的化学方程式。 16. F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如图:
16. F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如图: (1)、A分子中采取sp2杂化的碳原子数目是。(2)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、A分子中采取sp2杂化的碳原子数目是。(2)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中不同化学环境的氢原子个数比是2:2:2:1。
②苯环上有4个取代基,且有两种含氧官能团。
(3)、A+B→C的反应需经历A+B→X→C的过程,中间体X的分子式为C17H17NO6。X→C的反应类型为。(4)、E→F中有一种分子式为C15H14O4的副产物生成,该副产物的结构简式为。(5)、写出以
 CH3和F
CH3和F CH2OH为原料制备
CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 17. 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。(1)、取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 17. 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。(1)、取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
①写出用蚀刻废液制备CuO反应的化学方程式:。
②检验CuO固体是否洗净的实验操作是。
③装置图中装置X的作用是。
(2)、以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣, , 加热浓缩、冷却结晶、过滤、晾干,得到CuSO4·5H2O晶体。已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol/L H2SO4、1.0 mol/L HCl、1.0 mol/L NaOH。(3)、通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O+I2= S4O+2I-。计算CuSO4·5H2O样品的纯度:。18. 硫酸厂产生的酸性废水中含有超标的H3AsO3 , 需处理达标后才能排放。目前含砷废水的处理常用石灰中和-PFS、硫化、氧化吸附等方法。(1)、石灰中和-PFS法,处理过程如下:
含砷废水经氧化后,加入石灰乳,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如图-1所示。水溶液中含砷微粒的物质的量分布分数与pH的关系如图-2所示。已知此温度下,溶于水, , , 。

①一级沉降时,当 , 废水中开始产生沉淀,该沉淀主要成分的化学式为。pH调节到8时,开始产生沉淀,原因是。
②二级沉降中,保持溶液pH在8~10之间,加入PFS(聚合硫酸铁)形成的胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为。
(2)、硫化法,用硫代硫酸钠 (Na2S2O3)去除酸性废水中的反应机理如图-3所示,经过“途径Ⅰ”的除砷过程可描述为(图中“HS·”为自由基,“·”表示孤单电子)。 (3)、氧化吸附法,新生态悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(Ⅴ),也具有较强的吸附性,能吸附水体中的而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态悬浊液对砷去除率如图-4所示。
(3)、氧化吸附法,新生态悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(Ⅴ),也具有较强的吸附性,能吸附水体中的而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态悬浊液对砷去除率如图-4所示。
①加入新生态悬浊液使废水中转化为 , 反应的离子方程式为。
②pH从3增大到7的过程中,随着pH增大,砷的去除率上升。其原因是。