湖北省七市(州)2021-2022学年高三下学期3月联合统一调研测试化学试题
试卷更新日期:2022-03-22 类型:月考试卷
一、单选题
-
1. 2022年1月14日,汤加火山喷发产生大量SO2进入大气。下列有关SO2说法正确的是( )A、大气中SO2主要来源于火山喷发 B、SO2是直线形分子 C、食品中添加适量的SO2可以起到漂白和防腐等作用 D、可用盐酸酸化的BaCl2溶液检验气体中的SO22. 2021年我国科学家从一氧化碳到蛋白质一步合成的技术路线被突破。下列叙述不正确的是( )A、CO是极性分子 B、工业上可用CO冶炼金属 C、新冠灭活疫苗的主要成分是蛋白质 D、蛋白质变性后均不能食用3. 下列实验装置和操作正确的是( )
A
B
C
D
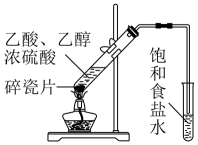
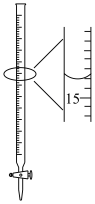
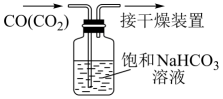
实验室制取乙酸乙酯
准确量取15.20mL酸性KMnO4标准溶液
除去CO中的CO2
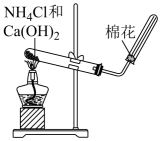
实验室制取并收集NH3
A、A B、B C、C D、D4. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1molNH4F晶体中含有共价键数目为3NA B、0.5molXeF4中氙的价层电子对数为3NA C、标况下,11.2LNO和11.2LO2混合后的分子数目为NA D、31g乙二醇中sp3杂化的原子数目为NA5. 下列实验现象与实验操作不相匹配的是( )实验操作
实验现象
A
向饱和溴化钾溶液中滴入氯化银饱和溶液
产生淡黄色沉淀
B
向盛有乙苯的试管中滴加3滴酸性高锰酸钾溶液,振荡
紫色不褪去
C
发黄的浓硝酸中通入O2
黄色变浅
D
装有甲烷和氯气的试管置于光亮处
气体颜色变浅,试管壁有液珠
A、A B、B C、C D、D6. 乙二醇生产工艺中,需使用热的K2CO3溶液(脱碳液)脱除CO2 , 脱碳液中含有的V2O5能减少溶液对管道的腐蚀。可使用“碘量法”测定脱碳液中V2O5的含量,操作中涉及两个反应如下:①V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O;②I2+2Na2S2O3=2NaI+Na2S4O6。下列说法不正确的是( )A、反应①中氧化剂与还原剂物质的量之比为1:2 B、反应①生成1molVOCl2时,反应转移1mol电子 C、V的最高价为+5价,推测V2O5只有氧化性 D、溶液酸性过强时,反应②易发生其他反应7. 由同周期元素原子W、X、Y、Z构成的一种阴离子(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20。下列说法正确的是( )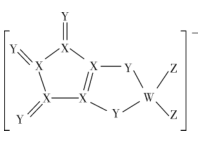 A、W、X、Y、Z第一电离能由大到小依次是:Z>Y>X>W B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、W和X的最高价氧化物对应水化物的酸性:W>X D、W、Z形成的化合物分子中各原子均满足8电子稳定结构8. 某有机物的结构简式如图。下列有关该有机物的说法不正确的是( )
A、W、X、Y、Z第一电离能由大到小依次是:Z>Y>X>W B、Y形成的简单离子的半径比Z形成的简单离子的半径小 C、W和X的最高价氧化物对应水化物的酸性:W>X D、W、Z形成的化合物分子中各原子均满足8电子稳定结构8. 某有机物的结构简式如图。下列有关该有机物的说法不正确的是( )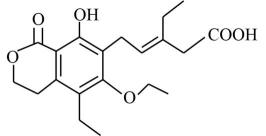 A、分子式为C20H26O6 B、既可以形成分子内氢键又可以形成分子间氢键 C、分子中有一个手性碳原子,具有一定的光学活性 D、1mol该有机物最多与3molNaOH反应9. 下列关于元素及化合物的结构和性质的叙述正确的是( )A、稳定性:H2Se<H2S<H2O,三者都是V形分子 B、SO3和H2SO4中的硫原子都采取sp3杂化 C、P4分子和离子中的键角都为109°28ˊ D、F2能与NaCl溶液反应置换出Cl210. 砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为( , , )。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法不正确的是( )
A、分子式为C20H26O6 B、既可以形成分子内氢键又可以形成分子间氢键 C、分子中有一个手性碳原子,具有一定的光学活性 D、1mol该有机物最多与3molNaOH反应9. 下列关于元素及化合物的结构和性质的叙述正确的是( )A、稳定性:H2Se<H2S<H2O,三者都是V形分子 B、SO3和H2SO4中的硫原子都采取sp3杂化 C、P4分子和离子中的键角都为109°28ˊ D、F2能与NaCl溶液反应置换出Cl210. 砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为( , , )。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法不正确的是( ) A、砷化镉中Cd与As原子个数比为3:2 B、两个Cd原子间最短距离为0.5apm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为g·cm-311. 制备苯甲酸甲酯的一种反应机理如图(其中Ph-代表苯基)。下列说法不正确的是( )
A、砷化镉中Cd与As原子个数比为3:2 B、两个Cd原子间最短距离为0.5apm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为g·cm-311. 制备苯甲酸甲酯的一种反应机理如图(其中Ph-代表苯基)。下列说法不正确的是( )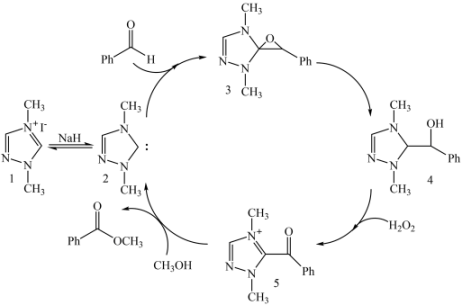 A、化合物2到化合物3的过程,存在极性键的断裂和生成 B、化合物4到化合物5的过程,H2O2体现了还原性 C、苯甲酸甲酯分子中所有C和O原子可能共平面 D、制备苯甲酸甲酯的化学方程式:
A、化合物2到化合物3的过程,存在极性键的断裂和生成 B、化合物4到化合物5的过程,H2O2体现了还原性 C、苯甲酸甲酯分子中所有C和O原子可能共平面 D、制备苯甲酸甲酯的化学方程式: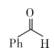 +H2O2+CH3OH
+H2O2+CH3OH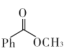 +2H2O
12. 在一定温度下,BaSO4和C在一密闭容器中进行反应:BaSO4(s)+4C(s)BaS(s)+4CO(g),CO的平衡浓度(mol/L)的对数lgc(CO)与温度的倒数的关系如图所示,下列说法中正确的是( )
+2H2O
12. 在一定温度下,BaSO4和C在一密闭容器中进行反应:BaSO4(s)+4C(s)BaS(s)+4CO(g),CO的平衡浓度(mol/L)的对数lgc(CO)与温度的倒数的关系如图所示,下列说法中正确的是( )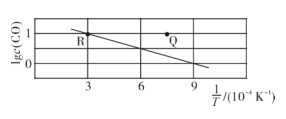 A、Q点BaSO4的消耗速率小于生成速率 B、该反应的ΔH<0 C、温度是K时,反应的平衡常数为1 D、温度不变,将R点状态的容器体积扩大,重新达到平衡时,气体的压强减小13. 以赤铁矿(主要成分为Fe2O3 , 含少量Al2O3)为原料制备无水FeCl2的工艺流程如下。下列说法不正确的是( )
A、Q点BaSO4的消耗速率小于生成速率 B、该反应的ΔH<0 C、温度是K时,反应的平衡常数为1 D、温度不变,将R点状态的容器体积扩大,重新达到平衡时,气体的压强减小13. 以赤铁矿(主要成分为Fe2O3 , 含少量Al2O3)为原料制备无水FeCl2的工艺流程如下。下列说法不正确的是( )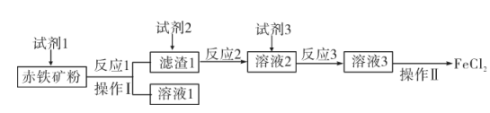 A、试剂1可用NaOH溶液 B、鉴别溶液2中金属阳离子可用KSCN溶液 C、反应3为化合反应 D、将溶液3蒸干可制得无水FeCl214. 可用惰性电极通过电解法制备KMnO4 , 下列说法正确的是( )
A、试剂1可用NaOH溶液 B、鉴别溶液2中金属阳离子可用KSCN溶液 C、反应3为化合反应 D、将溶液3蒸干可制得无水FeCl214. 可用惰性电极通过电解法制备KMnO4 , 下列说法正确的是( )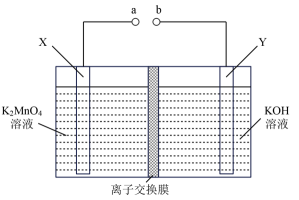 A、图中离子交换膜为阴离子交换膜 B、X极的电极反应为MnO-e—=MnO C、Y极区可以产生O2和较浓的KOH溶液 D、电解一段时间后阴极区溶液的pH减小15. 室温下,向100mL某浓度的二元弱酸H2A溶液中逐滴加入0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如图所示。下列有关说法不正确的是( )
A、图中离子交换膜为阴离子交换膜 B、X极的电极反应为MnO-e—=MnO C、Y极区可以产生O2和较浓的KOH溶液 D、电解一段时间后阴极区溶液的pH减小15. 室温下,向100mL某浓度的二元弱酸H2A溶液中逐滴加入0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如图所示。下列有关说法不正确的是( ) A、Ka1(H2A)数量级为10-3 B、b点时:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) C、水的电离程度:d>c>b>a D、b→c段,反应的离子方程式为HA-+OH-=A2-+H2O
A、Ka1(H2A)数量级为10-3 B、b点时:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) C、水的电离程度:d>c>b>a D、b→c段,反应的离子方程式为HA-+OH-=A2-+H2O二、综合题
-
16. 钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上通常利用钼精矿(主要成分MoS2中硫为-2价)制备钼酸钠晶体的流程如图所示。
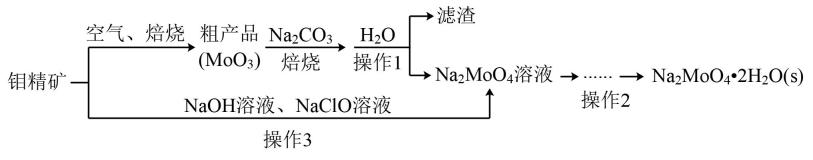
回答下列问题:
(1)、可以提高钼精矿焙烧效率的措施有。(任写一种)(2)、NaClO的电子式。(3)、粗产品焙烧的化学方程式。(4)、实验室进行操作1所用的玻璃仪器是:烧杯、 , 操作2的步骤是:、过滤、洗涤、干燥。(5)、操作3中硫元素被氧化为最高价,发生反应的离子方程式为。(6)、钼的化合物间有如下转化关系。八钼酸铵的化学式为:。 (7)、某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,要使溶液中钼酸根离子完全沉淀(浓度小于1×10-5mol/L),溶液中Ba2+的浓度应大于mol/L。
(7)、某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,要使溶液中钼酸根离子完全沉淀(浓度小于1×10-5mol/L),溶液中Ba2+的浓度应大于mol/L。 17. 有机物E是合成药物的中间体,E的合成路线如下:
17. 有机物E是合成药物的中间体,E的合成路线如下: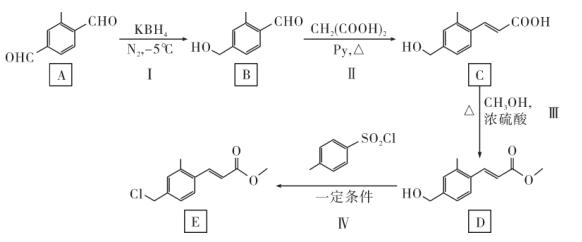
回答下列问题:
(1)、C分子中含氧官能团名称为。(2)、反应Ⅲ的化学方程式为。(3)、D→E的反应类型为。(4)、化合物Y是比B少一个碳的同系物。Y的同分异构体中遇FeCl3溶液显紫色,还能发生银镜反应的结构共有种,其中核磁共振氢谱有5组峰,峰面积之比为2:2:2:1:1的结构简式为 , 化学名称为。(5)、写出以 为原料制备化合物
为原料制备化合物 的合成路线(其他试剂任选):。 18. 磺酰氯(SO2Cl2)可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量SO2Cl2 , 装置如图(部分夹持装置已省略)。
的合成路线(其他试剂任选):。 18. 磺酰氯(SO2Cl2)可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量SO2Cl2 , 装置如图(部分夹持装置已省略)。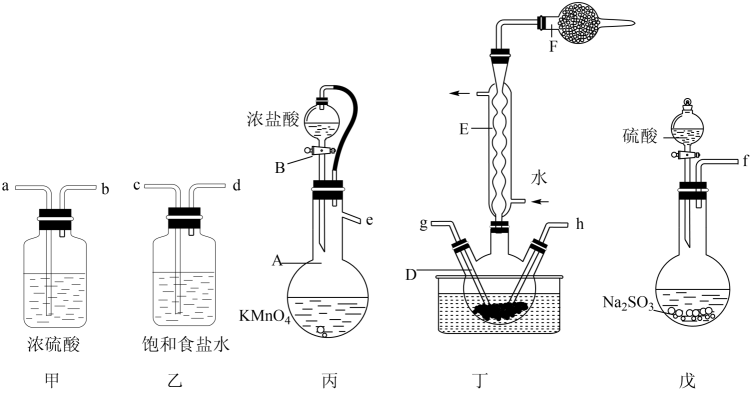
已知:①SO2(g)+Cl2(g)=SO2Cl2(1) △H=-97.3kJ/mol。
②SO2Cl2熔点为-54.1℃,沸点69.1℃,常温较稳定。遇水剧烈水解,100℃以上易分解。
回答下列问题:
(1)、仪器A的名称是 , 装置丙中橡胶管的作用是。(2)、装置丙中发生反应的离子反应方程式为 , 上述仪器正确的连接顺序是e→→g,h←←f(填仪器接口字母编号,仪器可重复使用)。(3)、仪器F的作用是。(4)、装置丁中三颈烧瓶置于冷水浴中,其原因是。(5)、使用Li-SO2Cl2电池作为电源,采用四室式电渗析法制备Ni(H2PO2)2和NaOH,其工作原理如图所示。已知电池反应为2Li+SO2Cl2=2LiCl+SO2↑。下列说法正确的是____(填标号)。 A、电池中C电极的电极反应式为SO2Cl2+2e-=2Cl-+SO2↑ B、膜甲、膜丙分别为阳离子交换膜、阴离子交换膜 C、g为Ni电极,连接电池的正极 D、一段时间后,I室和IV室中溶液的pH均升高(6)、某实验小组利用该装置消耗了氯气1120mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为(结果保留三位有效数字)。19. 研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:(1)、已知下列热化学方程式:
A、电池中C电极的电极反应式为SO2Cl2+2e-=2Cl-+SO2↑ B、膜甲、膜丙分别为阳离子交换膜、阴离子交换膜 C、g为Ni电极,连接电池的正极 D、一段时间后,I室和IV室中溶液的pH均升高(6)、某实验小组利用该装置消耗了氯气1120mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为(结果保留三位有效数字)。19. 研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:(1)、已知下列热化学方程式:反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应II:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g)CO(g)+3H2(g)的ΔH3=kJ/mol。
(2)、在T℃时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:t/min
0
10
20
30
40
50
φ(CO2)
0.25
0.23
0.214
0.202
0.200
0.200
①能判断反应CO2(g)+4H2(g)CH4(g)+2H2O(g)达到平衡的是(填标号)。
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为%(结果保留三位有效数字)。
(3)、将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是。 (4)、在T℃时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)=HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始的关系如图所示:(分压=总压×物质的量分数)
(4)、在T℃时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)=HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始的关系如图所示:(分压=总压×物质的量分数)
①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=mol/(L·min)。
②b点时反应的平衡常数Kp=(kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率(填“增大”“不变”或减小”)。