福建省龙岩市2021年中考一模化学试题
试卷更新日期:2022-03-15 类型:中考模拟
一、单选题
-
1. 我国古代下列古代发明或技术中,主要原理涉及化学变化的是( )A、矿石炼铁 B、水车灌溉 C、活字印刷 D、雕刻石像2. 糖尿病患者应少摄入糖类物质,下列食物中富含糖类的是( )A、鸡蛋 B、蔬菜 C、米饭 D、鱼3. 地壳中含有丰富的氧、硅等元素。根据下图有关信息,下列说法不正确的是( )
 A、氧元素属于非金属元素 B、地壳中的含量:氧>硅 C、氧原子在化学反应中易失去电子 D、硅元素相对原子质量为28.094. 真空包装食品进入高原地区,包装袋往往会鼓起,这是因为包装袋内的气体分子()A、质量增大 B、间隔增大 C、体积增大 D、个数增多5. 根据化学方程式不能获得的信息有( )A、化学反应发生的条件 B、化学反应的快慢 C、反应物和生成物的质量比 D、化学反应的反应物和生成物6. 复旦大学研究团队捕捉到含+9价元素的物质,打破元素化合价处在-4到+8价的经典化学理论。下列微粒构成的物质中,除氧外的另一元素的化合价为+9的是( )A、IO- B、 C、 D、7. 某消毒液标签的部分内容如图所示,下列说法正确的是( )
A、氧元素属于非金属元素 B、地壳中的含量:氧>硅 C、氧原子在化学反应中易失去电子 D、硅元素相对原子质量为28.094. 真空包装食品进入高原地区,包装袋往往会鼓起,这是因为包装袋内的气体分子()A、质量增大 B、间隔增大 C、体积增大 D、个数增多5. 根据化学方程式不能获得的信息有( )A、化学反应发生的条件 B、化学反应的快慢 C、反应物和生成物的质量比 D、化学反应的反应物和生成物6. 复旦大学研究团队捕捉到含+9价元素的物质,打破元素化合价处在-4到+8价的经典化学理论。下列微粒构成的物质中,除氧外的另一元素的化合价为+9的是( )A、IO- B、 C、 D、7. 某消毒液标签的部分内容如图所示,下列说法正确的是( ) A、该消毒液为纯净物 B、NaClO是由钠原子、氯原子、氧原子组成的 C、NaClO的相对分子质量为74.5g D、NaClO中钠、氯、氧元素的质量比为46:71:328. 除去下列物质中的少量杂质,所选用试剂和操作方法都正确的是( )
A、该消毒液为纯净物 B、NaClO是由钠原子、氯原子、氧原子组成的 C、NaClO的相对分子质量为74.5g D、NaClO中钠、氯、氧元素的质量比为46:71:328. 除去下列物质中的少量杂质,所选用试剂和操作方法都正确的是( )选项
物质
少量杂质
所用试剂和操作方法
A
H2O
NaCl
向水中加入活性炭吸附
B
铜粉
CuO
在空气中充分灼烧
C
N2
水蒸气
通过足量的氢氧化钠固体干燥剂
D
NaOH
Na2CO3
加适量的稀盐酸
A、A B、B C、C D、D9. 为了探究铁制品锈蚀的条件,小明用普通铁钉、纯铁钉同时进行下面的四组实验,一段时间后只在实验I中观察到了红褐色的锈斑,其他均无明显变化。下列说法不正确的是( )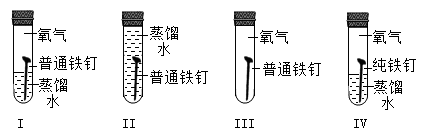 A、I和Ⅱ说明铁制品锈蚀需要O2 B、I和Ⅲ说明铁制品锈蚀需要H2O C、I和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀 D、Ⅲ和Ⅳ说明铁制品的锈蚀与铁制品内部结构有关10. 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是()
A、I和Ⅱ说明铁制品锈蚀需要O2 B、I和Ⅲ说明铁制品锈蚀需要H2O C、I和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀 D、Ⅲ和Ⅳ说明铁制品的锈蚀与铁制品内部结构有关10. 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是()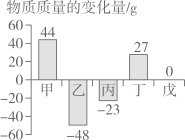 A、该反应一定属于置换反应 B、戊一定是该反应的催化剂 C、参加反应的乙、丙的质量比一定为48:23 D、该反应中甲、丁的相对分子质量之比一定为44:27
A、该反应一定属于置换反应 B、戊一定是该反应的催化剂 C、参加反应的乙、丙的质量比一定为48:23 D、该反应中甲、丁的相对分子质量之比一定为44:27二、填空题
-
11. 在“新冠疫情”期间,人们使用过氧乙酸、医用酒精等进行消毒,使用时要有一定的科学知识。(1)、医用酒精是乙醇的水溶液,其中溶质为 , 溶剂为。(2)、过氧乙酸溶液(填“能”或“不能”)用铁质器皿盛装。(3)、现将200mL20%的过氧乙酸(密度近似为1.0g/cm3)稀释为0.5%的过氧乙酸,需加入水的体积为mL;用量筒量取200mL20%的过氧乙酸倒入塑料桶中,按比例兑水,用搅拌后,盖好桶盖待用;若盛装过氧乙酸的容器没有密封,人们在远处就可以闻到消毒液的气味,试从微观微观角度解释这一现象:。12. 铜、铁及其合金是古代使用的主要金属材料。资料表明,铜比铁更早使用的原因包含自然界有单质铜而无单质铁、许多铜矿石颜色鲜艳而易于发现、炼铜比炼铁容易等。(1)、铁因锈蚀而难于在自然界中存在。铁锈蚀是铁与作用的结果。(2)、用矿石还原生产铜和铁,反应所需温度差别较大,这与两者活泼性有关。现有铁片、铜丝、稀硫酸、硫酸铜、氢氧化钠等药品和必要仪器,设计一个简单实验证明铁的金属性比铜活泼。
实验操作
实验预期现象
(3)、唐代方士金陵子发明了“点铜成银”之术:将砒霜(As2O3)与面粉用水揉成团粘于柳木棍上,阴干后将其插入熔化的铜中,从而得到“白银”。①“白银”实为铜砷合金。合金中的砷来源于砒霜与碳的置换反应,其化学方程式为。
②“点铜成银”(即通过化学变化将铜转化为银)是不可能的,因为。
13. t℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量之间的关系如图所示。回答下列问题: (1)、蒸发溶剂前,(填“甲”或“乙”)是饱和溶液;(2)、b点对应的乙溶液是(填“饱和溶液”或“不饱和溶液”);(3)、t℃时,(填“甲”或“乙”)的溶解度更大;(4)、甲的饱和溶液的质量分数是(用含m、n的代数式表示)。14. 空气质量意味着生活质量。(1)、下表为某同学测量的呼吸前后气体组成的实验数据(通常状况)。
(1)、蒸发溶剂前,(填“甲”或“乙”)是饱和溶液;(2)、b点对应的乙溶液是(填“饱和溶液”或“不饱和溶液”);(3)、t℃时,(填“甲”或“乙”)的溶解度更大;(4)、甲的饱和溶液的质量分数是(用含m、n的代数式表示)。14. 空气质量意味着生活质量。(1)、下表为某同学测量的呼吸前后气体组成的实验数据(通常状况)。物质
吸入空气(体积分数/%)
呼出气体(体积分数/%)
氮气
78
75
氧气
21
16
二氧化碳
0.03
4
水蒸气
a
b
①氮气的化学性质比较(填“稳定”或“活泼”),在呼吸前后没有发生变化,实验中呼出气体的总体积吸入空气的总体积(填“>”“=”或“<”)。
②呼吸时消耗O2产生CO2 , 该过程能量(填“吸收”或“释放”)。呼吸前后气体中水蒸气含量变化较大,实验中其体积分数ba(填“>”“=”或“<”)。
(2)、远在高空是地球卫士,近在身边是健康杀手。”臭氧(O3)对环境的作用需辩证地认识。①高空中臭氧层能吸收紫外线,有学者认为,致冷剂氟利昂进入高空大气后会产生氯原子(Cl),引发以下反应:Ⅰ、Cl+O3=ClO+O2 Ⅱ、 , Cl加快了上述转化过程总反应的速率,但自身的质量和化学性质在总反应前后没有发生变化,其作用是 , 该转化过程总反应的化学方程式为。
②地面附近的臭氧是一种空气污染物,臭氧属于(填“单质”或“化合物”),O3可表示一个(填“原子”“分子”或“离子”)。
三、综合题
-
15. 利用毒重石(主要成分为BaCO3 , 含CaCO3和Fe2O3等杂质)制备BaCl2的流程如图所示(流程中铁渣、钙渣分别为不溶性的含铁、钙化合物)。根据要求回答问题:
 (1)、步骤①中,发生了多个化学反应,其中一个反应的化学方程式为。(2)、步骤②中,铁渣的化学式为。(3)、步骤④中,对应操作的名称为。(4)、步骤①前,应将毒重石充分研磨为粉末。这样做的目的是。(5)、步骤③中,加入的溶液A不可能是碳酸钠溶液,理由是。
(1)、步骤①中,发生了多个化学反应,其中一个反应的化学方程式为。(2)、步骤②中,铁渣的化学式为。(3)、步骤④中,对应操作的名称为。(4)、步骤①前,应将毒重石充分研磨为粉末。这样做的目的是。(5)、步骤③中,加入的溶液A不可能是碳酸钠溶液,理由是。四、实验题
-
16. 小红和同学们完成了实验室制取氧气和验证氧气性质的实验,并进行了相关问题的思考。请结合图文信息完成下列任务。
 (1)、图1:仪器a的名称是 , 发生反应的化学方程式是。(2)、图2:当气体从b端进c端出时,可收集到的一种气体是(写名称)。(3)、图3:点燃系在螺旋状细铁丝底端的火柴,待时,插入集气瓶中。(4)、图4:木炭点燃伸入氧气中,继续燃烧,能说明产物有二氧化碳的现象是。17. 镁条加入盛有稀盐酸的试管中,有大量气泡产生,试管壁发热。反应停止后,试管底部有白色不溶物剩余。
(1)、图1:仪器a的名称是 , 发生反应的化学方程式是。(2)、图2:当气体从b端进c端出时,可收集到的一种气体是(写名称)。(3)、图3:点燃系在螺旋状细铁丝底端的火柴,待时,插入集气瓶中。(4)、图4:木炭点燃伸入氧气中,继续燃烧,能说明产物有二氧化碳的现象是。17. 镁条加入盛有稀盐酸的试管中,有大量气泡产生,试管壁发热。反应停止后,试管底部有白色不溶物剩余。资料摘要:
镁条与稀盐酸混合,主要发生金属与酸的置换反应,还可能发生其他两个反应,三个反应I、II、III的产物如下表所示。
I
II
III
H2。
MgCl2
(易溶于水)
H2。
Mg(OH)2
(难溶于水,可溶于酸)
H2。
Mg(OH)Cl
(难溶于水,可溶于酸)
(1)、证明白色不溶物是否含镁条的方法是。(2)、常温下,II反应不容易发生,随温度升高,该反应越容易进行。本实验,II能够发生原因是 , 反应的化学方程式是。(3)、为验证试管底部的白色不溶物中含Mg(OH)Cl,设计如下实验:
上述设计不够严密,具体是。
(4)、出现白色不溶物与镁条的量有关系,请设计实验探究。①猜想:镁条的量越(填“多”或“少”),出现的白色不溶物越多。
②简述探究实验方案:(写出实验操作及可能的)。
五、计算题
-
18. 某水泥厂的技术人员为测定一批石灰石矿样中碳酸钙含量,称取四份质量均为10.0 g的样品,磨成粉末后分别置于A、B、C、D四个烧杯中、往四个烧杯中加入不同体积的同种稀盐酸,充分反应后测量烧杯中剩余固体的质量,结果如下表(已知:样品中的杂质不溶于水且不与稀酸盐反应)。
烧杯标号
A
B
C
D
加入稀盐酸的体积(g)
7.5
15.0
22.5
30.0
剩余固体的质量(g)
7.0
4.0
1.0
1.0
回答(求解)下列问题:
(1)、样品中碳酸钙的质量分数为。(2)、10.0g该样品与足量稀盐酸反应后产生二氧化碳的质量(计算结果精确到0.01g)。
-