2021年北京市房山区中考二模化学试题
试卷更新日期:2022-03-14 类型:中考模拟
一、单选题
-
1. 空气成分中,体积分数最大的是( )A、氮气 B、二氧化碳 C、氧气 D、稀有气体2. 地壳中含量最多的元素是( )A、硅 B、氧 C、铁 D、铝3. 铝片能压成铝箔,说明铝具有良好的( )A、导电性 B、导热性 C、延展性 D、抗腐蚀性4. 下列图标中,表示“禁止燃放鞭炮”的是( )A、
 B、
B、 C、
C、 D、
D、 5. 下列含金属元素的物质是( )A、H2O B、P2O5 C、Ca(OH)2 D、C2H5OH6. 下列物质中,属于纯净物的是( )A、氢气 B、空气 C、不锈钢 D、澄清的石灰水7. 下列人体所必需的元素中,缺乏会引起贫血的是( )A、铁 B、钙 C、碘 D、锌8. 下列物质放入水中,能形成溶液的是( )A、冰块 B、奶粉 C、泥沙 D、酒精9. 下列物质通常不会损害人体健康的是( )A、一氧化碳 B、黄曲霉素 C、甲醛 D、水10. 下列物品所使用的主要材料不属于有机合成材料的是( )A、塑料水瓶
5. 下列含金属元素的物质是( )A、H2O B、P2O5 C、Ca(OH)2 D、C2H5OH6. 下列物质中,属于纯净物的是( )A、氢气 B、空气 C、不锈钢 D、澄清的石灰水7. 下列人体所必需的元素中,缺乏会引起贫血的是( )A、铁 B、钙 C、碘 D、锌8. 下列物质放入水中,能形成溶液的是( )A、冰块 B、奶粉 C、泥沙 D、酒精9. 下列物质通常不会损害人体健康的是( )A、一氧化碳 B、黄曲霉素 C、甲醛 D、水10. 下列物品所使用的主要材料不属于有机合成材料的是( )A、塑料水瓶 B、涤纶书包
B、涤纶书包 C、羊毛围巾
C、羊毛围巾 D、橡胶雨鞋
D、橡胶雨鞋 11. 下列化学符号能表示两个氮原子的是( )A、N2 B、2N C、2N2 D、N2O12. 下列物质中,不需密封保存的是( )A、食盐 B、浓盐酸 C、氢氧化钙 D、氢氧化钠13. 下列物质溶于水时,溶液温度明显降低的是( )A、氯化钠 B、硝酸铵 C、浓硫酸 D、氢氧化钠14. 下列基本操作中,正确的是( )A、直接用手抓取药品 B、用酒精灯的焰心加热物质 C、用剩的药品放回原瓶 D、量取液体时平视量筒内凹液面最低处15. 下列化学式能正确表示物质组成的是( )A、氧化铁FeO B、硝酸银AgNO3 C、氯化铜CUCl2 D、高锰酸钾K2MnO416. 酒精灯中的酒精酒在桌面上燃烧起来,立即用湿抹布盖灭,其灭火原理是( )A、隔绝空气 B、降低酒精的着火点 C、清除可燃物 D、降温到着火点以下17. 如图所示装置不能达到的目的是( )
11. 下列化学符号能表示两个氮原子的是( )A、N2 B、2N C、2N2 D、N2O12. 下列物质中,不需密封保存的是( )A、食盐 B、浓盐酸 C、氢氧化钙 D、氢氧化钠13. 下列物质溶于水时,溶液温度明显降低的是( )A、氯化钠 B、硝酸铵 C、浓硫酸 D、氢氧化钠14. 下列基本操作中,正确的是( )A、直接用手抓取药品 B、用酒精灯的焰心加热物质 C、用剩的药品放回原瓶 D、量取液体时平视量筒内凹液面最低处15. 下列化学式能正确表示物质组成的是( )A、氧化铁FeO B、硝酸银AgNO3 C、氯化铜CUCl2 D、高锰酸钾K2MnO416. 酒精灯中的酒精酒在桌面上燃烧起来,立即用湿抹布盖灭,其灭火原理是( )A、隔绝空气 B、降低酒精的着火点 C、清除可燃物 D、降温到着火点以下17. 如图所示装置不能达到的目的是( )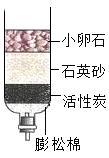 A、除去泥沙 B、使有色水褪色 C、除去臭味 D、使河水变为纯水18. 保护环境,实现碳达峰、碳中和,应从降低生活中的碳排放开始。下列做法不符合“低碳”要求的是( )A、随手关闭电源 B、分类投放垃圾 C、随意露天烧烤 D、践行“光盘行动”19. 为证明铁与氧气、水同时接触时易生锈,下列实验必须要做的有( )
A、除去泥沙 B、使有色水褪色 C、除去臭味 D、使河水变为纯水18. 保护环境,实现碳达峰、碳中和,应从降低生活中的碳排放开始。下列做法不符合“低碳”要求的是( )A、随手关闭电源 B、分类投放垃圾 C、随意露天烧烤 D、践行“光盘行动”19. 为证明铁与氧气、水同时接触时易生锈,下列实验必须要做的有( )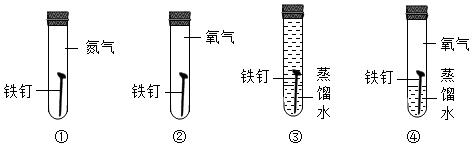 A、④ B、②③ C、①③④ D、②③④20. 如图所示实验中,两朵石蕊纸花均为一半干燥一半湿润。下列说法正确的是( )
A、④ B、②③ C、①③④ D、②③④20. 如图所示实验中,两朵石蕊纸花均为一半干燥一半湿润。下列说法正确的是( ) A、两朵纸花干湿部分均全部变色 B、两朵纸花湿润部分由下至上依次变蓝 C、该实验证明二氧化碳的密度比空气的小 D、该实验证明二氧化碳能与水发生化学反应21. 烧烤类食物中含有的苯并芘(C20H12)。是一种致癌物。下列说法正确的是( )A、苯并芘由碳、氢元素组成 B、每个苯并芘分子中含有6个氢分子 C、苯并芘的相对分子质量为252g D、苯并芘中碳、氢元素的质量比为5:322. 下列实验操作中,不能达到实验目的的是( )
A、两朵纸花干湿部分均全部变色 B、两朵纸花湿润部分由下至上依次变蓝 C、该实验证明二氧化碳的密度比空气的小 D、该实验证明二氧化碳能与水发生化学反应21. 烧烤类食物中含有的苯并芘(C20H12)。是一种致癌物。下列说法正确的是( )A、苯并芘由碳、氢元素组成 B、每个苯并芘分子中含有6个氢分子 C、苯并芘的相对分子质量为252g D、苯并芘中碳、氢元素的质量比为5:322. 下列实验操作中,不能达到实验目的的是( )选项
实验目的
实验操作
A
软化硬水
滴入肥皂水
B
除去NaCl固体中混有的泥沙
溶解、过滤、蒸发
C
鉴别澄清石灰水和NaOH溶液
通入二氧化碳
D
比较Zn、Cu、Ag的金属活动性
将Zn和Ag分别放入CuSO4溶液中
A、A B、B C、C D、D23. 下列现象中,能说明装置漏气的是( ) A、实验1中用手紧贴试管外壁,烧杯中导管口有气泡冒出 B、实验1中将试管放入冰水里,烧杯中导管内上升一段水柱 C、实验2中向外拉注射器活塞,长颈漏斗下端冒出气泡 D、实验2中向里推注射器活塞,长颈漏斗内无明显变化24. KNO3和KCl的溶解度曲线如图所示。下列说法不正确的是( )
A、实验1中用手紧贴试管外壁,烧杯中导管口有气泡冒出 B、实验1中将试管放入冰水里,烧杯中导管内上升一段水柱 C、实验2中向外拉注射器活塞,长颈漏斗下端冒出气泡 D、实验2中向里推注射器活塞,长颈漏斗内无明显变化24. KNO3和KCl的溶解度曲线如图所示。下列说法不正确的是( ) A、KNO3的溶解度随温度升高而增大 B、t1℃时,KNO3和KCl的溶解度相等 C、t2℃时,KNO3的饱和溶液中溶质质量分数为85.5% D、将t2℃时KNO3和KCl的饱和溶液分别降温至t1℃,均有固体析出25. 如图表示加热一定质量的高锰酸钾固体时,某变量y随时间的变化趋势。变量y表示的是( )
A、KNO3的溶解度随温度升高而增大 B、t1℃时,KNO3和KCl的溶解度相等 C、t2℃时,KNO3的饱和溶液中溶质质量分数为85.5% D、将t2℃时KNO3和KCl的饱和溶液分别降温至t1℃,均有固体析出25. 如图表示加热一定质量的高锰酸钾固体时,某变量y随时间的变化趋势。变量y表示的是( ) A、高锰酸钾的质量 B、固体中钾元素的质量 C、生成氧气的质量 D、固体中MnO2的质量
A、高锰酸钾的质量 B、固体中钾元素的质量 C、生成氧气的质量 D、固体中MnO2的质量二、填空题
-
26. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
A补齐物质与其用途的连线
B补齐化学肥料与其类别的连线

 27. 皮蛋又称松花蛋,是我国的特有食品。制作皮蛋的主要原料有新鲜鸭蛋、生石灰、食盐、纯碱、草木灰等。(1)、制作过程中生石灰与水反应的化学方程式为。(2)、皮蛋腌制液显碱性,其pH7(填“<”、“>”或“=”)。(3)、用皮蛋可制成各种美食,其中皮蛋瘦肉粥中含有的营养素有____(填序号)。A、蛋白质 B、糖类 C、水28. 自然界中的碳循环过程如图所示。
27. 皮蛋又称松花蛋,是我国的特有食品。制作皮蛋的主要原料有新鲜鸭蛋、生石灰、食盐、纯碱、草木灰等。(1)、制作过程中生石灰与水反应的化学方程式为。(2)、皮蛋腌制液显碱性,其pH7(填“<”、“>”或“=”)。(3)、用皮蛋可制成各种美食,其中皮蛋瘦肉粥中含有的营养素有____(填序号)。A、蛋白质 B、糖类 C、水28. 自然界中的碳循环过程如图所示。 (1)、碳循环中的“碳”是指(填“碳元素”或“碳单质”)。(2)、化石燃料的燃烧是CO2的重要来源,化石燃料包括煤,石油和。29. 光热发电站工作原理如图所示。
(1)、碳循环中的“碳”是指(填“碳元素”或“碳单质”)。(2)、化石燃料的燃烧是CO2的重要来源,化石燃料包括煤,石油和。29. 光热发电站工作原理如图所示。 (1)、该发电站利用的新能源是。(2)、凝汽器中水蒸气冷凝为水,从微粒的角度分析,变化的是。30. 硝酸(HNO3)是一种重要的化工原料,工业制硝酸的主要转化过程如下:
(1)、该发电站利用的新能源是。(2)、凝汽器中水蒸气冷凝为水,从微粒的角度分析,变化的是。30. 硝酸(HNO3)是一种重要的化工原料,工业制硝酸的主要转化过程如下: (1)、①中反应的微观示意图如下,参加反应的N2和H2的分子个数比为。
(1)、①中反应的微观示意图如下,参加反应的N2和H2的分子个数比为。 (2)、③中发生的化学反应为 , 其中化合价发生改变的元素为。(3)、①-④中的物质,属于氧化物的是。31. 在井穴板1~5的孔穴中,分别滴加一定量稀盐酸。
(2)、③中发生的化学反应为 , 其中化合价发生改变的元素为。(3)、①-④中的物质,属于氧化物的是。31. 在井穴板1~5的孔穴中,分别滴加一定量稀盐酸。 (1)、能证明稀盐酸显酸性的是(填“1”或“2”)。(2)、孔穴3中观察到的现象是:固体减少、。(3)、孔穴4中反应的化学方程式为。(4)、孔穴5中溶液由红色变为无色,测得反应后溶液的pH为2,则该溶液中的溶质是。32. 下列文物中,由金属材料制成的是( )A、史前时期石雕
(1)、能证明稀盐酸显酸性的是(填“1”或“2”)。(2)、孔穴3中观察到的现象是:固体减少、。(3)、孔穴4中反应的化学方程式为。(4)、孔穴5中溶液由红色变为无色,测得反应后溶液的pH为2,则该溶液中的溶质是。32. 下列文物中,由金属材料制成的是( )A、史前时期石雕 B、春秋青铜编钟
B、春秋青铜编钟 C、西汉角形玉杯
C、西汉角形玉杯 D、唐代鎏金银壶
D、唐代鎏金银壶 33. 广东“南海一号”南宋沉船出土的金叶子和金缨络胸佩(如图)。在海底沉睡800年至今仍光彩照人,从物质性质的角度解释其原因:。
33. 广东“南海一号”南宋沉船出土的金叶子和金缨络胸佩(如图)。在海底沉睡800年至今仍光彩照人,从物质性质的角度解释其原因:。

三、科普阅读题
-
34. 阅读下面科普短文。
柠檬果实含有丰富的维生素,有机酸和矿物质等,具有极高的营养价值和药用价值,是继柑、橙之后的第三大柑橘类水果。
柠檬鲜果的酸度较高,一定程度上限制了其食用量。目前柠檬鲜果加工主要以生产柠檬干片和果汁饮料为主、但柠檬鲜果皮、籽、果肉中均含有大量柚皮苷(C27H32O14)等苦味物质,在榨汁、灭菌、贮藏等加工过程中会产生“后苦味”现象,严重制约了柠檬果汁饮料产业的发展,因此,在柠檬汁加工产业中常使用柚皮苷酶进行脱苦,相关因素对脱苦率的影响如下图所示。



柠檬的不同部位中柚皮苷的含量不同,柠檬籽中柚皮苷的含量最高,果皮次之,再次是果肉,果汁中柚皮苷含量最少。未成熟柠檬比成熟柠檬中的柚皮苷含量高。
近年来的研究结果显示,柚皮苷在抗癌、抗氧化等方面效果显著,因此可用于医药工业生产。
依据文章内容回答下列问题。
(1)、鲜榨柠檬汁存在苦味的原因是。(2)、柚皮苷(C27H32O14)中碳元素质量分数的计算式为。(3)、由图2可知,柠檬汁脱苦率与酶解温度的关系为。(4)、下列说法正确的是____(填序号)。A、柚皮苷(C27H32O14)属于有机物 B、使用柚皮苷酶为柠檬汁脱苦时,酶用量越多越好 C、使用柚皮苷酶脱苦的最佳反应时间约为90分钟 D、柚皮苷可用于生产抗癌药物(5)、生活中,用柠檬鲜果泡柠檬水时,可以采用的方法减少柠檬水的苦味。四、综合题
-
35. 氟化铝(AlF3)在电解铝工业中有重要作用,其制备的主要工艺流程如下:
 (1)、加热器中,硫酸与萤石(CaF2)发生复分解反应的化学方程式为。(2)、气化炉中发生的是(填“物理变化”或“化学变化”)。(3)、反应器中,HF和Al2O3发生如下反应,补全反应的化学方程式。
(1)、加热器中,硫酸与萤石(CaF2)发生复分解反应的化学方程式为。(2)、气化炉中发生的是(填“物理变化”或“化学变化”)。(3)、反应器中,HF和Al2O3发生如下反应,补全反应的化学方程式。。
36. 实验室用如图装置制取O2。 (1)、反应的化学方程式为。(2)、用向上排空气法收集O2的原因是。37. 进行如下实验,研究氧气的性质。
(1)、反应的化学方程式为。(2)、用向上排空气法收集O2的原因是。37. 进行如下实验,研究氧气的性质。 (1)、实验1中木炭燃烧的现象为。(2)、实验2中发生反应的化学方程式为。38. 配制50g溶质质量分数为10%的NaCl溶液。
(1)、实验1中木炭燃烧的现象为。(2)、实验2中发生反应的化学方程式为。38. 配制50g溶质质量分数为10%的NaCl溶液。 (1)、需要NaCl和水的质量分别为。(2)、实验操作顺序为(填序号)。(3)、将配制好的溶液装瓶、贴标签:在右侧标签中填上相应的内容。
(1)、需要NaCl和水的质量分别为。(2)、实验操作顺序为(填序号)。(3)、将配制好的溶液装瓶、贴标签:在右侧标签中填上相应的内容。 39. 利用下图所示装置进行实验。
39. 利用下图所示装置进行实验。 (1)、A中电子秤示数变化的原因是。(2)、B中观察到的现象为。(3)、C中反应的化学方程式为。(4)、以上实验能验证质量守恒定律的是(填序号)。40. 下图“点火成蛇”实验中,在蔗糖和碳酸氢钠混合物周围的草木灰上滴加20滴酒精,点燃酒精引燃混合物,一段时间后,产生疏松弯曲的蛇状物。
(1)、A中电子秤示数变化的原因是。(2)、B中观察到的现象为。(3)、C中反应的化学方程式为。(4)、以上实验能验证质量守恒定律的是(填序号)。40. 下图“点火成蛇”实验中,在蔗糖和碳酸氢钠混合物周围的草木灰上滴加20滴酒精,点燃酒精引燃混合物,一段时间后,产生疏松弯曲的蛇状物。
【提出问题】影响“点火成蛇”实验效果的因素有哪些?
【查阅资料】
“点火成蛇”实验的反应原理是:蔗糖受热发生燃烧、熔化、氧化、炭化等变化,蔗糖氧化和碳酸氢钠分解生成的二氧化碳气体顶着黏稠变软的蔗糖不断向外生长,形成“蛇”的形状。
【进行实验】
实验1:取质量比一定的蔗糖和碳酸氢钠的混合物,进行实验。
序号
1-1
1-2
1-3
1-4
1-5
1-6
蔗糖和碳酸氢钠混合物的质量/g
0.1
0.2
0.3
0.4
0.5
0.6
成“蛇”长度/cm
5
14.5
21
24
25
33.4
实验2:取0.5g蔗糖和碳酸氢钠的混合物,进行实验。
序号
2-1
2-2
2-3
2-4
2-5
2-6
蔗糖和碳酸氢钠的质量比
5:1
6:1
7:1
8:1
9:1
10:1
成“蛇”长度/cm
23.5
23.8
24.5
25
19.6
16
实验3:取0.5g质量比为10:1的蔗糖和碳酸氢钠的混合物,进行实验。
组别
第1组
第2组
序号
3-1
3-2
3-3
3-4
3-5
3-6
3-7
3-8
草木灰颗粒大小
未研磨
未研磨
未研磨
研磨
研细
研细
研细
研细
草木灰质量/g
0.2
0.3
0.4
0.5
0.2
0.3
0.4
0.5
成“蛇”长度/cm
16
16
16
16
16
16
16
16
(1)、【解释与结论】碳酸氢钠的俗称为。
(2)、实验1的目的是。(3)、实验2中,产生“长蛇”的蔗糖和碳酸氢钠的最佳质量比为。(4)、实验3中,对比第1组和第2组实验,可得到的结论是。(5)、综合分析,影响“点火成蛇”实验效果的因素有。(6)、【反思与评价】实验中,酒精的作用是____(填序号)。
A、作催化剂 B、作“点火成蛇”的反应物 C、燃烧时放热,以提供热量五、计算题
-
41. 过氧化钠(Na2O2)常用作呼吸面具和潜水艇中的供氧剂,发生反应的化学方程式为:。计算156g过氧化钠(Na2O2)理论上可以制得O2的质量。
-