江苏省无锡市2021年中考化学试题
试卷更新日期:2022-03-10 类型:中考真卷
一、单选题
-
1. “奋斗者号”载人潜水器采用新型钛合金作为舱壳材料。钛合金属于( )A、金属材料 B、非金属材料 C、合成材料 D、复合材料2. 海水中含量最高的元素是( )A、H B、O C、Na D、Cl3. 下列物质属于纯净物的是( )A、矿泉水 B、金刚石 C、不锈钢 D、可燃冰4. 下列物质放入水中能形成溶液的是( )A、蔗糖 B、汽油 C、面粉 D、泥沙5. 下列食品可作为人体获取维生素主要来源的是( )A、乌米饭 B、水蜜桃 C、酱排骨 D、马蹄酥6. 自来水厂净水过程中不常用的方法是( )A、沉淀 B、过滤 C、吸附 D、蒸馏7. 下列化学用语中数字“2”表示的意义正确的是( )A、2H——2个氢元素 B、O2——2个氧原子 C、2CO——2个一氧化碳分子 D、Fe2+——1个铁离子带2个单位正电荷8. 1875年,布瓦博德朗利用光谱分析在闪锌矿中发现了镓,门捷列夫预言的“类铝”元素得到了证实。如图是镓元素在元素周期表中的信息。下列叙述不正确的是( )
 A、镓是一种金属元素 B、镓的相对原子质量是69.72g C、镓原子中的质子数是31 D、镓与铝的性质相似9. 丙氨酸(C3H7O2N)是一种常见的氨基酸。下列叙述正确的是( )A、丙氨酸属于有机小分子化合物 B、丙氨酸是一种蛋白质 C、每个丙氨酸分子中含有1个氧分子 D、丙氨酸中碳、氮元素的质量比为3:110. 下列物质的性质与用途对应关系正确的是( )A、石墨有导电性,可用于生产铅笔芯 B、银有金属光泽,可用于制造电线 C、二氧化碳能与水反应,可用于灭火 D、熟石灰溶液有碱性,可用于改良酸性土壤11. 如图是甲和乙在一定条件下反应前后分子种类变化的微观示意图。下列叙述正确的是( )
A、镓是一种金属元素 B、镓的相对原子质量是69.72g C、镓原子中的质子数是31 D、镓与铝的性质相似9. 丙氨酸(C3H7O2N)是一种常见的氨基酸。下列叙述正确的是( )A、丙氨酸属于有机小分子化合物 B、丙氨酸是一种蛋白质 C、每个丙氨酸分子中含有1个氧分子 D、丙氨酸中碳、氮元素的质量比为3:110. 下列物质的性质与用途对应关系正确的是( )A、石墨有导电性,可用于生产铅笔芯 B、银有金属光泽,可用于制造电线 C、二氧化碳能与水反应,可用于灭火 D、熟石灰溶液有碱性,可用于改良酸性土壤11. 如图是甲和乙在一定条件下反应前后分子种类变化的微观示意图。下列叙述正确的是( ) A、甲与丙均属于氧化物 B、反应生成的丙与丁的分子个数比为1:1 C、反应后原子的数目增加 D、该反应能使有害气体转化为无害物质12. 下列叙述正确的是( )A、实验室制取O2:2KMnO4═K2MnO4+MnO2+O2↑ B、工业上分离液态空气得到O2的变化属于化学变化 C、自然界中植物通过光合作用吸收CO2 , 释放O2 D、人体呼出的气体中CO2的含量比O2高13. “侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3=NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( )
A、甲与丙均属于氧化物 B、反应生成的丙与丁的分子个数比为1:1 C、反应后原子的数目增加 D、该反应能使有害气体转化为无害物质12. 下列叙述正确的是( )A、实验室制取O2:2KMnO4═K2MnO4+MnO2+O2↑ B、工业上分离液态空气得到O2的变化属于化学变化 C、自然界中植物通过光合作用吸收CO2 , 释放O2 D、人体呼出的气体中CO2的含量比O2高13. “侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3=NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( ) A、0℃时,NH4Cl的溶解度大于NaCl的溶解度 B、20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数 C、20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出 D、NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl14. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )
A、0℃时,NH4Cl的溶解度大于NaCl的溶解度 B、20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数 C、20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出 D、NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl14. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )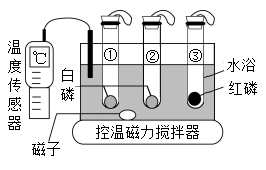 A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用15. 将0.72g草酸亚铁(FeC2O4)放在一个可称量的敞口容器中高温焙烧,500~600℃时,容器中的固体质量保持0.4g不变。所得物质的化学式为( )A、Fe B、FeO C、Fe2O3 D、Fe3O4
A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用15. 将0.72g草酸亚铁(FeC2O4)放在一个可称量的敞口容器中高温焙烧,500~600℃时,容器中的固体质量保持0.4g不变。所得物质的化学式为( )A、Fe B、FeO C、Fe2O3 D、Fe3O4二、填空题
-
16. 氮及其化合物的“价类二维图”如图所示。
 (1)、A点对应的物质可以是 (填字母)。
(1)、A点对应的物质可以是 (填字母)。a.氮气 b.氧气 c.氢气
(2)、B点对应物质的化学式是 (填字母)。a.N2O b.NO c.N2O3
(3)、NH3•H2O的物质类别是 (填字母)。a.酸 b.碱 c.盐
(4)、KNO3在图中对应的点是 (填字母)。a.C b.D c.E
17. 家用燃料变迁过程的示意图如图: (1)、2020年,受新冠疫情的影响,全球工业生产排放的温室气体比2019年(填“上升”或“下降”)。(2)、秸秆在隔绝空气的条件下受热分解生成H2、CH4和CO等气体,则秸秆中一定含有的元素有;煤炭燃烧时排放出NO2、等气体,在空气中会形成酸雨。(3)、由液化石油气(主要成分为C3H8)改为压缩天然气(主要成分为CH4)时,燃气报警器应安装在灶具的(填“上方”或“下方”);写出CH4完全燃烧的化学方程式:。(4)、为实现我国“2030年前碳达峰,2060年前碳中和”的目标,你认为能源综合利用的趋势是。18. 氢气是一种可持续研发的新能源和工业原料。(1)、利用太阳能将水转化为氢能是一种理想途径。某种光分解水的过程如图甲所示。
(1)、2020年,受新冠疫情的影响,全球工业生产排放的温室气体比2019年(填“上升”或“下降”)。(2)、秸秆在隔绝空气的条件下受热分解生成H2、CH4和CO等气体,则秸秆中一定含有的元素有;煤炭燃烧时排放出NO2、等气体,在空气中会形成酸雨。(3)、由液化石油气(主要成分为C3H8)改为压缩天然气(主要成分为CH4)时,燃气报警器应安装在灶具的(填“上方”或“下方”);写出CH4完全燃烧的化学方程式:。(4)、为实现我国“2030年前碳达峰,2060年前碳中和”的目标,你认为能源综合利用的趋势是。18. 氢气是一种可持续研发的新能源和工业原料。(1)、利用太阳能将水转化为氢能是一种理想途径。某种光分解水的过程如图甲所示。

①该转化中循环利用的物质有Fe3O4和(填化学式);
②与电解水相比,该方法的优点是。
(2)、CH2﹣H2O催化重整是目前大规模制取H2的重要方法,生产过程中涉及的重要反应有CH4+H2OCO+3H2 , CO+H2OCO2+H2。①向催化重整体系中投入一定量的CaO可提高H2的百分含量,原因是;
②如图乙所示,投入纳米CaO时,H2的百分含量最大的原因是。
(3)、氢气可用于钢铁冶炼、合成氨和合成甲醇等工业。写出赤铁矿(主要成分为Fe2O3)与氢气在高温下炼铁的化学方程式:。三、综合题
-
19. 化学兴趣小组对CO2与NaOH溶液反应的发生进行了探究。(1)、从压强变化的角度探究。
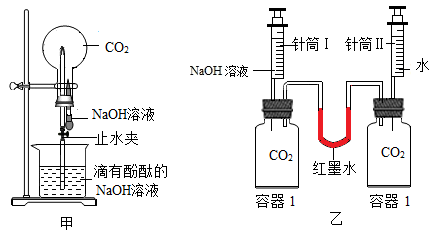
①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强(填“大于”或“小于”)外界大气压;
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是;
③写出CO2与NaOH溶液反应的化学方程式:。
(2)、利用“数字化实验”探究。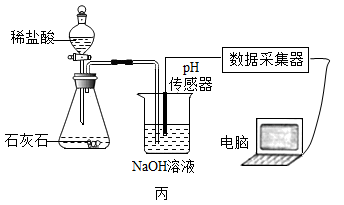
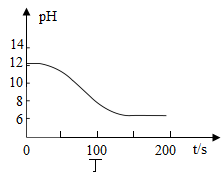
①写出图丙中制取CO2的化学方程式: , 检验CO2的方法是;
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是(填离子符号)。
(3)、氯碱工业生产的烧碱样品中常含有Na2CO3和NaCl等杂质。为测定烧碱样品中Na2CO3的质量分数,称取20g烧碱样品,加足量水溶解,再加入足量的BaCl2溶液,充分反应后,过滤,将滤渣洗涤、干燥、称量,得到0.197g碳酸钡(BaCO3)固体。①检验烧碱样品中是否含有Na2CO3 , 可选择的试剂是(填字母);
a.稀盐酸b.澄清石灰水c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。
20. 铜及其化合物在生活、生产中用途广泛。(1)、以氧化铜为原料制取铜。某研究小组为探究CO的还原性,设计了如下系列实验。
实验1:将CuO加水制成糊状,刷在试管内壁,在试管底部加入炭粉,再向试管中通入CO2(见图甲),集满后立即用气球密封。
实验2:用酒精灯加热CuO部位(见图乙),无明显现象。
实验3:用加网罩的酒精灯加热炭粉(见图丙);一段时间后,利用CO2传感器测得试管内CO2含量变小。
实验4:加热CuO(见图丁),黑色固体变成紫红色。

①实验1中浓硫酸的作用是;
②实验2得到的结论是;
③实验3的目的是 , 酒精灯加网罩的作用是;
④写出实验4中发生反应的化学方程式:。
(2)、以辉铜矿(主要成分为Cu2S)为原料冶炼铜。方法1:火法炼铜.Cu2S在高温下与氧气反应的部分转化关系如图:
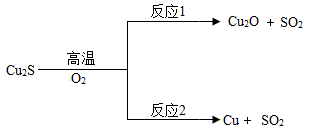
①Cu2O中铜元素的化合价为;
②反应2的基本类型是;
方法2:生物炼铜。Cu2S在酸性环境和微生物菌类的作用下转化为CuSO4的原理是Cu2S+O2+2H2SO4═2CuSO4+2H2O+X。
③X的化学式为;
④从含有CuSO4和H2SO4的混合溶液中回收铜,请补充完整实验方案。
步骤1:向一定量的混合溶液中加入过量的试剂Y,过滤,得到滤渣和滤液1。
步骤2:取步骤1中的滤渣, , 过滤,得到Cu和滤液2。
步骤3:将滤液1与滤液2合并,冷却结晶,得到FeSO4•7H2O晶体。
写出步骤1中发生反应的化学方程式:(任写1个)。