江苏省泰州市2021年中考化学试题
试卷更新日期:2022-03-10 类型:中考真卷
一、单选题
-
1. 下列变化属于化学变化的是( )A、石蜡熔化 B、轮胎爆炸 C、金属锈蚀 D、棉花纺线2. 下列物质由原子直接构成的是( )A、氯化钠 B、蔗糖 C、水 D、金刚石3. 下列材料属于复合材料的是( )A、合金 B、钢筋混凝土 C、合成橡胶 D、有机玻璃4. 水的三态变化,主要是由于( )A、水分子间隙变化 B、水分子大小变化 C、水分子种类变化 D、水分子质量变化5. 下列实验操作正确的是( )A、
 振荡试管
B、
振荡试管
B、 点燃镁条
C、
点燃镁条
C、 闻气体气味
D、
闻气体气味
D、 取走蒸发皿
6. 下列化学用语书写不正确的是( )A、银元素:AG B、氨气分子:NH3 C、氯化铁中铁元素的化合价: D、硅原子:Si7. 下列对实验现象的描述不正确的是( )A、浓硫酸滴到纸张上,纸张逐渐变黑 B、红磷在空气中燃烧,产生大量白烟 C、一氧化碳还原氧化铁,黑色固体变为红色固体 D、氯化铵和氢氧化钙混合加热,产生能使湿润的红色石蕊试纸变蓝的气体8. 含有“氚”的核废水直接排放会对人类生存环境造成一定的影响。氚原子的原子核内含有1个质子和2个中子,其核外电子数是( )A、1 B、2 C、3 D、69. 下列气体在空气中达到一定体积分数,遇明火不可能发生爆炸的是( )A、甲烷 B、一氧化碳 C、氢气 D、氮气10. 下列说法不正确的是( )A、在化学实验室内不得尝试任何药品的味道 B、为防止水污染应禁止使用农药和化肥 C、绝对不能食用含有黄曲霉毒素的食物 D、铝表面易形成致密氧化膜而“自我保护”11. 中国将采取更加有力的措施,努力争取2060年前实现碳中和。一种CO2的“捕捉”和转化过程如下:在高压时将烟道气中CO2溶解于甲醇(CH3OH),得到二氧化碳的甲醇溶液;用“捕捉”到的二氧化碳与氢气在一定条件下生产甲醇,同时生成水。下列说法不正确的是( )A、整个过程有助于减少温室气体排放 B、二氧化碳的甲醇溶液,溶剂是甲醇 C、转化过程中的“一定条件”可能需要合适的催化剂 D、转化过程中发生反应的化学方程式:CO2+H2CH3OH+H2O12. 下列说法正确的是( )A、含有氧元素的物质一定是氧化物 B、只含一种元素的物质一定是单质 C、质子数相同的原子一定属于同种元素 D、能与稀盐酸反应产生气泡的物质一定是活泼金属
取走蒸发皿
6. 下列化学用语书写不正确的是( )A、银元素:AG B、氨气分子:NH3 C、氯化铁中铁元素的化合价: D、硅原子:Si7. 下列对实验现象的描述不正确的是( )A、浓硫酸滴到纸张上,纸张逐渐变黑 B、红磷在空气中燃烧,产生大量白烟 C、一氧化碳还原氧化铁,黑色固体变为红色固体 D、氯化铵和氢氧化钙混合加热,产生能使湿润的红色石蕊试纸变蓝的气体8. 含有“氚”的核废水直接排放会对人类生存环境造成一定的影响。氚原子的原子核内含有1个质子和2个中子,其核外电子数是( )A、1 B、2 C、3 D、69. 下列气体在空气中达到一定体积分数,遇明火不可能发生爆炸的是( )A、甲烷 B、一氧化碳 C、氢气 D、氮气10. 下列说法不正确的是( )A、在化学实验室内不得尝试任何药品的味道 B、为防止水污染应禁止使用农药和化肥 C、绝对不能食用含有黄曲霉毒素的食物 D、铝表面易形成致密氧化膜而“自我保护”11. 中国将采取更加有力的措施,努力争取2060年前实现碳中和。一种CO2的“捕捉”和转化过程如下:在高压时将烟道气中CO2溶解于甲醇(CH3OH),得到二氧化碳的甲醇溶液;用“捕捉”到的二氧化碳与氢气在一定条件下生产甲醇,同时生成水。下列说法不正确的是( )A、整个过程有助于减少温室气体排放 B、二氧化碳的甲醇溶液,溶剂是甲醇 C、转化过程中的“一定条件”可能需要合适的催化剂 D、转化过程中发生反应的化学方程式:CO2+H2CH3OH+H2O12. 下列说法正确的是( )A、含有氧元素的物质一定是氧化物 B、只含一种元素的物质一定是单质 C、质子数相同的原子一定属于同种元素 D、能与稀盐酸反应产生气泡的物质一定是活泼金属二、多选题
-
13. 氯化钠、硝酸钾在不同温度时的溶解度如下表所示,下列有关说法正确的是( )
温度/℃
0
10
20
30
40
氯化钠溶解度/g
35.7
35.8
36
36.5
37
硝酸钾溶解度/g
13.3
20.9
31.6
45.8
63.9
A、在20℃时,20g氯化钠固体加入50g水中充分溶解后,得到氯化钠的不饱和溶液 B、在40℃时,硝酸钾的饱和溶液163.9g,若降温至20℃,析出32.3g硝酸钾晶体 C、氯化钠中混有少量硝酸钾时,宜采用降温结晶的方法提纯氯化钠 D、在20℃~30℃的范围内,存在某一温度,此温度下硝酸钾与氯化钠溶解度相等14. 下列实验方案不正确的是( )A、硬水软化成软水;将硬水进行蒸馏 B、氧气的验满;把带火星的木条伸入到集气瓶内 C、除去NaCl溶液中的Na2SO4;加入过量Ba(NO3)2溶液,过滤 D、鉴别氢氧化钠固体和硝酸铵固体;取样溶于水,测量溶解前后液体温度的变化,并作比较15. 在密闭反应体系内加热碳酸氢钠溶液,利用数字化仪器测量碳酸氢钠分解产生的二氧化碳体积分数随温度变化的曲线如图所示。下列说法正确的是( )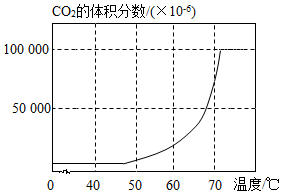 A、40℃~50℃之间的某一温度碳酸氢钠开始分解 B、随着温度的升高,二氧化碳的体积分数一直增大 C、使碳酸氢钠从其溶液中析出不宜用加热蒸发的方法 D、温度升高,溶液中钠元素和碳元素质量始终不变
A、40℃~50℃之间的某一温度碳酸氢钠开始分解 B、随着温度的升高,二氧化碳的体积分数一直增大 C、使碳酸氢钠从其溶液中析出不宜用加热蒸发的方法 D、温度升高,溶液中钠元素和碳元素质量始终不变三、实验题
-
16. 化学是一门以实验为基础的科学。请回答以下问题:(1)、现提供下列实验装置:
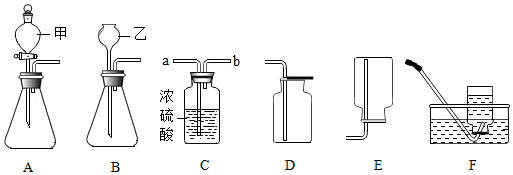
①A装置中仪器甲的名称是 , 实验室利用A装置,在二氧化锰催化下分解过氧化氢制氧气的化学方程式为 , 收集氧气可用装置(填字母)。
②利用C装置干燥氧气,需从导管口端通入气体(填“a”或“b”)。
③利用B装置制取气体时,仪器乙下端管口须伸入到液面以下,目的是。
(2)、实验探究物质燃烧所需要的条件如图所示。比较燃烧着的蜡烛罩上玻璃杯前后的燃烧情况,说明燃烧应具备的条件是;观察,比较使小木条和小煤块燃烧所需要的 , 说明燃烧应具备的条件是温度达到可燃物的着火点。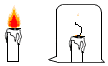
四、综合题
-
17. 英国《独立报》曾评出改变世界的101个发明,中国古代四大发明赫然在列,造纸术就是其中之一、一种现代造纸流程如图所示。
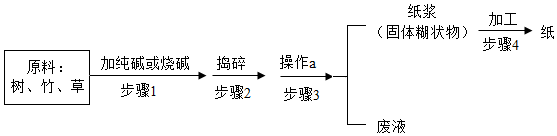 (1)、纸的主要成分是纤维素,纤维素属于营养物质中的类。纤维素组成用(C6H10O5)n表示,(填“属于”或“不属于”)有机高分子化合物,其中碳、氢元素的质量比为。废办公用纸属于(填“可回收”或“不可回收”)垃圾。(2)、烧碱、纯碱能与树、竹、草中的油脂作用。生活中用洗洁精洗油污,属于现象。(3)、步骤2中捣碎的目的是;步骤3中操作a的名称是 , 此操作中常用玻璃棒,作用是。(4)、经检测甲造纸厂废液中含有一定量的碳酸钠,可向废液中加入稀硫酸至不再产生(填现象)后待排放,环境监测员常用检测废液的pH,确认是否达标。(5)、经检测,乙造纸厂废液中含有一定量的NaOH,NaOH的质量分数为4%,现用H2SO4的质量分数为9.8%的废硫酸10t将其处理至中性,可以处理的废液质量是?(写出计算过程)18. A~J是初中化学常见的物质,相互之间能发生下列反应:①A+B→C+D ②D+E→B ③C+F→G+H ④B+F→G+I ⑤H+JA其中A是一种黑色固体,C溶液是蓝色,F、H、I、J为单质,通常状况下I、J为气体,反应②是形成硫酸型酸雨的某一步反应,E的分子中两种原子的个数比为1:3,反应③是湿法冶金的先驱。请回答下列问题:(1)、E的化学式为;反应④除生成气体处,还有的现象是;F在使用时易与空气中等物质作用生成一种疏松多孔的物质,造成资源损失。(2)、写出反应的化学方程式;反应③;反应⑤。①~⑤五个反应中,属于置换反应的是(填序号)。(3)、将过量F加入C溶液中充分反应,反应后与反应前相比,溶液质量(填“增大”“减小”或“不变”),过滤后所得固体的成分为。(4)、I在J中燃烧的化学方程式为 , I作为能源,其优势为(答一点)。19. 碳酸钙是初中阶段化学学习中的常见物质,某化学兴趣小组围绕此物质展开探究。
(1)、纸的主要成分是纤维素,纤维素属于营养物质中的类。纤维素组成用(C6H10O5)n表示,(填“属于”或“不属于”)有机高分子化合物,其中碳、氢元素的质量比为。废办公用纸属于(填“可回收”或“不可回收”)垃圾。(2)、烧碱、纯碱能与树、竹、草中的油脂作用。生活中用洗洁精洗油污,属于现象。(3)、步骤2中捣碎的目的是;步骤3中操作a的名称是 , 此操作中常用玻璃棒,作用是。(4)、经检测甲造纸厂废液中含有一定量的碳酸钠,可向废液中加入稀硫酸至不再产生(填现象)后待排放,环境监测员常用检测废液的pH,确认是否达标。(5)、经检测,乙造纸厂废液中含有一定量的NaOH,NaOH的质量分数为4%,现用H2SO4的质量分数为9.8%的废硫酸10t将其处理至中性,可以处理的废液质量是?(写出计算过程)18. A~J是初中化学常见的物质,相互之间能发生下列反应:①A+B→C+D ②D+E→B ③C+F→G+H ④B+F→G+I ⑤H+JA其中A是一种黑色固体,C溶液是蓝色,F、H、I、J为单质,通常状况下I、J为气体,反应②是形成硫酸型酸雨的某一步反应,E的分子中两种原子的个数比为1:3,反应③是湿法冶金的先驱。请回答下列问题:(1)、E的化学式为;反应④除生成气体处,还有的现象是;F在使用时易与空气中等物质作用生成一种疏松多孔的物质,造成资源损失。(2)、写出反应的化学方程式;反应③;反应⑤。①~⑤五个反应中,属于置换反应的是(填序号)。(3)、将过量F加入C溶液中充分反应,反应后与反应前相比,溶液质量(填“增大”“减小”或“不变”),过滤后所得固体的成分为。(4)、I在J中燃烧的化学方程式为 , I作为能源,其优势为(答一点)。19. 碳酸钙是初中阶段化学学习中的常见物质,某化学兴趣小组围绕此物质展开探究。相关信息:一定体积的溶液中,离子数目越多,其离子浓度越大;电导率传感器用于测定溶液的导电性强弱,在其他条件相同下,溶液中离子浓度越大;溶液的电导率越大。
(1)、【实验探究Ⅰ】将碳酸钙粉末在酒精喷灯上灼烧一段时间,再将灼烧后的固体物质投入盛水的烧杯中,滴加2滴酚酞试液,酚酞试液变红。对此现象分析,得出结论。碳酸钙高温发生了分解,反应的化学方程式为。
(2)、分解后固体产物与水反应的化学方程式为 , 此反应生成物能使酚酞试液变红,是因为在水溶液中产生离子(填离子符号)。小组经过讨论,对酚酞试液变红是否存在其他因素产生了疑问,进行下列实验。
(3)、【实验探究Ⅱ】在试管中加入少量碳酸钙粉末,加入2mL水,振荡摇匀,制成碳酸钙悬浊液,滴加2滴酚酞试液,酚酞试液变红。酚酞试液变红证明碳酸钙悬浊液显性。
(4)、在相同实验条件下,用电导率传感器测得水的电导率为8.5,碳酸钙悬浊液电导率为74.与水比较,碳酸钙悬浊液中离子浓度较(填“大”或“小”),证明在碳酸钙悬浊液中有部分碳酸钙溶于水,形成碳酸钙的(填“饱和”或“不饱和”)溶液。(5)、小组继续探究碳酸钙悬浊液使酚酞试液变红的微观原因,做了下面的对照实验:用pH传感器分别测得在常温下五种混合体系的pH,如下表所示。混合体系
①Na2CO3溶液
②NaCl溶液
③CaCl2溶液
④K2CO3溶液
⑤CaCO3悬浊液
pH
11.6
7.0
7.0
11.6
10.1
从上表可知,“盐溶液一定显中性”的说法是(填“正确”或“不正确”)的。
结合①②③④的数据分析可知,Na2CO3溶液使酚酞试液变红与碳酸钠组成中离子(填离子符号)有关。查阅资料可知碳酸钠能与水发生一定程度的反应生成一种钠盐和另一种化合物,试写出此反应两种生成物的化学式:。结合⑤的数据分析。碳酸钙悬浊液使酚酞试液变色原因与碳酸钠溶液使酚酞试液变色原因本质上是一致的。
(6)、【拓展延伸】进一步探究,将碳酸钙悬浊液滴加酚酞试液加热,红色会变浅,经测定pH减小。联系所学知识,对此现象产生的原因猜测合理的是____(填字母)。A、碳酸钙的溶解度随着温度的升高而降低 B、温度升高增大了某离子与水作用的速率,碱性增强 C、加热时部分碳酸钙发生了分解反应
-