江苏省淮安市2021年中考化学试题
试卷更新日期:2022-03-10 类型:中考真卷
一、单选题
-
1. 空气中含量最多的物质是( )A、O2 B、N2 C、H2O D、CO22. 下列变化属于化学变化的是( )A、瓷碗破碎 B、酒精挥发 C、湿衣晾干 D、苹果腐烂3. 下列关于水的说法正确的是( )A、水中氢、氧元素的质量比为2:1 B、水由氢原子和氧原子组成 C、水中异味与色素可用活性炭吸附 D、水资源取之不尽用之不竭4. 下列有关“粗盐的初步提纯”的实验操作不符合规范要求的是( )A、
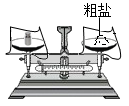 称量
B、
称量
B、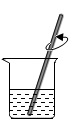 溶解
C、
溶解
C、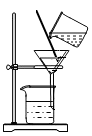 过滤
D、
过滤
D、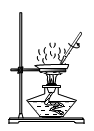 蒸发
5. 下列有关燃烧与灭火的说法不正确的是( )A、物质燃烧时伴随着发光、发热 B、吹灭蜡烛的灭火原理是隔绝氧气 C、图书着火可用液态二氧化碳灭火 D、发生火险沉着应付,必要时拨打1196. 氧、铁在元素周期表中的信息如图所示。下列表述正确的是( )
蒸发
5. 下列有关燃烧与灭火的说法不正确的是( )A、物质燃烧时伴随着发光、发热 B、吹灭蜡烛的灭火原理是隔绝氧气 C、图书着火可用液态二氧化碳灭火 D、发生火险沉着应付,必要时拨打1196. 氧、铁在元素周期表中的信息如图所示。下列表述正确的是( ) A、氧原子的核内质子数为8 B、铁是地壳中含量最多的金属元素 C、人体中缺少铁元素会导致骨骼疏松 D、不同元素的本质区别是相对原子质量不同7. 已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O。下列有关该反应说法正确的是( )A、X的化学式为NO2 B、反应时仅观察到有气泡产生 C、铜元素化合价由0变为+2 D、消耗的铜和生成的水质量比为3:48. 下列操作能达到实验目的的是( )
A、氧原子的核内质子数为8 B、铁是地壳中含量最多的金属元素 C、人体中缺少铁元素会导致骨骼疏松 D、不同元素的本质区别是相对原子质量不同7. 已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O。下列有关该反应说法正确的是( )A、X的化学式为NO2 B、反应时仅观察到有气泡产生 C、铜元素化合价由0变为+2 D、消耗的铜和生成的水质量比为3:48. 下列操作能达到实验目的的是( )选项
实验目的
主要操作
A
鉴别硬水与软水
取样,加入肥皂水,振荡,比较产生的泡沫多少
B
稀释浓硫酸
将水倒入浓硫酸中并用玻璃棒搅拌
C
测定稀盐酸的pH
将pH试纸插入溶液中,与比色卡对照读数
D
除去NaCl溶液中的Na2CO3
加入适量的Ca(OH)2溶液,搅拌,过滤
A、A B、B C、C D、D9. 如图是NaCl和KNO3两种物质的溶解度曲线。根据信息,下列说法正确的是( ) A、KNO3的溶解度比NaCl的溶解度大 B、20℃时,NaCl饱和溶液的溶质质量分数为36.0% C、50℃时,50g KNO3在50g水中充分溶解,形成不饱和溶液 D、通过加溶剂、升温等方法能将KNO3饱和溶液转化为不饱和溶液10. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如图所示:
A、KNO3的溶解度比NaCl的溶解度大 B、20℃时,NaCl饱和溶液的溶质质量分数为36.0% C、50℃时,50g KNO3在50g水中充分溶解,形成不饱和溶液 D、通过加溶剂、升温等方法能将KNO3饱和溶液转化为不饱和溶液10. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如图所示:
下列说法不正确的是( )
A、整个流程最终实现太阳能转化为电能 B、反应Ⅰ属于分解反应,有三种物质生成 C、反应Ⅱ中催化剂在反应前后质量和化学性质不变 D、反应Ⅲ中发出蓝紫色火焰,产生无色无味的气体二、填空题
-
11. 从下列选项中选择一种适当的物质填空(填字母)。
A.食盐 B.洗洁精 C.碳酸氢铵
(1)、可作调味品的是 。(2)、可作氮肥的是 。(3)、可乳化油污的是 。12. 我国抗击“新冠疫情”卓有成效,为全世界做出了贡献。(1)、“新冠”重症患者需要使用呼吸机提供氧气。下列关于氧气的描述正确的有____。A、氧气能供给呼吸 B、工业上一般采用分离液态空气的方法获得大量氧气 C、“疫情”期间,医用氧气的需求量增大,会使空气中氧气大幅减少(2)、增强体质、做好防护是“抗疫”的有效方法。①戴口罩。制作口罩常用的聚丙烯属于(填“合成”或“金属”)材料。
②测体温。体温计中汞柱上升的微观解释是温度升高,微粒间空隙。
③勤消毒。75%的医用酒精消灭病菌的原理是。
④讲营养。午餐食用米饭、红烧肉、青菜、牛奶,其中富含维生素C的食物是。
13. 我国向世界承诺:到2060年实现“碳中和”。“碳中和”的含义是产生的CO2和消耗的CO2相当,达到相对“零排放”。(1)、实现“碳中和”有利于缓解的环境问题是。(2)、我国科学家使用纳米纤维作催化剂实现了CO2的转化.反应原理如图所示:
①上述物质中属于有机物的是(填序号)。
②反应前后未发生改变的微粒有(填微粒符号)。
(3)、下列做法不利于实现“碳中和”的是____。A、大量燃烧化石燃料 B、植树造林,增大绿化面积 C、利用化学技术捕捉CO2并转化 D、开发、利用清洁能源,如太阳能等14. 金属材料在生产、生活中应用越来越广泛.请回答下列相关问题:(1)、用武德合金制电路保险丝,除导电性外,主要利用其的特性。(2)、常温下,铝和氧气反应,在表面形成一层 , 使其耐腐蚀。(3)、通常在铁栏杆表面喷涂油漆,其防锈原理是。(4)、验证锌、铜、银三种金属活动性强弱的方法有多种。例如:将Zn和Ag两种金属分别放入(填化学式)溶液中即可直接验证。三、综合题
-
15. 化学是一门以实验为基础的科学。根据如图所示的装置,回答问题:
 (1)、图中标有序号①的仪器名称是。(2)、实验室用氯酸钾和二氧化锰制备氧气,反应的化学方程式为。需用一瓶较为纯净的氧气,通常选择的收集装置是(填字母)。(3)、实验室用装置B制取二氧化碳时,可通过的操作来停止反应。16. 草酸是生产、生活中常用的漂白剂,可用于生产抗菌素,可作为提炼稀有气体的溶剂。兴趣小组对草酸受热分解的产物进行如下探究:
(1)、图中标有序号①的仪器名称是。(2)、实验室用氯酸钾和二氧化锰制备氧气,反应的化学方程式为。需用一瓶较为纯净的氧气,通常选择的收集装置是(填字母)。(3)、实验室用装置B制取二氧化碳时,可通过的操作来停止反应。16. 草酸是生产、生活中常用的漂白剂,可用于生产抗菌素,可作为提炼稀有气体的溶剂。兴趣小组对草酸受热分解的产物进行如下探究:【查阅资料】
①草酸(H2C2O4)是一种酸,熔点为101.5℃,易溶于水,易升华,170℃以上分解。
②草酸钙难溶于水。
③无水硫酸铜遇水变蓝。
④碱石灰是生石灰与烧碱的混合固体,能吸收H2O和CO2。
【实验过程】
同学们在老师的指导下设计了如图所示装置,并进行实验(部分夹持仪器已略去)。

【交流与讨论】
(1)、草酸受热分解,应选择图中的(填“甲”或“乙”)装置。 (2)、C装置的作用为。(3)、实验过程中应该先点燃(填“酒精灯”或“酒精喷灯”)。(4)、F装置中反应的化学方程式为。(5)、实验过程中观察到B中白色固体变成蓝色,D中澄清石灰水变浑浊, , 则可以证明草酸分解产物为H2O、CO2和CO。(6)、从环保角度考虑,该套装置的明显缺陷是。17. 过氧化钙(CaO2)是白色或淡黄色粉末,与二氧化碳、水都能反应产生氧气,是一种用途广泛的优良供氧剂。工业上用碳酸钙为原料制备过氧化钙,实验室模拟流程如图:
(2)、C装置的作用为。(3)、实验过程中应该先点燃(填“酒精灯”或“酒精喷灯”)。(4)、F装置中反应的化学方程式为。(5)、实验过程中观察到B中白色固体变成蓝色,D中澄清石灰水变浑浊, , 则可以证明草酸分解产物为H2O、CO2和CO。(6)、从环保角度考虑,该套装置的明显缺陷是。17. 过氧化钙(CaO2)是白色或淡黄色粉末,与二氧化碳、水都能反应产生氧气,是一种用途广泛的优良供氧剂。工业上用碳酸钙为原料制备过氧化钙,实验室模拟流程如图:
已知:
①氯化钙、浓氨水和过氧化氢溶液反应生成NH4Cl和CaO2•8H2O。
②CaO2•8H2O不溶于水,在0℃时稳定,加热至130℃变为无水CaO2。
③CaO2加热至315℃时开始分解。
请根据流程回答下列问题:
(1)、“操作A”常用的步骤有蒸发浓缩、、过滤、洗涤、干燥等。(2)、CaO2在空气中易变质,需要密封保存。CaO2和H2O反应生成氧气和一种碱,该反应的化学方程式为。(3)、“烘干”得到CaO2 , 适宜的温度范围为。(4)、在“酸溶”过程中,10克碳酸钙能与克溶质质量分数为10%的稀盐酸恰好完全反应(写出计算过程)。18. 氢氧化钠是重要的化工原料。某同学对氢氧化钠的性质进行了如下探究:

 (1)、将适量NaOH固体放入刚停止沸腾的水中,观察到水重新沸腾,说明NaOH固体溶解时(填“吸收”或“放出”)热量。(2)、取(1)中的溶液连入图1电路中,闭合开关后,小灯泡发光,说明NaOH溶液具有导电性,NaOH以(填“分子”或“离子”)形式分散在水中。(3)、在盛有NaOH溶液的烧杯中,滴加2~3滴无色酚酞试液,再逐滴加入稀盐酸,边滴加边用玻璃棒搅拌,当溶液颜色刚好时,稀盐酸和NaOH溶液恰好完全反应。(4)、按图2所示进行实验,将H2O和NaOH溶液同时全部注入集气瓶中,观察到U形管内液面 , 说明CO2和NaOH可以发生反应。(5)、探究NaOH溶液和FeSO4溶液的反应
(1)、将适量NaOH固体放入刚停止沸腾的水中,观察到水重新沸腾,说明NaOH固体溶解时(填“吸收”或“放出”)热量。(2)、取(1)中的溶液连入图1电路中,闭合开关后,小灯泡发光,说明NaOH溶液具有导电性,NaOH以(填“分子”或“离子”)形式分散在水中。(3)、在盛有NaOH溶液的烧杯中,滴加2~3滴无色酚酞试液,再逐滴加入稀盐酸,边滴加边用玻璃棒搅拌,当溶液颜色刚好时,稀盐酸和NaOH溶液恰好完全反应。(4)、按图2所示进行实验,将H2O和NaOH溶液同时全部注入集气瓶中,观察到U形管内液面 , 说明CO2和NaOH可以发生反应。(5)、探究NaOH溶液和FeSO4溶液的反应【进行实验1】该同学将NaOH溶液滴入盛有FeSO4溶液的试管中,观察到有白色沉淀生成,短时间内即变为红褐色。
【查阅资料】FeSO4+2NaOH═Na2SO4+Fe(OH)2↓(白色);
Fe(OH)2容易被氧气氧化:4Fe(OH)2+O2+2H2O═4Fe(OH)3(红褐色)。
【提出问题】如何使白色沉淀长时间存在?
【进行实验2】改进实验装置如图3所示,观察到白色沉淀存在时间较长。
【交流反思1】装置中煤油的作用是。
(6)、【发现问题】上述白色沉淀放置一段时间后,又转化为红褐色沉淀。【进行实验3】分析原因后,再次改进实验装置如图4所示,打开止水夹K1、K2;一段时间后,关闭K1 , 具支试管B中出现白色沉淀,待液面稳定后关闭K2 , 所得白色沉淀能保持更长时间。
【交流反思2】①具支试管A中发生反应的化学方程式为。
②H2的作用有:
a.排出装置中溶液上方的空气;
b.;
c.将A中溶液压入B中。
【归纳总结】NaOH溶于水,水溶液能导电,显碱性,能与非金属氧化物、酸和盐等物质发生反应。