辽宁省六校协作体2021-2022学年高三下学期期初考试化学试题
试卷更新日期:2022-03-10 类型:开学考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 化学与生活密切相关。下列说法错误的是( )A、液氨可用作制冷剂 B、漂白粉可用于游泳池等场所的消毒 C、聚乙炔可通过加聚反应制得,可用作绝缘材料 D、2022年北京冬奥会速滑服的主要成分聚氨酯为有机高分子材料2. 下列化学用语使用正确的是( )A、甲醛的电子式
 B、硫原子的价电子排布式 3s23p4
C、中子数为18的氯原子
D、明矾的化学式 Al2(SO4)3
3. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、1L1mol•L-1 NH4Br水溶液中NH4+与H+离子数之和大于NA B、18g重水(D2O)中含有的质子数为10NA C、Na2O2与水反应时,生成0.1mol氧气转移的电子数为0.4NA D、常温常压下,1 mol P4中所含P—P键数目为4NA4. 氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm,下列说法正确的是( )
B、硫原子的价电子排布式 3s23p4
C、中子数为18的氯原子
D、明矾的化学式 Al2(SO4)3
3. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、1L1mol•L-1 NH4Br水溶液中NH4+与H+离子数之和大于NA B、18g重水(D2O)中含有的质子数为10NA C、Na2O2与水反应时,生成0.1mol氧气转移的电子数为0.4NA D、常温常压下,1 mol P4中所含P—P键数目为4NA4. 氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm,下列说法正确的是( ) A、氮化钼的化学式为MoN2 B、相邻两个最近的N原子的距离为nm C、晶体的密度 D、每个钼原子周围与其距离最近的钼原子有12个5. 下列有关常见元素及其化合物的说法正确的是( )A、工业上用氯气与澄清石灰水反应制备漂白粉 B、金属钠具有强还原性,可用金属钠和TiCl4溶液反应制备金属Ti C、镁是国防金属,工业上采用电解熔融氧化镁的方法获得镁单质 D、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化作用6. 下列有关实验装置的用途叙述正确的是( )
A、氮化钼的化学式为MoN2 B、相邻两个最近的N原子的距离为nm C、晶体的密度 D、每个钼原子周围与其距离最近的钼原子有12个5. 下列有关常见元素及其化合物的说法正确的是( )A、工业上用氯气与澄清石灰水反应制备漂白粉 B、金属钠具有强还原性,可用金属钠和TiCl4溶液反应制备金属Ti C、镁是国防金属,工业上采用电解熔融氧化镁的方法获得镁单质 D、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化作用6. 下列有关实验装置的用途叙述正确的是( )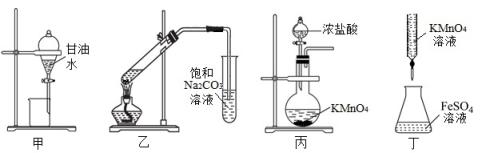 A、甲装置用于分离甘油和水 B、乙装置用于实验室制备乙酸乙酯 C、丙装置用于实验室制备氯气 D、丁装置用于滴定未知浓度的FeSO4溶液7. 下列说法正确的是( )A、能使pH试纸显红色的溶液中:K+、Na+、CO32-、NO3- 一定能大量共存 B、室温下由水电离出的c(H+)=1×10-13mol/L的溶液中:Cl-、NH4+、Na+、S2O32-
A、甲装置用于分离甘油和水 B、乙装置用于实验室制备乙酸乙酯 C、丙装置用于实验室制备氯气 D、丁装置用于滴定未知浓度的FeSO4溶液7. 下列说法正确的是( )A、能使pH试纸显红色的溶液中:K+、Na+、CO32-、NO3- 一定能大量共存 B、室温下由水电离出的c(H+)=1×10-13mol/L的溶液中:Cl-、NH4+、Na+、S2O32-一定不能大量共存
C、向AgNO3溶液中滴加过量氨水,离子方程式:Ag++NH3·H2O= AgOH↓+NH4+ D、Na2S溶液显碱性的原因:S2- +2H2O = H2S↑+2OH-8. 化合物X是一种医药中间体,其结构如图所示。下列有关化合物X的说法正确的是( ) A、分子中两个苯环一定处于同一平面 B、1mol该物质最多可与8molH2发生加成反应 C、1mol化合物X最多能与反应 D、在酸性条件下水解,水解产物只有一种9. 下列关于化学反应速率的说法正确的是( )A、决定化学反应速率的主要因素有温度、浓度、压强和催化剂 B、增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 C、对于放热的可逆反应,升高温度,逆反应速率加快,正反应速率减慢 D、从酯化反应体系中分离出水,反应速率减慢,但有利于提高酯的产率10. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2 , Y、W最外层电子数相同。下列说法错误的是( )A、第一电离能:W>X>Y>Z B、简单离子的半径:W>X>Y>Z C、Y的氢化物水溶液可腐蚀玻璃 D、元素W和X的某些单质均可作为水处理中的消毒剂11. 镍镉电池是二次电池,其放电过程的工作原理如下。下列说法错误的是( )
A、分子中两个苯环一定处于同一平面 B、1mol该物质最多可与8molH2发生加成反应 C、1mol化合物X最多能与反应 D、在酸性条件下水解,水解产物只有一种9. 下列关于化学反应速率的说法正确的是( )A、决定化学反应速率的主要因素有温度、浓度、压强和催化剂 B、增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 C、对于放热的可逆反应,升高温度,逆反应速率加快,正反应速率减慢 D、从酯化反应体系中分离出水,反应速率减慢,但有利于提高酯的产率10. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2 , Y、W最外层电子数相同。下列说法错误的是( )A、第一电离能:W>X>Y>Z B、简单离子的半径:W>X>Y>Z C、Y的氢化物水溶液可腐蚀玻璃 D、元素W和X的某些单质均可作为水处理中的消毒剂11. 镍镉电池是二次电池,其放电过程的工作原理如下。下列说法错误的是( )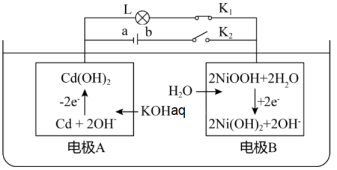 A、断开K2、合上K1 , 电极A为负极,发生氧化反应 B、断开K1、合上K2 , 镍镉电池能量转化形式为:电能→化学能 C、充电时B电极反应式为2Ni(OH)2+2e-+2OH-=2NiOOH+2H2O D、镍镉二次电池的总反应式:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)212. 根据下列实验操作和现象得出的结论正确的是( )
A、断开K2、合上K1 , 电极A为负极,发生氧化反应 B、断开K1、合上K2 , 镍镉电池能量转化形式为:电能→化学能 C、充电时B电极反应式为2Ni(OH)2+2e-+2OH-=2NiOOH+2H2O D、镍镉二次电池的总反应式:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)212. 根据下列实验操作和现象得出的结论正确的是( )编号
实验操作
实验现象
解释与结论
A
常温下,等体积等pH的HA、HB两种酸溶液分别与足量的锌反应
相同时间内,HB收集到的H2多
酸性强弱:HA > HB
B
将炽热的木炭加入到浓硝酸中
产生红棕色气体
木炭与浓硝酸反应生成NO2
C
向盛有2mL 0.1mol/L AgNO3溶液的试管中滴加几滴0.1mol/L NaCl溶液,再向其中滴加0.1mol/L KI溶液
先得到白色沉淀后变为黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
向1mL 0.5 mol/L KI溶液加入1mL 1mol/LFeCl3溶液,充分反应后向水层滴加KSCN溶液
溶液变红
Fe3+与I-反应是可逆反应
A、A B、B C、C D、D13. 根据下列图示所得出的结论错误的是( )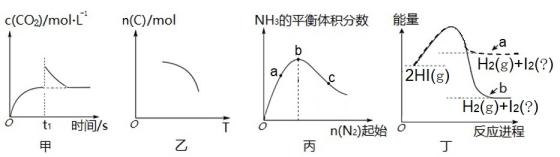 A、图甲是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化曲线,t1时刻改变的条件可能是缩小容器的体积 B、图乙是密闭容器中发生aA(g)+bB(g) cC(g)反应,C的平衡物质的量与温度的关系,则该反应焓变∆H<0 C、图丙是恒温密闭容器中发生N2(g)+3H2(g) 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>a>c D、图丁是HI(g)分解反应能量与反应进程关系曲线,a、b中I2的状态分别为气态、固态14. 对氨基苯甲酸(
A、图甲是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化曲线,t1时刻改变的条件可能是缩小容器的体积 B、图乙是密闭容器中发生aA(g)+bB(g) cC(g)反应,C的平衡物质的量与温度的关系,则该反应焓变∆H<0 C、图丙是恒温密闭容器中发生N2(g)+3H2(g) 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>a>c D、图丁是HI(g)分解反应能量与反应进程关系曲线,a、b中I2的状态分别为气态、固态14. 对氨基苯甲酸(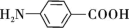 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(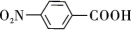 )为原料,采用电解法合成对氨基苯甲酸的装置如图。
)为原料,采用电解法合成对氨基苯甲酸的装置如图。
下列说法错误的是( )
A、b为直流电源正极 B、少量气体X为H2 C、质子交换膜中H+由左向右迁移 D、阴极的主要电极反应式为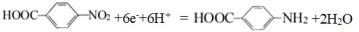 15. 25℃,向20 mL 0.1 mol·L-1的H3PO2溶液中滴加0.1 mol·L-1的NaOH溶液直至过量,滴定曲线如图1,所有含磷微粒的分布系数δ随pH变化关系如图2,则下列说法错误的是( )
15. 25℃,向20 mL 0.1 mol·L-1的H3PO2溶液中滴加0.1 mol·L-1的NaOH溶液直至过量,滴定曲线如图1,所有含磷微粒的分布系数δ随pH变化关系如图2,则下列说法错误的是( )[如H2PO2-的分布系数: ]
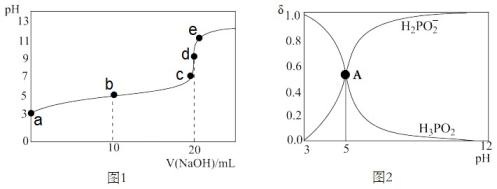 A、H3PO2为一元弱酸,电离常数Ka约为1×10-5 B、水的电离程度按a、b、c、d、e顺序依次增大 C、当混合溶液pH=7时,c(H2PO2-) > c(H3PO2) D、b点溶液中存在关系2c(H+)+c(H3PO2) =2c(OH-)+c(H2PO2-)
A、H3PO2为一元弱酸,电离常数Ka约为1×10-5 B、水的电离程度按a、b、c、d、e顺序依次增大 C、当混合溶液pH=7时,c(H2PO2-) > c(H3PO2) D、b点溶液中存在关系2c(H+)+c(H3PO2) =2c(OH-)+c(H2PO2-)二、非选择题:本题共4小题,共55分。
-
16. 三氧化二钴(Co2O3)常用作催化剂、氧化剂及制滤光眼镜的添加剂等。工业上以含钴废料(主要成分为CoO、Co2O3 , 含有少量MnO2、NiO、Fe2O3杂质)为原料制备Co2O3的流程如下图所示:
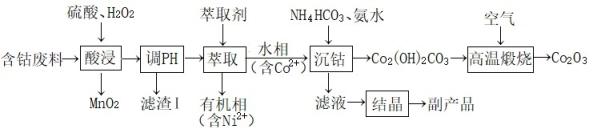
已知:“酸浸”后的浸出液中含的金属阳离子主要有Co2+、Fe3+、Ni2+。
回答下列问题:
(1)、含钴废料“酸浸”前要研磨处理,其目的是。(2)、“酸浸”时加入H2O2作(填“氧化剂”或“还原剂”)。生产过程中发现实际消耗双氧水的量大于理论值,主要原因可能。
(3)、“滤渣1”的主要成分为。(4)、某萃取剂对金属离子的萃取率与溶液pH的关系如图所示,使用该萃取剂时应控制的pH约为(填选项)。
a.2 b. 3 c.4 d.5
(5)、“沉钴”步骤反应的离子方程式。(6)、“结晶”得到的主要副产品是。(7)、“高温煅烧”发生反应化学方程式为。17. 氮化钙(Ca3N2)是一种重要的化学试剂,具有耐高温、导热性好等优良性质,被广泛应用于新型陶瓷工业等领域。实验室拟用单质钙与氮气反应制备氮化钙,并测定产品纯度。已知氮化钙为棕色固体,在空气中会被氧化,遇水强烈水解,产生刺激性气味气体。(1)、Ⅰ氮化钙的制备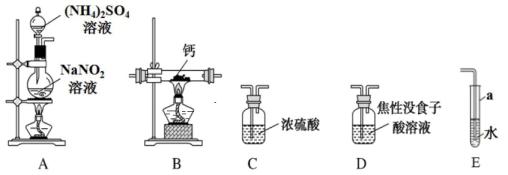
装置中反应生成N2 , 离子方程式为。
(2)、装置B中玻璃仪器为酒精灯、。(3)、选用上图中的装置制备氮化钙,其连接顺序为:A→ (注:焦性没食子酸有还原性、图中装置可重复选用)。(4)、装置A中生成N2的作用为:①作为反应物与钙反应生成Ca3N2; ②。
(5)、Ⅱ.产品纯度的测定用如下装置测定产品纯度。实验时,打开分液漏斗活塞,加入浓溶液,至不再产生气体,测得装置反应后增重3.4g(已知Ca3N2摩尔质量为148g/mol,产品中所含的杂质不与NaOH浓溶液反应)。

装置M中发生反应的化学方程式为。
(6)、根据实验数据计算产品的纯度为。(7)、通过该实验方案测得的产品纯度偏低,请分析主要原因为。18. 2021年3月5日,国务院政府工作报告中指出,扎实做好碳达峰、碳中和各项工作。为了达到碳中和,研发二氧化碳的利用技术成为热点。(1)、利用反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH,可减少CO2排放并合成清洁能源。该反应一般认为通过如下步骤来实现:① CO2(g)+H2(g) H2O(g)+CO (g) ΔH1=+41 kJ·mol-1
② CO(g)+2H2 (g) CH3OH(g) ΔH2=-90 kJ·mol-1
总反应的ΔH =kJ·mol-1
若反应①为慢反应,下图中能体现上述反应能量变化的是 (填标号)。
 (2)、500 ℃时,在容积为2 L的密闭容器中充入3 mol CO2和8 mol H2 , 发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得5 min时,反应达到平衡,此时n(CO2)=1.0 mol。从反应开始到平衡,H2的平均反应速率v(H2)=;该可逆反应的平衡常数为。(3)、科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2 转化为HCOOH,实现碳中和的目标。原理如图所示:
(2)、500 ℃时,在容积为2 L的密闭容器中充入3 mol CO2和8 mol H2 , 发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得5 min时,反应达到平衡,此时n(CO2)=1.0 mol。从反应开始到平衡,H2的平均反应速率v(H2)=;该可逆反应的平衡常数为。(3)、科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2 转化为HCOOH,实现碳中和的目标。原理如图所示:
①P极电极反应式为。
②已知CO2(g)+H2(g) HCOOH(g) △H = -31.4 kJ·mol-1 。温度为T1℃时, K=2。实验测得:v正=k正c(CO2) c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=k逆;若温度为T2℃时,k正=1.9k逆 , 则T2T1(填“>”、“<”或“=”)。
19. 一种药物的中间体的一种合成路线如下:(已知:Ac为乙酰基)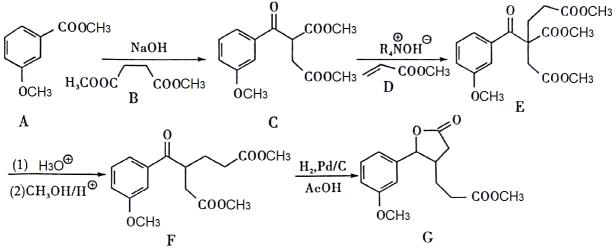
回答下列问题:
(1)、D中官能团的名称有。(2)、G的分子式为。(3)、C→E的反应类型是。(4)、A→C的化学方程式是。(5)、A的同分异构体中,能同时满足以下四个条件的有种(不考虑立体异构)。①能与FeCl3显紫色 ②能发生银镜反应 ③能发生水解反应 ④苯环上有两个取代基
其中核磁共振氢谱中有6组峰,且峰面积比为2∶2∶2∶2∶1∶1的结构简式:。
(6)、结合题中信息,以 与
与 及必要的无机物和有机试剂为原料,合成
及必要的无机物和有机试剂为原料,合成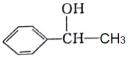 的路线如下:
的路线如下:
写出M的结构简式:。